人參皂苷抗腫瘤活性與機制研究進展
王永宏,艾芷伊,張俊順,胡 月,劉思彤,劉永哲,王玉華, ,南 博,
(1.吉林農業大學食品科學與工程學院,吉林長春 130000;2.吉林省食品生物制造科技創新中心,吉林農業大學,吉林長春 130000)
人參(Panax ginsengC A Meyer)是我國傳統的天然滋補健康食材,含有多種生物活性成分,包括人參皂苷、多糖、生物堿、有機酸、黃酮和揮發油等[1]。其中,人參皂苷是人參中最重要的活性成分,具有廣泛的生物學功效,如提高免疫力[2]、護肝[3]、神經保護[4]、抗炎[5]、抗腫瘤[6]等。腫瘤是世界范圍內常見的危害人民生命健康的疾病,發病率和死亡率高,是全球第二大死亡原因[7]。根據世衛組織統計的數據,僅2018年就約有960萬人死于惡性腫瘤,其中,中國惡性腫瘤患病人數達428萬,死亡人數更是占世界總死亡人數的三分之一,惡性腫瘤給社會和家庭造成了巨大負擔[8]。目前惡性腫瘤的主要治療手段是手術和放化療[9],但手術治療效果不佳且部分晚期患者發病時已不具備手術條件,放化療容易引起嚴重的毒副作用[10]。目前,大量研究結果表明人參總皂苷及單體對抑制腫瘤細胞增殖、促進腫瘤細胞凋亡、抑制腫瘤細胞轉移和侵襲、阻斷腫瘤血管生成、增強機體免疫能力、抗氧化應激及與化療藥物協同增效等方面具有重要作用,本文就人參皂苷的抗腫瘤活性與機制研究進展進行了系統闡述。
1 人參皂苷分類及其抗腫瘤活性
人參皂苷由皂苷元和糖基連接形成,根據皂苷元的不同,人參皂苷分為四環三萜類達瑪烷型、五環三萜類齊墩果酸型人參皂苷,其中,瑪烷型人參皂苷根據皂苷元上C-6鍵位上是否有羥基分為原人參二醇型和原人參三醇型[11]。
1.1 原人參二醇型人參皂苷
原人參二醇型人參皂苷的皂苷元是原人參二醇(protopanaxadiol, PPD),按照C-20位構型的不同,可將其分為20(S)-和20(R)-原人參二醇,化學結構見圖1a。目前已被證實具有抗腫瘤活性的原人參二醇型人參皂苷有Rb1[12]、Rb2[13]、Rc[14]、Rd[15]、Rg3[16]、Rg5[17]、Rh2[18]、Rk1[19]、CK[20]和F2[21]等。其中,人參皂苷Rg3和Rh2的研究最為廣泛,已被證實對多種惡性腫瘤如胰腺癌和黑色素瘤等具有較好的治療效果[22-25]。以人參皂苷Rg3為主要功能成分的參一膠囊已經用于臨床上非小細胞肺癌和消化系統腫瘤的治療[26-27]。
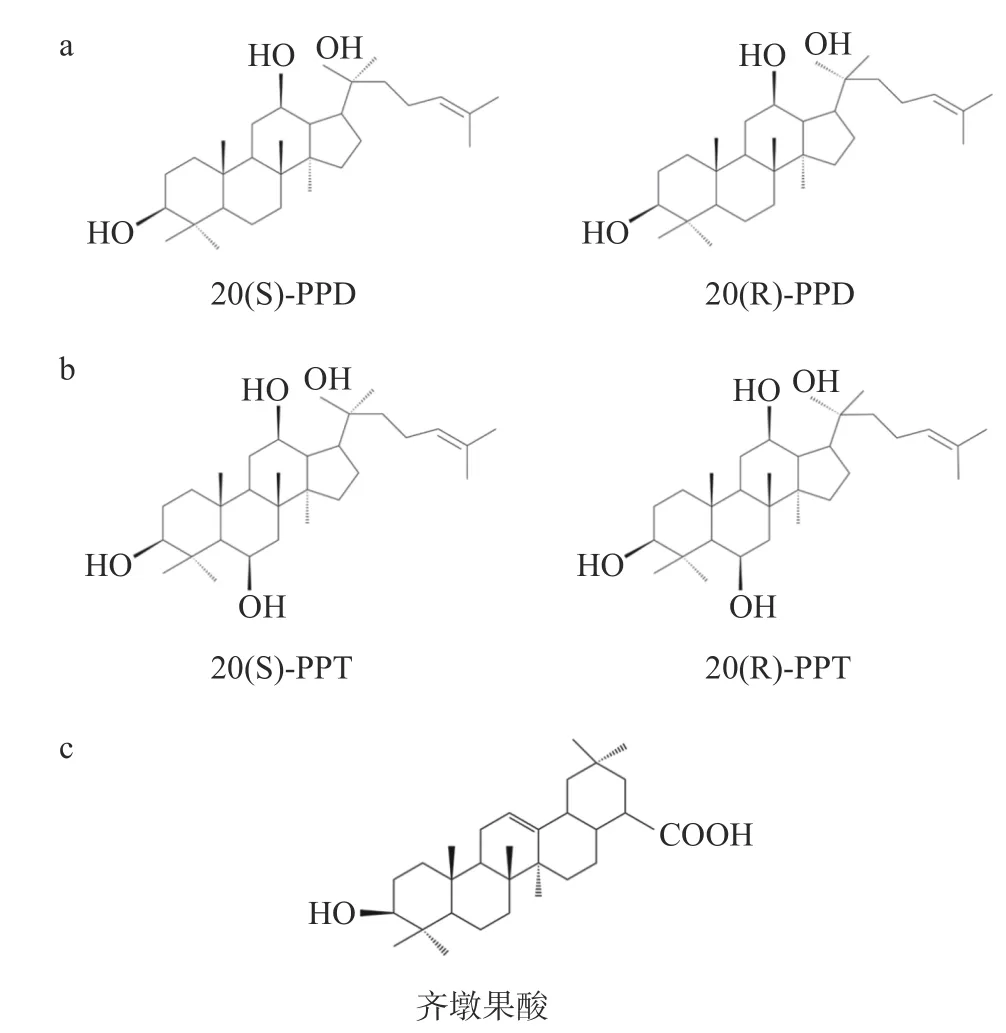
圖 1 人參皂苷的化學結構式Fig.1 Chemical structure of ginsenosides
1.2 原人參三醇型人參皂苷
原人參三醇型人參皂苷的皂苷元是原人參三醇(protopanaxatriol, PPT),按C-20位構型的不同,可將其分為20(S)-和20(R)-原人參三醇,化學結構見圖1b。目前已被證實具有抗腫瘤活性的原人參二醇型人參皂苷有Re[28]、Rf[29]、Rg1[30]、Rh1[31]和Rh4[32]等。
1.3 齊墩果酸型人參皂苷
齊墩果酸型人參皂苷的皂苷元為齊墩果酸,化學結構見圖1c,在齊墩果酸的 C-3 和 C-28 位上與不同的糖基相連形成不同的齊墩果酸型人參皂苷。齊墩果酸已被證明可抑制多種腫瘤,包括肝癌、肺癌等[33-34]。目前,從人參中提取出的齊墩果酸型人參皂苷較少,其中,研究最多的是人參皂苷Ro。有研究表明人參皂苷Ro在小鼠體內能夠抑制腫瘤生長,是基于人參皂苷Ro代謝物的生物活性[35],研究人員從人參皂苷Ro干預的荷瘤裸鼠血清中檢測到許多人參皂苷Ro的代謝產物,如竹節參皂苷Iva,齊墩果酸葡萄糖基酯等,目前竹節參皂苷Iva的抗腫瘤活性在多種腫瘤如結直腸癌、肝癌和卵巢癌中被證實[36-38],齊墩果酸葡萄糖基酯的抗腫瘤活性還未見報道。
2 人參皂苷抗腫瘤機制
2.1 人參皂苷抑制腫瘤細胞增殖
細胞增殖是腫瘤生長和發展的基礎,調控細胞周期是控制細胞增殖的重要機制。細胞周期是指細胞從一次分裂完成到下一次分裂結束所經歷的全過程,分為G0、G1、S、G2和M期[39-40]。多種人參皂苷被證實可以通過調控周期蛋白的表達破壞細胞周期轉換進而抑制腫瘤細胞的增殖。Wu等[41]使用人參皂苷Rh4處理人直腸癌HCT-116細胞,蛋白免疫印跡實驗結果發現Rh4的處理增加了細胞周期蛋白依賴性激酶抑制劑(Cyclin-dependent kinase inhibitor,CKI)蛋白中p53、p21和p27的表達水平,并且呈劑量依賴性降低細胞周期蛋白依賴性激酶(Cyclindependent kinase, CDK)1和CDK4的表達,將細胞周期阻滯在G0/G1期,抑制細胞增殖。Shangguan等[29]的研究表明人參皂苷Rf干預人骨肉瘤MG-63細胞后,可通過降低CDK1和細胞周期蛋白(Cyclin)B1的蛋白質和mRNA水平將細胞阻滯在G2/M期。綜上所述,人參皂苷可通過調節腫瘤細胞中Cyclin、CDK和CKI蛋白的表達,誘導細胞周期阻滯以抑制腫瘤細胞的增殖(表1)。
2.2 人參皂苷誘導腫瘤細胞凋亡
細胞凋亡是指細胞在特定基因的控制下,受到多個基因嚴格控制而發生的自動死亡過程[42]。誘導細胞凋亡是消除腫瘤細胞的有效治療方法。研究表明人參皂苷可以激活內源性線粒體凋亡途徑和外源性死亡受體途徑誘導細胞凋亡。Wu等[41]研究發現人參皂苷Rh4可以激活HCT-116細胞中的ROS/JNK/p53信號通路,上調內源性線粒體凋亡途徑中的促凋亡蛋白Bax的表達,增加線粒體中的細胞色素c向細胞漿中的釋放,增加胞漿中Cleaved Caspase-3/-9的水平,降低抗凋亡蛋白Bcl-2的表達,由此證實內源性線粒體凋亡途徑被激活;同時發現Rh4的干預降低了外源性死亡受體途徑中Fas的表達水平并增加了Cleaved Caspase-8的表達水平,說明外源性死亡受體途徑也參與了細胞凋亡的調節。綜上所述,人參皂苷能夠通過激活內源性線粒體凋亡途徑和外源性死亡受體途徑,調節細胞凋亡相關蛋白的表達,誘導腫瘤細胞凋亡(表1)。
2.3 人參皂苷抑制腫瘤細胞侵襲和遷移
腫瘤細胞的侵襲和遷移是導致腫瘤惡化的重要原因,是深入研究人參皂苷抗腫瘤作用的主要方向[43]。Phi等[44]研究使用人參皂苷Rd干預腸癌HT29細胞以觀察Rd對細胞遷移的作用,結果發現Rd通過抑制EGFR/Sox2信號軸和下調上皮間質轉化(Epithelial-mesenchymal transition, EMT)標志物的表達以控制HT29細胞在體內和體外的遷移潛能。Kim等[45]證實Rg3通過調控人肺癌A549細胞中TGFβ1信號通路抑制EMT過程進而阻止肺癌細胞侵襲和遷移。基質蛋白金屬酶(Matrix protein metalloenzymes, MMPs)是調控腫瘤細胞侵襲和遷移的調控因子[46],Jung等[47]研究了人參皂苷Rh1對人星形膠質瘤U87MG和U373MG細胞中MMPs家族蛋白表達的影響,結果分析表明,Rh1的干預通過調控MAPK和PI3K/Akt信號通路和其下游轉錄因子如NF-κB和AP-1以抑制MMP-1、-3和-9的蛋白表達以及酶活性,通過傷口愈合實驗和Matrigel侵襲實驗證實Rh1能有效抑制U87MG和U373MG細胞的侵襲和遷移。綜上所述,人參皂苷通過多種信號通路抑制EMT過程,降低MMPs家族蛋白的表達水平和活性,從而抑制細胞侵襲和遷移(表1)。
2.4 人參皂苷阻斷腫瘤血管生成
血管生成是指從現有血管形成新血管的過程,是腫瘤生長和轉移的重要組成部分,廣泛分布的血管網絡向腫瘤輸送氧氣和營養物質以及清除腫瘤的代謝廢物[48-49],因此阻斷血管生成是腫瘤治療和預防的重要途徑。研究證明多種人參皂苷能通過不同途徑調控不同分子進而阻斷血管生成。Zhang等[50]研究了人參皂苷Rd對血管生成的影響,結果發現Rd以劑量依賴性的方式抑制人臍血管內皮細胞中血管內皮生長因子(Vascular endothelial growth factor, VEGF)誘導的血管生成,抑制體內基質膠栓塞測定中的血管生成,進一步研究發現Rd通過抑制乳腺癌MDAMB-231細胞中Akt/mTOR/p70S6K信號通路以降低缺氧誘導因子1α(Hypoxia-inducible factor-1α,HIF-1α)和VEGF的表達,進而抑制裸鼠的腫瘤血管生成。Zeng等[51]探討了人參皂苷Rg3在白血病患者體內的抗血管生成作用,使用Rg3處理白血病患者的骨髓基質細胞,結果發現Rg3抑制了細胞中HIF-1α和 VEGF 的 mRNA 和蛋白表達,此外 Rg3的治療導致患者血清中的HIF-1α和VEGF水平降低。色素上皮衍生因子(Pigment epithelium-derived factor, PEDF)是一種抗血管生成蛋白,Leung等[52]研究發現人參皂苷Rb1顯著促進了人臍靜脈內皮細胞(Human umbilical vein endothelial cells, HUVECs)中PEDF的轉錄、蛋白表達和分泌,而對PEDF進行靶向抑制則阻斷了Rb1的作用,這表明Rb1的抗血管生成作用是特異性靶向PEDF。綜上所述,人參皂苷可通過促進抗血管生成蛋白的表達,抑制生長因子來阻斷血管生成(表1)。
2.5 人參皂苷增強機體免疫能力
免疫系統在維持機體健康方面發揮著及其主要的作用,現代腫瘤免疫學認為,免疫系統在監視和清除腫瘤中起到重要作用[53]。T細胞是免疫系統最重要的組成成分[54],Park等[55]研究發現人參皂苷Rg3通過刺激ConA誘導T細胞增殖,提高小鼠免疫器官和血清中細胞因子(IL-2、IFN-γ)的水平,增強免疫活性,抑制荷瘤小鼠的腫瘤生長。NK細胞可通過釋放細胞因子等方式殺傷腫瘤細胞,維持T細胞的功能和增強免疫檢查點治療的功效[56],Kwon等[57]探究了人參皂苷F1在NK細胞的腫瘤監測中的作用,研究結果表明F1的干預有效增強了NK細胞對多種激活受體和腫瘤細胞的細胞毒性,還改善了依賴NK細胞活性的淋巴瘤清除和轉移性黑色素瘤小鼠模型的腫瘤監測。阻斷免疫檢查點已在臨床實踐中用于治療腫瘤,PD-L1/PD-1通路是最關鍵的免疫檢查點[58]。Hu等[59]使用人參皂苷Rk1處理肺癌A549和PC9細胞,結果顯示Rk1通過抑制NF-κB信號轉導降低了細胞中PD-L1的高表達。綜上所述,人參皂苷通過誘導免疫細胞增殖,增強免疫反應和調控免疫檢查點發揮抗腫瘤作用(表1)。
2.6 人參皂苷抗氧化應激
研究發現,氧化應激可介導細胞中原癌基因和抑癌基因的激活和失活,導致細胞異常生長發展成為腫瘤[60]。人參皂苷在抗氧化應激和治療由氧化應激介導的疾病中發揮著重要的作用。Zhou等[61]研究了人參皂苷Rb1對氧化應激造成的炎癥損傷的影響及分子機制,結果表明對HUVECs使用Rb1處理可減輕由TNF-α誘導引起的氧化應激和炎癥損傷,進一步研究表明Rb1通過激活P38和JNK信號通路來抑制 NF-κB 通路,抑制 TNF-α誘導 ROS 和 MDA的產生,增加SOD、CAT和GSH-Px的活性,從而保護細胞免受氧化應激和細胞炎癥因子誘導的炎癥損傷。Li 等[62]研究了人參皂苷 Rg1 在心肌細胞 H9c2細胞氧化應激損傷中的作用,實驗結果發現Rg1通過提高激活細胞中細胞內Nrf2/HO-1軸,抑制JNK信號通路,提高SOD、GSH-Px和GSH的水平來降低ROS誘導的氧化應激。Liu等[63]使用人參皂苷Rd干預從Sprague-Dawley大鼠幼崽分離的海馬神經元細胞,結果發現Rd通過降低細胞中ROS和MDA水平,提高SOD和GSH-Px水平,顯著改善了由淀粉樣蛋白β25-35誘導的氧化應激損傷。綜上所述,人參皂苷作為一種保護劑,通過減少氧化應激和氧化應激對細胞的損傷來平衡細胞內的微環境,從而在源頭上降低患癌的可能性(表1)。

表 1 人參皂苷的抗腫瘤機制Table 1 Antitumor mechanism of ginsenosides
2.7 人參皂苷與化療藥物協同增效
腫瘤患者在放化療后會產生一定的副作用,長期大劑量用藥會導致許多腫瘤細胞產生多藥耐藥性[64],因此開發新的治療策略以減少副作用和逆轉多藥耐藥性顯得尤為緊迫。有研究報道證實人參皂苷與現有放化療藥物聯合使用具有許多優勢,如提高抗腫瘤效果、減少副作用和降低用藥劑量以及逆轉多藥耐藥性[65-67]。生曬參是一種人參熱加工的產物,Lin等[68]發現將生曬參與表柔比星和紫杉醇聯合使用后增加了兩種藥物在人宮頸癌HeLa細胞、人結直腸癌SW111C細胞和SW480細胞中的引起細胞凋亡的能力。Zhu等[69]報道表明從人參中提取的總人參皂苷與環磷酰胺聯合使用后促進了環磷酰胺的治療作用,具體表現為延長存活率、增強腫瘤生長抑制率和細胞凋亡,進一步的研究證實,總人參皂苷促進了腸道益生菌的繁殖,減輕了環磷酰胺誘導的腸道黏膜炎,這些作用與總人參皂苷激活Nrf2并抑制NF-κB通路有關。此外,Jiang等[70]研究了人參皂苷Rg3對減弱順鉑耐藥誘導的PD-L1表達的作用,結果發現Rg3通過下調NF-κB p65和Akt信號通路以抑制順鉑耐藥誘導的PD-L1的表達,并提高了T細胞對肺癌A549細胞和A549/DDP耐藥細胞的抑制作用。綜上所述,人參皂苷與化療藥物聯用具有良好的協同作用,可提高化療藥物療效,降低副作用,逆轉腫瘤細胞的多藥耐藥性(表1)。
3 總結與展望
人參皂苷的抗腫瘤活性是通過不同機制實現的,包括抑制腫瘤細胞增殖、誘導腫瘤細胞凋亡、抑制腫瘤細胞侵襲和轉移、阻斷腫瘤血管生成、增強機體免疫系統、抵抗氧化應激以及與化療藥物的協同作用等。目前僅有少數人參皂苷已經應用于臨床治療,大部分人參皂苷的研究僅局限于細胞及動物試驗層面,極少進行臨床試驗,未被完全開發利用,并且關于人參皂苷與放化療藥物聯合使用對于腫瘤治療效果的臨床研究仍較少。隨著腫瘤患病率的不斷提高,抗腫瘤藥物的研發成為臨床和科研工作者研究的重中之重。人參皂苷在腫瘤的發生、發展和轉移等多個過程中可以進行調控,顯示出較強的抗腫瘤潛力。作為一種天然的抗腫瘤藥物,人參皂苷和由人參開發的功能性食品會對腫瘤的治療和預防發揮越來越重要的作用。本文通過對人參皂苷的抗腫瘤活性和機制進行總結,以期對人參皂苷抗腫瘤的深入研究提供參考,同時為人參抗腫瘤功能性食品開發提供了理論基礎。

