一株產中性蛋白酶菌株的篩選及其發酵產酶條件優化
李 娜,附俊杰,劉 軍,溫雪瓶,李 麗,2,
(1.四川輕化工大學生物工程學院,四川宜賓 644000;2.固態發酵資源利用四川省重點實驗室,四川宜賓 644000)
蛋白質是體內重要的營養物質。攝入的蛋白質在胃腸道中被蛋白酶和肽酶降解,被吸收為小肽或游離氨基酸[1]。小肽比氨基酸更易被吸收,且具有增強免疫、抗氧化、抗菌、降血脂等多種生物學功能,被廣泛應用于食品和飼料生產中[2-4]。含蛋白質的農業副產物對生物活性肽的生產越來越具有吸引力,這有助于廢物的利用和價值的提高,如豆粕,菜粕,棉粕,花生粕等[5]。這些肽序列在含有完整的母蛋白序列時不顯示任何生物活性,因此首先必須水解,一般是通過與一種或多種蛋白酶酶解、發酵或兩者結合而催化水解。在發酵過程中,發酵底物中蛋白質的分子結構、空間結構效應以及理化性質會發生變化,產生獨特的功能肽,如鮮味肽、抗菌肽[6-8]。但發酵效果易受微生物種類和所用發酵工藝的影響,乳酸菌、酵母菌在豆粕、菜粕脫毒和提升風味中效果顯著,但由于其蛋白酶活低,使得豆粕、菜粕中的蛋白不能有效轉化[9],菌酶協同是一種好的方式[10]。外源添加蛋白酶提高小肽的含量的同時,還可有效降低蛋白原料中的過敏原[11]。
中性蛋白酶具有催化速度快、催化過程溫和、無污染等優點,常被用于食品、藥品、飼料行業[12]。中性蛋白酶產生的游離氨基酸類型豐富,制備呈味肽的效果優于風味蛋白酶,其產生的不益物質以及水解度要比風味蛋白酶低,因此中性蛋白酶用于發酵工藝可以降低酶的用量并提高原料的回收率[13-14]。蛋白質是微生物產蛋白酶主要的底物來源,植物源蛋白可作為蛋白酶及多肽生產的潛在底物,如中性蛋白酶酶解紅花籽粕制備抗氧化肽,酶解大豆粕蛋白制備小分子肽[15-16]。
植物源蛋白的應用逐漸成為當今研究的熱點,我國非傳統蛋白資源非常豐富,包括農產品加工副產物、糟粕類、植物及其加工副產物等,這些植物源蛋白的利用有助于減少酶或多肽的生產成本,同時也會獲得多種活性功能的多肽。因此,適應菜粕等農業副產物的高性能、高產量的蛋白酶新型菌株和連續發酵工藝亟需推進。本研究從桑葉中篩選出一株高產中性蛋白酶的菌株,以菜粕作為氮源,通過優化培養基成分和發酵條件,使得酶活顯著提高。該研究為植物源蛋白資源高值利用和植物蛋白向生物活性肽的轉化提供了理論基礎。
1 材料與方法
1.1 材料與儀器
桑葉 -20 ℃下保藏,備用(品種為白桑葉,2021年5月采摘自某桑葉園);干酪素、三氯乙酸、硫酸銅、無水碳酸鈉、葡萄糖、乳糖、曲拉通-100、吐溫60、吐溫80、尿素、氯化銨、硫酸鎂、可溶性淀粉、氯化鈉、氯化鉀、硫酸錳、硫酸鋅、硫酸鐵、硫酸銅、麥芽糖 分析純,均購于成都科隆化學品有限公司;福林酚試劑、蛋白胨、牛肉膏、酵母浸粉 生化級,均購于成都奧博星生物技術有限公司;蔗糖 化學純,購于天津市科密歐化學試劑有限公司;司班60
化學純,購于成都科隆試劑有限公司;菜粕、豆粕、玉米粉 食品級,市售;DNA試劑盒 購自天根生化科技有限公司。
酪素培養基(g/L):參考文獻[17]并稍加修改,干酪素4 g,并滴入少量20 g/L NaOH溶液和蒸餾水,在沸水浴下溶解后調pH至7.5,再加入1.07 g Na2HPO4.7 H2O作為A液。0.36 g K2HPO4加入少量蒸餾水溶解作為B液。A液和B液混合加入20 g瓊脂粉、0.5%酪素水解培養物2 mL,溶于1 L蒸餾水中,121 ℃滅菌15 min。
營養肉湯培養基(g/L):蛋白胨10 g/L、牛肉浸出粉3 g/L、氯化鈉5 g/L、pH7.2±0.2,溶于1 L蒸餾水中,121 ℃滅菌15 min。
基礎發酵培養基(g/L):葡萄糖2 g/L、蛋白胨10 g/L、氯化鈉5 g/L、吐溫80 0.4%,溶于1 L蒸餾水中,121 ℃滅菌15 min。
T-114分析天平 奧豪斯儀器有限公司;QYC-2102C恒溫培養搖床 上海福馬實驗設備有限公司;DZKW-4電子恒溫水浴鍋、T6新世紀紫外可見分光光度計 北京普析通用儀器有限公司;HWS-260B恒溫恒濕箱、LS-75HD高壓蒸汽滅菌鍋 江陰濱江醫療設備有限公司;BM1000顯微鏡 南京江南永新光學有限公司;AT-710 pH計 日本京都電子制造有限公司;SPX-100B-Z單人單面凈化超凈工作臺 上海滬凈醫療器械有限公司;Mini Amp PCR儀 上海艾研生物科技有限公司。
1.2 實驗方法
1.2.1 產蛋白酶菌株的篩選 產蛋白酶菌株的篩選基于文獻稍加修改[18-19]。
初篩:取20 g桑葉切碎加入150 mL生理鹽水中,37 ℃、195 r/min搖床培養20 min,用梯度稀釋法分別稀釋10-1~10-5濃度,分別從10-1~10-5稀釋液中取出100 μL涂布在酪素培養基平板上,于37 ℃培養24 h,將產生透明圈菌株點注在酪素培養基上,觀察菌落與透明圈直徑大小,直徑較大的可以初步認為是產蛋白酶能強的菌株,并用接種環挑取產透明圈菌株進行純種劃線。
復篩:挑取產生透明圈的菌株接種于營養肉湯培養基中,37 ℃、195 r/min搖床培養35 h,測定中性蛋白酶活,結合初篩結果,挑選產中性蛋白酶活較高的菌株。
1.2.2 蛋白酶活力測定 根據GB/T 23527-2009《蛋白酶制劑》進行蛋白酶活測定,堿性蛋白酶pH10.5、中性蛋白酶pH7.5、酸性蛋白酶pH3.0條件下測定。以L-酪氨酸為標準曲線并建立回歸方程,吸光度值為縱坐標,L-酪氨酸濃度為橫坐標,回歸方程為y=0.0106x+0.0021,R2=0.9998。
1.2.3 菌株鑒定
1.2.3.1 菌株形態學鑒定 所篩菌株在營養肉湯固體培養基上劃線,37 ℃好氧培養24 h,觀察菌落,通過革蘭氏染色在顯微鏡下觀察菌體形態。
1.2.3.2 生理生化特征分析 根據《伯杰氏細菌鑒定手冊(第八版)》對該菌種進行糖發酵試驗、VP試驗、MR試驗、吲哚試驗、檸檬酸鹽利用試驗、苯丙氨酸脫羧酶測定、H2S試驗、產氣試驗。
1.2.3.3 分子生物學鑒定 采用DNA試劑盒對篩選到的菌株進行全基因組提取,以27F(5’-AGAGTTTGATCCTGGCTCAG -3’)、1492R(5’-GGTTACCTTGTTACGACTT-3’)為引物對16S rDNA進行PCR擴增,經純化后將樣品送擎科生物公司測序,測序結果在NCBI數據庫中進行BLAST分析,之后利用MEGA6進行基因排序匹配及系統發育樹的構建,得到基因序列同源性較高的菌株。
1.2.4 菌株產酶曲線 對數生長期的菌液以3%(v/v)接種至營養肉湯培養基,37 ℃、195 r/min搖床發酵,每隔8 h取樣,測定蛋白酶活,根據蛋白酶活的變化,確定最佳產酶時間。
1.2.5 不同培養基成分對菌株產酶的影響
1.2.5.1 不同碳源對菌株產酶的影響 對數生長期的菌液以3%(v/v)接種至基礎發酵培養基,其中葡萄糖替換為2 g/L(蔗糖、乳糖、麥芽糖、果糖、可溶性淀粉、玉米粉),其余成分及含量不變,初始pH5.6、37 ℃、195 r/min搖床發酵40 h,測定蛋白酶活。最佳碳源以0.5、3.5、6.5、9.5、12.5 g/L添加進不同基礎發酵培養基中發酵40 h后測定蛋白酶活,選取最優區間進行后續試驗設計。
1.2.5.2 不同氮源對菌株產酶的影響 對數生長期的菌液以3%(v/v)接種至基礎發酵培養基,其中蛋白胨替換為10 g/L(牛肉膏、菜粕、豆粕、尿素、硝酸鉀、硫酸銨),其余成分及含量不變,初始pH5.6、37 ℃、195 r/min搖床發酵40 h,測定蛋白酶活。最佳氮源按1.5、11.5、19.5、27.5、35.5、43.5 g/L添加進不同基礎發酵培養基中發酵40 h后測定蛋白酶活,選取最優區間進行后續試驗設計。
1.2.5.3 不同金屬離子對菌株產酶的影響 對數生長期的菌液以3%(v/v)接種至基礎發酵培養基,其中NaCl替換為5 g/L(MgSO4、ZnSO4、CuSO4、FeSO4、K2SO4、MnSO4),其余成分及含量不變,初始pH5.6、37 ℃、195 r/min搖床發酵40 h,測定蛋白酶活。最佳金屬離子按0.5、3、5.5、8、10.5 g/L添加進不同基礎發酵培養基中發酵40 h后測定蛋白酶活,選取最優區間進行后續試驗設計。
1.2.5.4 不同表面活性劑對菌株產酶的影響 對數生長期的菌液以3%(v/v)接種至基礎發酵培養基,其中吐溫80分別替換為0.4%(吐溫60、Triton-100、司班60),其余成分及含量不變,初始pH5.6、37 ℃、195 r/min搖床發酵40 h,測定蛋白酶活。最佳表面活性劑按0.2、0.6、1、1.4、1.8 g/L添加進基礎發酵培養基中發酵40 h后測定蛋白酶活,選取最優區間進行后續試驗設計。
1.2.5.5 酵母浸粉和磷元素對菌株產酶的影響 對數生長期的菌液以3%(v/v)接種至基礎發酵培養基,分別添加0、1、2、3、4 g/L的K2HPO4,0、3、6、9、12 g/L酵母浸粉,初始pH5.6、37 ℃、195 r/min搖床發酵40 h后測定蛋白酶活,探討酵母浸粉和磷元素對蛋白酶活的影響。
1.2.6 發酵培養基優化試驗
1.2.6.1 Plackett-Burman(P-B)試驗 根據單因素實驗得到的結果。采用P-B試驗設計對6個培養基成分(乳糖、菜粕、MgSO4、酵母浸粉、吐溫80、K2HPO4)進行方差分析,將每個因素分為兩個水平,即低水平-1,高水平+1表示,試驗設計如表1。

表 1 Plackett-Burman試驗設計Table 1 Plackett-Burman experimental design
1.2.6.2 最陡爬坡試驗 根據P-B試驗設計得到的3個顯著因素進行最陡爬坡試驗,綜合考慮各因素之間的正負影響并確定各因素步長和爬坡方向,其余成分按照低水平加入,試驗設計如表2。

表 2 最陡爬坡試驗設計Table 2 Design of steepest climbing test

表 3 培養基成分響應面優化設計Table 3 Response surface optimization design of medium components
1.2.6.3 Box-Behnken響應面優化設計 在上述試驗基礎上,利用Design-Expert 8.0軟件進行響應面優化。以培養基成分中各顯著因素為自變量,蛋白酶活為響應值(Y),設計3因素3水平試驗,其余成分按照低水平加入。根據響應面試驗模擬的最佳產酶的培養基成分及相應濃度進行驗證。試驗設計如表3。
1.2.7 發酵條件對菌株產酶的影響 除了培養基成分影響菌株產酶,發酵條件也是影響菌株產酶活力的重要因素。將菌體接入優化培養基中,過夜培養至對數生長期(OD≈0.5)作為種子液并進行如下實驗。
1.2.7.1 溫度對菌株ppr3產酶的影響 對數生長期的菌液以3%(v/v)接種至優化的培養基中,置于18、26、34、42、50 ℃,初始pH5.6、195 r/min搖床發酵40 h后測定蛋白酶活。
1.2.7.2 接種量對菌株ppr3產酶的影響 對數生長期的菌液分別以0.5%、3%、5.5%、8%、10.5%(v/v)接種至優化的培養基中,初始pH5.6、37 ℃、195 r/min搖床發酵40 h后測定蛋白酶活。
1.2.7.3 初始pH對菌株ppr3產酶的影響 對數生長期的菌液以3%(v/v)接種至優化的培養基中,初始pH分別調節為1、3、5、7、9,37 ℃、195 r/min搖床發酵40 h后測定蛋白酶活。
1.2.8 發酵條件的響應面優化設計 根據單因素實驗結果,采用中心組合設計獲得二次模型,中心點估計以蛋白酶活為指標,對3個因素進行響應面優化,根據響應面試驗模擬最佳產酶的發酵條件進行驗證。試驗設計如表4。

表 4 發酵條件響應面優化設計Table 4 Response surface optimization design of fermentation conditions
1.3 數據處理
運用SPSS 22進行單因素ANOVA分析,采用Desige-Expert12軟件進行Plackett-Burman試驗和Box-Behnken響應面優化試驗設計,建立非線性回歸數學建模,并對模型進行驗證,該模型考慮了各因素之間的主次效應以及因素之間的二級交互作用。
2 結果與分析
2.1 產蛋白酶菌株的篩選
從采集的桑葉中篩選得到7株產生透明圈的菌株,挑取7株菌株點注在酪素培養基,見圖1,分別命名為ppr0、ppr2、ppr3、ppr4、ppr5、ppr6、ppr7,根據透明圈與菌株直徑比例,初步篩選酶活較高的菌株(表5),比值最大為菌株ppr3。通過發酵實驗對中性蛋白酶菌株復篩,結果顯示,中性蛋白酶活最高的仍為ppr3菌株,達到215.4±2.26 U/mL。表6展示了該菌株在不同蛋白酶測定方法下的蛋白酶活,中性蛋白酶活最高,為220.4±3.47 U/mL,因此菌株ppr3產中性蛋白酶,后續試驗以ppr3為試驗菌株進行中性蛋白酶酶活的優化。

圖 1 酪素培養基上篩選菌株的透明圈Fig.1 Transparent circle of strains screened on casein medium

圖 2 菌落形態圖片(左)與革蘭氏染色結果(右)Fig.2 Image of colony morphology (left) and observation of bacterial morphology under microscope (right)

表 5 透明圈與菌株直徑的比值及相應酶活Table 5 Ratio of transparent circle to strain diameter and corresponding enzyme activities

表 6 不同pH下ppr3蛋白酶活Table 6 ppr3 Protease activity at different pH
2.2 菌株鑒定
2.2.1 菌株形態學觀察 由圖2(左)可知,菌株近乳白色,邊緣光滑規則,呈圓形,表面濕潤。革蘭氏染色結果陽性,菌體形態桿狀(圖2(右))。
2.2.2 生理生化特征 生理生化結果顯示,菌株ppr3可分解葡萄糖、乳糖、蔗糖,不產氣,VP試驗、MR試驗為陰性,不具有色氨酸酶、苯丙氨酸脫羧酶,不可利用檸檬酸鹽作為碳源,不能分解含硫氨基酸,結合《伯杰氏細菌鑒定手冊》,初步確定為芽孢桿菌屬。
2.2.3ppr3菌株的分子生物學鑒定 對菌株ppr3進行DNA提取,PCR擴增產物經瓊脂糖凝膠電泳,如圖3所示,ppr3菌株16S rDNA在1000~2000 bp之間,表明已成功擴增目的基因。建立系統發育樹,比較菌株之間的同源性,如圖4所示,ppr3與貝萊斯芽孢桿菌CBMB205同源性極高。結合菌株形態學觀察、生理生化分析,初步認定ppr3菌株為貝萊斯芽孢桿菌,貝萊斯芽孢桿菌是一種新型益生菌,具有抗菌和改善腸道的能力[20],本研究篩選的貝萊斯芽孢桿菌可能在食品與農業生產中具有廣泛潛力。

圖 3 菌株ppr3 16S rDNA PCR擴增電泳圖Fig.3 Electropherogram of strain ppr3 16S rDNA PCR amplification
2.3 菌株的產酶曲線
測定ppr3不同發酵時間段的中性蛋白酶活,繪制產酶曲線。由圖5(a)可知,菌株發酵過程中,蛋白酶活先升高后下降,40 h達到277.3±6.21 U/mL,最佳產酶時間為40 h,因此取40 h為發酵截止時間進行后續試驗。

圖 4 ppr3的系統發育樹Fig.4 Construction of strain ppr3 phylogenetic tree
2.4 不同培養基成分對蛋白酶活的影響
添加不同碳源對菌株ppr3產酶的影響如圖5(b)所示。結果表明,以乳糖為碳源時,蛋白酶活最高,酶活達297±6.66 U/mL,這與之前研究結果一致[21],乳糖作為緩速碳源,有助于蛋白酶等代謝產物的合成[22]。當乳糖濃度為3.5 g/L時,蛋白酶活最高達310±3.33 U/mL,隨著乳糖濃度增加,酶活逐漸下降,這可能是微生物傾向于更多碳源代謝,影響了蛋白酶的產生,其他代謝產物的積累也抑制了菌體的生長。因此選擇4.5和0.5 g/L作為P-B試驗碳源的高低水平。
探究不同氮源對蛋白酶活的影響發現(圖5(c)),以菜粕和豆粕為氮源時,蛋白酶活最高,分別達到了382.83±4.45、385.35±6.19 U/mL,二者差異不顯著(P>0.05),相比于無機氮源,部分有機氮源更利于菌株產生蛋白酶。菜粕中含有豐富的蛋白質,可供蛋白酶的產生與利用[23-24],且菜粕價格優惠,故選擇菜粕作為最佳氮源進行后續實驗。當菜粕濃度為11.5 g/L時,蛋白酶活最高,為403±4.88 U/mL。繼續增加菜粕濃度,酶活出現先平穩后下降的趨勢。菜粕濃度的增加,發酵液呈粘性狀態,當發酵液粘性過大時,可能不利于菌體產酶。因此選擇18和2 g/L作為P-B試驗氮源的高低水平。
不同金屬離子對蛋白酶活的影響如圖5(d)所示,添加Mg2+發酵組蛋白酶活最高,為305±8.67 U/mL,Na+、K+次之,添加Mn2+、Zn2+、Fe2+、Cu2+酶活最低,且低于空白組。Mg2+是蛋白酶的活性位點和活化劑,催化蛋白酶的產生,細胞中的某類蛋白系統對Mg2+濃度進行了儲存,并運輸到適當位置,組合成酶促系統,從而促進了蛋白酶的產生[25-26],因此選擇Mg2+為最佳金屬離子。Mg2+濃度為3 g/L時,蛋白酶活達到291±5.12 U/mL,與Mg2+濃度為5.5 g/L時的蛋白酶活無顯著差異(P>0.05)。之后隨著Mg2+濃度增加,酶活出現輕微下降,說明金屬離子濃度過高抑制酶的產生,因此選擇 3.5 和 0.4 g/L 作為 P-B 試驗Mg2+的高低水平。
表面活性劑對蛋白酶活的影響見圖5(e),添加曲拉通-100對蛋白酶活有抑制作用,其他3種表面活性劑與對照組相比蛋白酶活無顯著差異(P>0.05),非離子型表面活性劑可以增大細胞膜的滲透性,使得酶更容易分泌[27-28],選取吐溫80進行后續實驗。吐溫80濃度為0.6 g/L時,蛋白酶活最高,達到了294±6.33 U/mL,適量的表面活性劑對蛋白酶活有所提高,因此選擇1.0和0.3 g/L作為P-B試驗吐溫80的高低水平。
添加不同濃度的酵母浸粉、K2HPO4發現(圖5(f)),隨著濃度的增加,蛋白酶活呈現先增加后下降的趨勢,當酵母浸粉、K2HPO4濃度分別為3 g/L和1 g/L時蛋白酶活最高,分別為387±5.88 U/mL和301±3.38 U/mL。即適量的酵母浸粉和K2HPO4可提高蛋白酶活。酵母浸粉中含有大量微生物可利用的生長因子[29],K2HPO4中的P元素是微生物代謝的重要組成部分,可為蛋白酶起到pH緩沖作用[30]。因此選擇3.75和0.25 g/L作為P-B試驗酵母浸粉高低水平,1.5和0.4 g/L作為P-B試驗磷元素高低水平。

圖 5 菌種的產酶曲線及發酵培養基成分對酶活的影響Fig.5 Enzyme production curve of strain and effect of medium composition on enzyme activity
2.5 響應面優化
2.5.1 Plackett-Burman試驗 P-B用來評估實驗誤差和一段模型的充分性[31],通過P-B試驗設計可獲得影響顯著的變量,從而為后續變量優化提供理論基礎。
依據單因素實驗結果,確定因素與水平后,通過P-B試驗(表1)篩選影響顯著的重要因素。如表7所示以蛋白酶活(Y)為響應值,對數據進行回歸分析,得到回歸方程為Y=24.75A+26.92B-2.92C+16.25D-10.08E+14.58F。模型相關系數為R2=0.8854,P=0.0296<0.05,該模型可用。P-B試驗的方差分析如表8所示,從各因素P值可知,乳糖、菜粕對蛋白酶活影響顯著(P<0.05)。根據F值將顯著因素由大到小排列為菜粕>乳糖>酵母浸粉>K2HPO4>吐溫80>Mg2+,根據回歸方程各變量系數可知,乳糖、菜粕、酵母浸粉對蛋白酶活均表現為正效應,選擇F值前三的影響因素進行后續爬坡實驗。

表 7 Plackett-Burman試驗設計及結果Table 7 Plackett-Burman experimental design and results

表 8 Plackett-Burman 設計方差分析Table 8 Plackett-Burman design variance analysis
2.5.2 最陡爬坡試驗 根據已確定的因素正負效應,并依據前期試驗確定爬坡方向及步長。由表9可知,第4組試驗蛋白酶活最高,為483.79±6.65 U/mL,因此將第4組作為中心點進行響應面優化。

表 9 最陡爬坡試驗Table 9 Steepest ascent experiment
2.5.3 培養基成分的響應面優化設計 以乳糖(A)、菜粕(B)、酵母浸粉(D)為自變量,蛋白酶活為響應值(Y),通過軟件Design-Expert 12對表10進行多元回歸擬合,得自變量A、B、D與因變量Y間的編碼回歸方程Y=4.77A+42.14B+18.61D-7.14AB-35.06AD+1.64BD-17.64A2-58.46B2-15.82D2,實際回歸方程Y=126.41A+55.02B+129.54D-0.45AB-10.02 AD+0.12BD-4.41A2-0.9B2-5.17D2。表11方差分析可知,模型P值=0.0015<0.05,差異極顯著,失擬值P=0.6681>0.05,不存在失擬現象,擬合度好。模型R2=0.9422,說明該模型能反映響應值的變化。

表 10 Box-Behnken試驗設計及結果Table 10 Box-Behnken experimental design and results

表 11 蛋白酶活回歸分析Table 11 Regression analysis of protease activity
蛋白酶活響應面曲面圖結果表明(圖6),乳糖和酵母浸粉有交互影響,乳糖和菜粕無交互作用,菜粕和酵母浸粉無顯著影響。利用軟件預測響應值最大值,模型預測各因素組合為乳糖5.55 g/L、菜粕31.89 g/L、酵母浸粉7.09 g/L時,預測到最大蛋白酶活為501 U/mL,通過驗證實驗得蛋白酶活為497±4.56 U/mL,達到了預測值的99%。
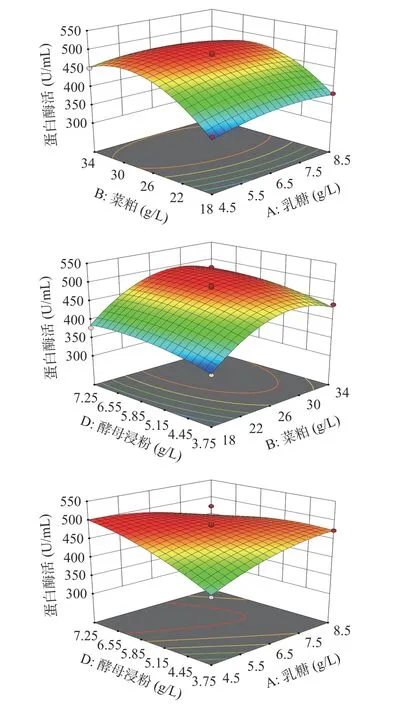
圖 6 各因素交互作用對貝萊斯芽孢桿菌產蛋白酶的影響Fig.6 Responses surface plots showing the interactive effects of rapeseed meal, yeast extract and lactose levels on protease production by Bacillus velezensis
2.6 發酵條件對菌株產酶的影響
除了發酵培養基會顯著影響菌株發酵過程中的蛋白酶活,溫度、初始pH等發酵條件也會對菌株的產酶起到關鍵作用。
如圖7A所示,在發酵溫度梯度變化下,蛋白酶活出現先升高后下降的趨勢,34 ℃時蛋白酶活達到最高,為482.91±6.65 U/mL,50 ℃時達到最低,則此蛋白酶耐熱性低。由于蛋白酶作為活性蛋白,對環境因素敏感,易失活,會使蛋白酶活降低,適宜的發酵溫度可使酶變得活躍,從而增加蛋白酶活的產量[32]。
接種量對菌株產酶的影響見圖7B,當接種量為3.0%時蛋白酶活達到468.68±1.64 U/mL,隨著接種量不斷增加,蛋白酶活和接種量3.0%時的蛋白酶活無顯著差異(P>0.05)。可能是增加接種量導致產酶時間提前,蛋白質等營養成分也被更快消耗,沒有足夠的蛋白誘導,使得蛋白酶活無明顯變化。
不同初始pH對菌株ppr3產酶的影響顯示(圖7C),當培養基初始pH5~7時蛋白酶活幾乎相同,分別為493.83±10.28、494.42±3.18 U/mL,pH9時蛋白酶活有顯著下降趨勢(P<0.05),但仍然保持較高酶活,有研究表明貝萊斯芽孢桿菌生長最適pH5[33]。
2.6.1 發酵條件的響應面優化設計 響應面設計獲得了自變量發酵溫度(a)、pH(b)、接種量(c)與因變量Y間的編碼回歸方程(表12)Y=-13.69a+83.79b+12c+0.6475ab+2.56ac-6.13bc-60.67a2-113.49b2-7.98c2,實際回歸方程Y=62.16a+327.9b+14.23c+0.04ab+0.13ac-1.23bc-0.95a2-28.37b2-1.28c2。通過方差分析(表13),該模型P值<0.01,表明差異極顯著,失擬值>0.05,失擬項不顯著,說明不存在失擬現象,擬合度好,R2=0.9987,因此可以用此模型進行驗證分析。根據響應面曲線及橢圓形曲線探討溫度、pH、接種量之間的交互作用,圖8顯示了溫度與pH之間無交互作用,接種量和pH之間有交互影響,溫度和接種量之間無交互作用。

圖 8 各因素交互作用對貝萊斯芽孢桿菌產蛋白酶的影響Fig.8 Responses surface plots showing the interactive effects of temperature, pH and inoculation amount on protease production by Bacillus velezensis

表 12 Box-Behnken試驗設計及結果Table 12 Box-Behnken experimental design and results

表 13 蛋白酶活回歸分析Table 13 Regression analysis of protease activity

圖 7 發酵條件對蛋白酶活的影響Fig.7 Effect of fermentation conditions on protease activity
該模型預測發酵條件為發酵溫度33 ℃,接種量為8.5%,初始pH5.7,蛋白酶活達到最大值502 U/mL,通過3組平行驗證實驗,蛋白酶活的平均值為500±5.86 U/mL,達到了預測值的98%,說明實際值與預測值有很好的擬合性。
3 結論
本研究篩選鑒定了一株高產中性蛋白酶的貝萊斯芽孢桿菌,蛋白酶活(215.4±2.26 U/mL)經統計學優化,提高到500 U/mL,盧超等[34]、許曌昕等[35]篩選到的產中性蛋白酶菌株,蛋白酶活分別為401.83、192.7 U/mL,均低于本研究的酶活。同時貝萊斯芽孢桿菌具有潛在的益生作用[21],這使得其在食品和農業的應用具有明顯優勢。通過方差分析和二階模型回歸方程,表明最優發酵條件為發酵溫度33 ℃,接種量為8.5%,初始pH5.7,培養基成分為乳糖5.55 g/L、菜粕31.89 g/L、酵母浸粉7.09 g/L、吐溫80 0.03%、MgSO40.04%,K2HPO40.04%。而菜粕作為替代蛋白,其成本相較于宋立立等[36]、郭艷霞等[37]顯著降低。使農業副產物得到了有效利用,但其工業生產有待擴大研究,其產酶機理、酶學性質及益生潛力也需要進一步探索。

