牦牛酥油微膠囊的制備及特性分析
凌月霜,張 巖,陳煉紅,
(1.西南民族大學食品科學與技術學院,四川成都 610041;2.西南民族大學畜牧獸醫學院,四川成都 610041)

圖 1 牦牛酥油微膠囊工藝流程Fig.1 Yak ghee microcapsule process
牦牛是西藏高原高寒地區的優勢物種[1]。牦牛奶中n-3多不飽和脂肪酸、n-6多不飽和脂肪酸和共軛亞油酸(Conjugated linoleic acid,CLA)等含量比普通牛乳高,CLA含量為0.596 mg/mL,是黑白花奶牛的11.4倍,牦牛酥油營養價值高[2],且功能性脂肪酸含量高[3-4],是優良的高脂肪食品。同時,牦牛酥油中的鞘磷脂能有效預防組織炎癥的發生[5]。手工制作的酥油比機械制作的酥油呈香物質(醇類、脂類等)更豐富,更受人們的喜愛[6-7],但其水分含量高會導致在儲存過程中脂肪被氧化水解,產生有害的物質[8],造成牦牛酥油質量下降,將其微膠囊化可以降低酥油氧化速率,保持品質。
微膠囊是使用一種或幾種穩定的分子材料(壁材)將不穩定物質(芯材)包埋,可以有效防止芯材跟外界接觸,起到防止氧化,延緩風味物質在儲藏期間釋放的作用,還可以控制芯材在特定部位釋放[9]。制備微膠囊常用的方法有噴霧干燥法、復合凝聚法、銳孔法等。銳孔法是以可溶性聚合物為壁材,在凝固浴中固化,將芯材封裝成微膠囊的方法[10],具有快速簡便、資金投入少、產品的粒徑和形態都較均勻等優點,適合應用于食品工業中。
目前,牦牛酥油微膠囊主要是采用噴霧干燥法制備[11-12],而噴霧干燥法制成的微膠囊在胃液中沒有很好的緩釋性,不能很好地保護酥油的功能性脂肪酸經過胃酸而不被破壞且其在高濕環境中容易破裂[13]。因此,本實驗選擇海藻酸鈉和CaCl2的復合產物作為壁材,采用銳孔法將牦牛酥油微膠囊化,通過單因素實驗和正交試驗來確定其最佳制備工藝,并測定其理化性質,對制備的微膠囊結構進行表征,測定其熱穩定性以及在胃腸液中的釋放特性,并測定其貯藏穩定性。以獲得一種包埋率高,穩定性高的微膠囊產品,并為深入研究酥油微膠囊在胃腸道內的消化吸收能力提供實驗依據。
1 材料與方法
1.1 材料與儀器
酥油(四川紅原) 傳統手工酥油;海藻酸鈉食品級,連云港天天海藻工業有限公司;無水氯化鈣
分析純,成都市科隆化學品有限公司;HCl、NaOH、磷酸二氫鉀、異辛烷、冰乙酸、硫代硫酸鈉 均為分析純,成都市科龍化工試劑廠;胃蛋白酶(1:3000)、胰蛋白酶(1:20) 均為食品級,如吉生物科技公司。
HMS-203D加熱型磁力攪拌器 上海滬浙實業有限公司;Master Sizer 2000激光粒度儀 英國Malvern Panalytical公司;Nicolet 380傅里葉變換紅外光譜儀 美國Thermo Electron公司;STA 449C同步熱分析儀 德國Netzsch公司;Sigma 600場發射掃描電鏡 德國Carl Zeiss Jena公司;DSC-60A差示掃描量熱儀 島津國際貿易(上海)有限公司;HR83水分測定儀 瑞士Mettler Toledo公司。
1.2 實驗方法
1.2.1 微膠囊制備工藝流程 微膠囊制備工藝流程如圖1所示。
1.2.2 單因素實驗 按照1.2.1流程制備牦牛酥油微膠囊,固定初始條件:乳化劑3%(單甘酯:蔗糖酯=2:3),海藻酸鈉濃度1.5%,芯壁質量比2:1,CaCl2濃度2.5%,乳化溫度50 ℃,固化時間35 min。以包埋率為指標,分別以海藻酸鈉濃度(0.5%、1.0%、1.5%、2.0%、2.5%)、CaCl2濃度(1.0%、1.5%、2.0%、2.5%、3.0%)、芯壁質量比(1:1.5、1:1、1.5:1、2:1、2.5:1、)、乳化溫度(40、45、50、55、60 ℃)、固化時間(25、30、35、40、45 min)5個因素進行單因素實驗。
1.2.3 正交工藝優化試驗 單因素實驗后選取海藻酸鈉濃度(A)、CaCl2濃度(B)、芯壁質量比(C),進行三因素三水平正交試驗,優化銳孔法制備酥油微膠囊工藝。試驗因素水平表見表1。

表 1 正交因素水平表Table 1 Orthogonal factor level table
1.2.4 包埋率 以包埋率為指標檢測酥油微膠囊化效果。參考陳欣等[14]的方法測定酥油微膠囊的表面油、總油的含量,計算公式見式(1)。

式中:E表示包埋率,%;E1表示表面油含量,mg;E2表示總油含量,mg。
1.2.5 基本理化性質測定
1.2.5.1 含水量 含水量參照GB 2009.3-2016進行測定。
1.2.5.2 溶解度 溶解度參照劉斯博[15]的方法進行測定。
1.2.5.3 流動性 休止角的大小參考姚澤晨等[16]的方法進行測定。
1.2.6 粒徑分布分析 參照Bee等[17]的方法,以水為分散劑,使用激光粒度分析儀測定微膠囊的粒度分布。
1.2.7 微觀形態表征 將酥油微膠囊置于樣品室內,采用掃描電子顯微鏡(SEM)在加速電壓20 kV下觀察微膠囊的表面形態,并選擇分布較均勻的視野進行拍照。
1.2.8 微膠囊的傅里葉紅外光譜分析 準確稱取2 mg微膠囊、酥油、壁材樣品各一份;樣品:溴化鉀質量比為1:100,在研缽混合研磨后壓片,在400~4000 cm-1范圍內掃描。
1.2.9 熱穩定性分析
1.2.9.1 熱重分析 將酥油微膠囊(3~5 mg)放入小坩堝中,設置同步熱分析儀參數溫度范圍30~600 ℃,升溫速度10 ℃/min,載氣為氮氣,速率為20 mL/min,進行微分熱重(Derivative thermogravimetry,DTG)分析,測定樣品的熱釋放曲線。
1.2.9.2 差示掃描熱分析 參考姜雪等[18]的方法分析膠囊的熱力學特性。稱取2 mg酥油微膠囊樣品置于鋁盒中,溫度從20 ℃加熱到300 ℃,升溫速率
10 ℃/min。
1.2.10 體外釋放模擬實驗 按照Chung等[19]的方法配制人工胃液;按照周莉等[20]的方法配制人工腸液。
按照程翎[21]的方法進行體外釋放模擬實驗并按照下式測定累積釋放率,計算公式見式(2)。

式中:Q表示累計釋放率,%;Q1表示過濾液中脂肪含量,mg;Q2表示微膠囊產品中總油含量,mg。
1.2.11 酥油微膠囊貯藏穩定性實驗
1.2.11.1 溫度對酥油微膠囊貯藏穩定性的影響 將酥油和制備的微膠囊放在25、60 ℃下避光保存,每2 d取1g樣品,共五次,參照GB 5009.227-2016的方法,測定其過氧化值(POV)。
1.2.11.2 光照對酥油微膠囊貯藏穩定性的影響 將酥油和制備的微膠囊放在室溫下避光和光照保存,每2 d取1g樣品,共五次,按照1.2.11.1的方法測定過氧化值(POV)。
1.2.11.3 酥油和酥油微膠囊氧化動力學研究及貨架期預測 零級或一級動力學,其方程分別見式(3)、(4):
零級動力學:

一級動力學:

式中:A表示t時間后樣品過氧化值,mmol/kg;A0表示初始過氧化值,mmol/kg;k表示反應速率常數;t表示貯藏時間,d。

表 2 正交試驗結果Table 2 Result of orthogonal test
將實驗數據代入兩個方程中,用Origin 2021軟件擬合,得到回歸方程和回歸系數R2,選取R2較大的回歸方程,將其代入方程,得到預測貯藏時間。
1.3 數據處理
所有實驗均重復3次。使用SPSS 23.0軟件對數據進行多重比較分析,以P<0.05為差異顯著。采用Origin 2021軟件進行繪圖。
2 結果與分析
2.1 單因素實驗結果
2.1.1 海藻酸鈉濃度對包埋率的影響 由圖2可知,海藻酸鈉濃度的變化會導致酥油微膠囊包埋率的變化,總體呈先上升后下降的趨勢。海藻酸鈉的粘度與濃度呈正相關,濃度低時粘度低,通過注射器時不易成型,且制備出來的微膠囊外壁較薄,在后期的處理中容易被破壞,導致包埋率下降。海藻酸鈉濃度增加后,粘度增大,通過注射器形成的微膠囊成型效果越來越好,包埋率上升,在海藻酸鈉濃度為1.5%時包埋率達到最大,為84.47%。隨后海藻酸鈉濃度上升,包埋率下降,主要是因為海藻酸鈉濃度增大,粘度也越來越高,使得成型所需要的推進壓力越來越高,擠壓成型困難[22],導致微膠囊包埋率降低。因此,海藻酸鈉濃度選擇1.0%、1.5%、2.0%作為正交優化試驗的三個水平。
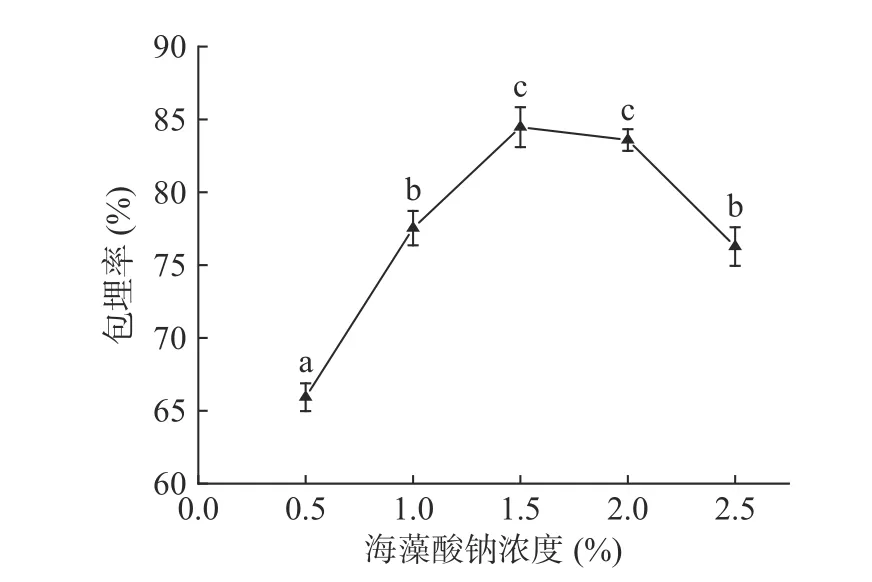
圖 2 海藻酸鈉濃度對包埋率的影響Fig.2 Effect of sodium alginate concentration on microencapsulation rate

圖 3 CaCl2濃度對包埋率的影響Fig.3 Effect of CaCl2 concentration on microencapsulation rate
2.1.2 CaCl2濃度對包埋率的影響 由圖3可知,CaCl2濃度升高,包埋率也隨之變化,總體呈先上升后下降的趨勢。在海藻酸鈉中添加CaCl2,兩者之間發生反應,形成“蛋盒二聚體”,可以將芯材包埋在壁材里且獲得穩定的結構[23]。當CaCl2濃度較低,芯壁材混合液滴入凝固浴時,海藻酸鈉和Ca2+沒有完全反應,導致成膜速度慢,且形成的膜較薄,不能將酥油有效地包封在微膠囊內部。隨著CaCl2濃度逐漸升高,包埋率隨之變大,CaCl2濃度為2.0%時,包埋率最大,包埋率為84.16%。當CaCl2濃度繼續增加,包埋率開始降低。這是因為CaCl2濃度高,海藻酸鈉和CaCl2迅速反應,外層快速凝固,導致CaCl2與海藻酸鈉形成的結構過于緊密,不能很好地將酥油包埋進去[24]。因此,CaCl2濃度選1.5%、2%、2.5%作為正交優化試驗的三個水平。
2.1.3 芯壁質量比對包埋率的影響 由圖4可知,隨著芯壁質量比的增大,包埋率總體呈先上升后下降的趨勢。芯壁質量比低時,由于沒有足夠的芯材被包埋,導致包埋率下降。在芯壁質量比為1.5:1時,包埋率最大,為87.39%。芯壁質量比繼續上升時,包埋率下降,主要是因為芯材遠大于壁材,當包埋物濃度增加時,包埋物會與海藻酸纖維形成弱鍵,并減少了海藻酸鹽鏈之間的相互作用,降低了復合物的穩定性,從而使包埋率下降[25]。陳麗等[26]的研究也出現同樣的結果。因此,芯壁質量比選擇1:1、1.5:1、2:1作為正交優化試驗的三個水平。

圖 4 芯壁質量比對包埋率的影響Fig.4 Effect of core-wall mass ratio on microencapsulation rate
2.1.4 乳化溫度對包埋率的影響 由圖5可知,隨著乳化溫度的升高,酥油微膠囊包埋率先上升,接著在一定乳化溫度范圍內包埋率基本不變,最后包埋率呈下降的趨勢。因為在相同固化時間內,較低溫度的海藻酸鈉粘度大,影響銳孔造粒的效果,乳化溫度逐漸升高,海藻酸鈉更易于和Ca2+聯結。當乳化溫度在55 ℃時,包埋率最高,為85.14%。當乳化溫度上升到一定程度時,海藻酸鈉中的結構單元容易分離,不易與Ca2+聯結,外部結構松散,包埋率降低[27]。由于溫度過高對酥油中不飽和脂肪酸有不利影響,并且包埋率在乳化溫度50和55 ℃時差異不顯著(P>0.05),所以確定反應溫度為50 ℃,在正交試驗中不選擇乳化溫度進行優化。

圖 5 乳化溫度對包埋率的影響Fig.5 Effect of emulsification temperature on microencapsulation rate
2.1.5 固化時間對包埋率的影響 由圖6可知,隨著固化時間的增加,酥油微膠囊包埋率呈上升趨勢,接著在一定固化時間內包埋率基本不變,最后包埋率下降。固化時間太短,包埋率較低主要是因為海藻酸鈉中Na+與CaCl2中的Ca2+置換形成海藻酸鈣需要時間,固化時間太短導致微膠囊的壁膜薄弱,包埋效果較差。隨著固化時間延長,生成的海藻酸鈣越來越多,包埋效果越來越好,包埋率顯著提升(P<0.05)。在固化時間30 min時,酥油微膠囊包埋率最高,為84.29%。當固化時間超過30 min,包埋率逐漸降低,這是由于海藻酸鈣的置換時間過長,包埋的酥油會通過囊壁上的孔向外擴散,導致包埋率較低[28]。所以微膠囊固化時間確定為30 min,在后續的正交試驗中將不再對固化時間進一步優化。
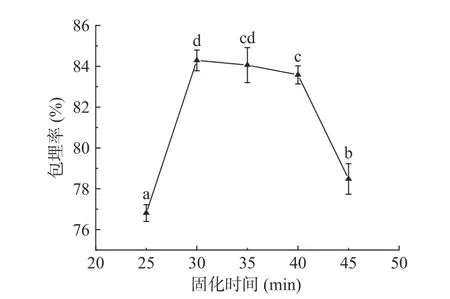
圖 6 固化時間對包埋率的影響Fig.6 Effect of curing time on microencapsulation rate
2.2 正交試驗優化結果
2.2.1 正交試驗分析 由表2的包埋率可知,A3B3C2組的包埋率最高,為84.62%。各因素對制備酥油微膠囊包埋率影響的主次順序為:A>B>C,最優組合是A2B3C2。
2.2.2 驗證實驗結果 對上述正交試驗得到的最佳微膠囊制備工藝(A2B3C2)進行驗證實驗,制備酥油微膠囊的最佳條件是:海藻酸鈉濃度1.5%,CaCl2濃度2.5%,芯壁比1.5:1,乳化溫度50 ℃,固化時間30 min,產品包埋率可達89.41%,高于正交表中包埋率最高的組合(A3B3C2),與正交表的預測相吻合。
2.3 最優工藝制備牦牛酥油微膠囊理化指標結果分析
2.3.1 微膠囊基本理化性質分析 如表3所示,微膠囊的水分含量為5.25%±0.16%,含水量對產品貯藏期有較大影響,水分含量低,貯藏中不易結塊和霉變,還會降低油脂的氧化速度,提升產品的貯藏時間。休止角為20.6°±0.35°,表明微膠囊產品表面光滑、流動性好。溶解度為57.22%±2.21%,溶解度良好,可進一步擴大產品的應用范圍,為食品工業應用打下良好基礎。

表 3 微膠囊的物理指標Table 3 The physical index of microcapsules
2.3.2 微膠囊的掃描電鏡和粒徑分析 從圖7(a)可以看出牦牛酥油微膠囊表面凹凸有致,囊壁清晰沒有存在裂紋,說明微膠囊具有良好的包裹性,有效隔絕外部的空氣,保持了酥油的穩定性。表面的褶皺是銳孔法微膠囊的特征,主要是因為干燥后失去水分造成聚縮,表面上有些凹凸是由于高溫噴金導致的。圖7(b)顯示,微膠囊平均粒徑為929.773 μm,有50%的微膠囊大于974.592 μm,粒徑在1002.374~1124.683 μm范圍內的微膠囊最多,占11.57%,表明微膠囊粒徑較為集中。
2.3.3 傅里葉紅外光譜分析結果 圖8為海藻酸鈉、酥油和微膠囊的紅外光譜圖,可以看出酥油在3442 cm-1處存在吸收峰,該峰主要是由-OH和NH共同引起的,表明酥油中不僅有脂肪,還存在蛋白質。酥油和微膠囊共有的吸收峰為2852 cm-1,此處是脂肪酸的甲基和亞甲基伸縮振動的吸收峰;1744 cm-1處是酥油的醛、酮中的C=O伸縮振動吸收峰;1164 cm-1的吸收峰為酥油中脂肪酸、氨基酸中C-O-C的對稱伸縮振動引起的。上述這三個波數在海藻酸鈉中均不存在吸收峰,表明微膠囊化后的特征峰是包埋了牦牛酥油引起的,通過微膠囊紅外光譜可以看出,微膠囊的出峰位置與酥油基本相同,說明微膠囊的主體結構為酥油,在1743、1637、1465 cm-1等處的吸收峰強度明顯降低,719 cm-1處由C-H的彎曲振動產生的吸收峰消失,這些吸收峰是由酥油中脂類、蛋白質引起的,證明脂類、蛋白質的含量減少,酥油被包埋。而微膠囊在623 cm-1處存在海藻酸鈉的特征吸收峰Na-O,表明壁材中存在海藻酸鈉。

圖 7 微膠囊的掃描電鏡圖(a)和粒徑分布圖(b)Fig.7 Scanning electron microscope diagram (a) and particle size distribution diagram (b) of microcapsules

圖 8 微膠囊紅外光譜圖Fig.8 FTIR of microcapsules
2.3.4 微膠囊的熱穩定性分析
2.3.4.1 熱重分析 熱重分析可以顯示出牦牛酥油微膠囊在不同的溫度條件下的損失速率和比例[29]。由圖9可知,在215 ℃之前為微膠囊熱分解的第一個階段,質量減少7.33%,此階段損失的主要是附著在微膠囊表面的酥油以及一些水分;第二個階段是
215~415 ℃,質量減少51.77%,大部分牦牛酥油微膠囊都是在此階段被破壞,說明外面的膜在高溫下被破壞,酥油和海藻酸鈉釋放出來被分解;最后一個階段是415~515 ℃,質量減少27.97%,此階段的損失主要與CaCl2分解有關。
這與趙楠楠[30]、張維等[31]制備的偃松松塔精油、榛子油微膠囊結論一致。牦牛酥油微膠囊在215 ℃前結構穩定,熱穩定性良好,在食品加工中有良好的潛能。
2.3.4.2 DSC分析結果 差示掃描量熱儀反映的是物理或化學變化之間與熱效應之間的關系[32]。由圖10可得,在116 ℃時,牦牛酥油微膠囊開始發生玻璃化轉變,其峰值溫度為132 ℃,在256 ℃時微膠囊徹底溶解。由此可知,本法制備的牦牛酥油微膠囊在常規的熱處理中可以保持良好的熱穩定性,保證芯材不被破壞。

圖 9 微膠囊熱重分析圖Fig.9 DTG diagram of microcapsules

圖 10 微膠囊的DSC曲線Fig.10 DSC of microcapsules
2.3.5 微膠囊在人工胃液和腸液中緩釋實驗分析
2.3.5.1 微膠囊在胃液中的釋放曲線擬合 將牦牛酥油微膠囊在體外人工模擬胃液釋放情況使用五個模型擬合,由表4可知,其中Logistic模型擬合度最高,擬合方程中R2為0.992最接近1,說明牦牛酥油的釋放動力學最符合Logistic模型的運動情況。由圖11可知,銳孔法制備的酥油微膠囊最大釋放率在11.52%,主要是由于附在微膠囊表面的酥油被消化,而壁材沒有被破壞。因為海藻酸鈣在胃液較低pH條件下,鈣離子與海藻酸鹽分子羧基解離,且質子化增加導致排斥力下降從而使壁材收縮,降低其被消化的可能性[33]。這個特性可以保證牦牛酥油能夠完整被傳遞到小腸中,牦牛酥油中的不飽和脂肪酸能更好被利用[34]。

表 4 體外人工模擬胃液釋放擬合結果Table 4 Fitting results of in vitro artificial simulation of gastric juice release
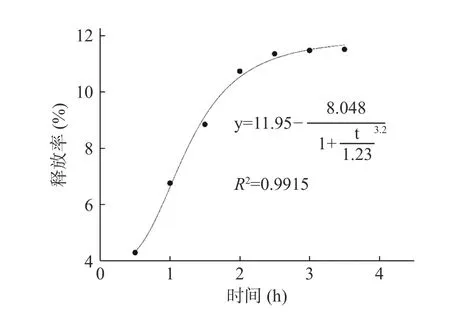
圖 11 模擬胃液中體外釋放Logistic模型擬合結果Fig.11 Fitting results of Logistic model for in vitro release in simulated gastric juice

表 5 體外人工模擬腸液釋放擬合結果Table 5 Fitting results of in vitro artificial simulation of intestinal fluid release
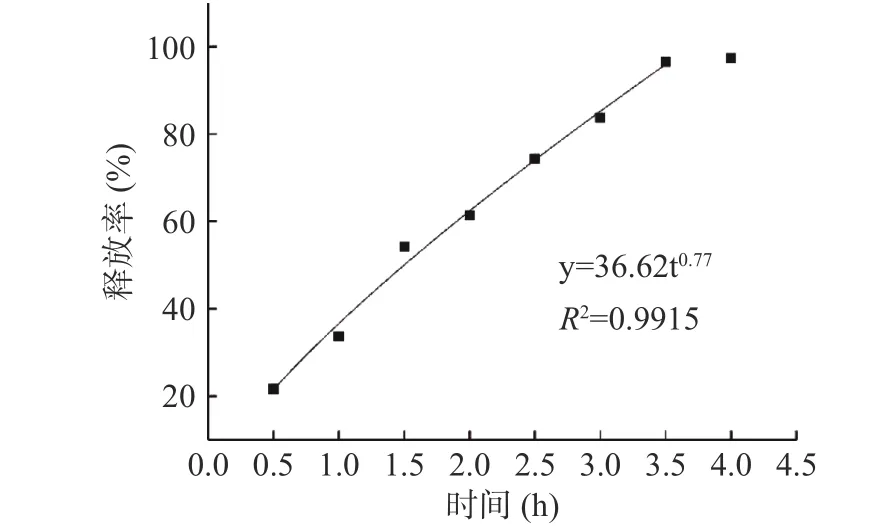
圖 12 模擬腸液中體外釋放Peppas模型擬合結果Fig.12 Fitting results of Peppas model for in vitro release in simulated intestinal fluid
2.3.5.2 微膠囊在腸液中的釋放曲線擬合 由表5可知,將牦牛酥油微膠囊在體外人工模擬腸液釋放情況使用五個模型擬合,其中Peppas模型擬合度最高,擬合方程中R2為0.992最接近1,說明牦牛酥油的釋放動力學最符合Peppas模型的運動情況。由圖12可知,銳孔法制備的酥油微膠囊在3.5 h基本釋放完全,釋放率達96.44%,說明牦牛酥油微膠囊能在腸道中被消化。在模擬腸液中,胰蛋白酶破壞囊壁結構,芯材向外擴散和囊壁溶蝕同時進行,最終實現大部分酥油在腸液中釋放,釋放出來的牦牛酥油功能性物質可以在腸道中被人體所吸收。
2.3.6 微膠囊貯藏穩定性分析
2.3.6.1 溫度對微膠囊貯藏穩定性的影響 由圖13、圖14可知,微膠囊初始過氧化值較未包埋的酥油高,主要是因為微膠囊在制備時受外部環境影響,導致部分酥油氧化,后期酥油氧化的速度顯著高于微膠囊氧化的速度(P<0.05)。10 d內貯藏溫度25和60 ℃酥油過氧化值分別上升了4.45、56.4 mmol/kg,貯藏溫度25和60 ℃微膠囊過氧化值分別上升了0.79、8.35 mmol/kg,均顯著低于同條件下酥油過氧化值增加量(P<0.05)。且60 ℃條件下,第2 d酥油的過氧化值已經超過了國家標準規定的15.76 mmol/kg。隨著貯藏時間增加,酥油過氧化值上升趨勢顯著高于微膠囊(P<0.05),酥油微膠囊過氧化值低主要是由于酥油被壁材包埋在其中,減少與外部環境接觸的機會,從而減少氧化。60 ℃條件下微膠囊的過氧化值也在略微升高,主要是因為海藻酸鈉與CaCl2反應,形成立體網狀結構存在空隙,微膠囊在保存過程中酥油會有滲出現象,在高溫下加速了酥油滲出,滲出的酥油遇到空氣則發生了氧化,導致過氧化值上升。以上結果表明微膠囊化可以防止酥油的氧化,顯著延長酥油的貨架期(P<0.05)。

圖 13 25 ℃對酥油微膠囊貯藏穩定性的影響Fig.13 Effect of temperature of 25 ℃ on storage stability of ghee microcapsules

圖 14 60 ℃對酥油微膠囊貯藏穩定性的影響Fig.14 Effect of temperature of 60 ℃ on storage stability of ghee microcapsules
2.3.6.2 光照對微膠囊貯藏穩定性的影響 光氧化是脂質氧化變質的主要因素[35]。當牛奶中的光敏劑被激發時,可以誘發乳脂的自動氧化[36]。由圖15、圖16可知,未包埋酥油的氧化速率比微膠囊的快。10 d內避光和光照條件下酥油過氧化值分別上升了3.27、4.37 mmol/kg,避光和光照條件下微膠囊過氧化值分別上升了0.73、0.82 mmol/kg,均顯著低于同條件下酥油過氧化值增加量(P<0.05)。微膠囊過氧化值增長速率慢,主要是因為牦牛酥油微膠囊化后,經壁材包裹,減緩了外部條件對牦牛酥油的影響,從而延長了酥油的保質期,在避光條件下貯存效果更佳。因此建議避光貯藏酥油微膠囊。

圖 15 避光對酥油微膠囊貯存穩定性的影響Fig.15 Effect of protecting from light on the storage stability of ghee microcapsules

圖 16 光照對酥油微膠囊貯存穩定性的影響Fig.16 Effect of light on the storage stability of ghee microcapsules
2.3.6.3 酥油和酥油微膠囊的氧化動力學研究及貨架期預測 由表6可知各個樣品在不同環境下的回歸方程和擬合系數。表中酥油和酥油微膠囊的零級反應回歸系數均大于一級反應回歸系數。證明銳孔法制備的微膠囊的氧化反應屬于零級氧化動力學反應[37]。預測的貨架期最長的是在避光條件貯藏的微膠囊,貨架期達136 d,是相同條件下的酥油的4.4倍,說明微膠囊避光貯藏具有更穩定的性質。根據R2可知方程擬合度較好,可以用來預測酥油和酥油微膠囊的貯藏期[38]。
3 結論
酥油是采用牦牛奶制成的一種藏族食品,但酥油在制作過程中水分含量較高,不易儲存,將其微膠囊化可以極大延長其保質期。本實驗使用海藻酸鈉與CaCl2作為壁材,使用銳孔法成功制備牦牛酥油微膠囊。以包埋率為指標,通過單因素實驗和正交試驗確定最佳工藝參數,并測定其理化指標、穩定性及釋放特性。結果表明,最佳工藝為:海藻酸鈉濃度1.5%,CaCl2濃度2.5%,芯壁質量比1.5:1,乳化溫度50 ℃,固化時間30 min,所得微膠囊包埋率為89.41%;含水量較低、溶解度、流動性良好,由FTIR分析可知,酥油特征峰在微膠囊化后強度降低,表明酥油被成功包埋;SEM和激光粒度儀分析表明,微膠囊結構完整且粒徑分布較為集中,其平均粒徑為929.773 μm;DSC、熱重分析表明酥油在微膠囊化后熱穩定性提高;模擬消化實驗表明,微膠囊產品在胃液中釋放率為11.52%,在腸液中釋放率達96.44%,大部分微膠囊在腸道中釋放。對其貯藏條件進行實驗,微膠囊在25 ℃和避光下貯藏可以保持其穩定性,預測最長貨架期可達136 d。本實驗表明使用銳孔法制備牦牛酥油微膠囊具有可行性,可以有效延長其保質期,有利于產品的遠距離銷售。

表 6 貯藏實驗線性回歸分析Table 6 Linear regression analysis of storage test

