功能性椰子植物酸奶貯藏過程中功能成分及活性的變化
趙曉明,宋 菲 ,張玉鋒,趙松林,王 揮
(1.中國熱帶農業科學院椰子研究所,海南文昌 571300;2.勁牌有限公司,湖北大冶 435100;
3.海南省椰子深加工工程技術研究中心,海南文昌 571339)
隨著經濟和生活水平的提高,人們越來越重視健康飲食。酸奶由于具有易消化吸收、抗過敏、改善腸道菌群平衡等功效,且具有良好的口感和風味而受到消費者的廣泛青睞。但對于乳糖不耐癥者或者由于飲食偏好而想要非乳制品酸奶的素質主義者來說,無乳糖的非乳制品植物酸奶便成了最優選擇。植物酸奶不含膽固醇和乳糖,產品質構特性與傳統酸奶大體相似,在健康和實現資源可持續利用方面,是傳統乳制品酸奶的理想替代品。因此,植物酸奶成為了近些年研究的熱點。
植物酸奶,也稱為非乳制品植物性酸奶,是在含有一定蛋白質的植物和(或)其制品為原料的基礎上進行乳酸菌發酵加工制成的酸奶產品[1]。目前關于植物酸奶的研究主要由基于椰子或大豆的產品主導,并且主要集中于工藝研究。Wang等[2]利用黃大豆和鷹嘴豆為原料,然后加入0.5%的非乳制品酸奶發酵劑,混合后于42 ℃下發酵16 h,研制出鷹嘴豆植物酸奶。馬文藝[3]利用未經加工處理的豌豆提取液和大豆漿為原料(調整蛋白質濃度為2.5%),加入0.004%的直投式發酵劑進行發酵分別制備出豌豆植物酸奶和大豆植物酸奶。Pachekrepapol等[4]研究了木薯淀粉對椰子酸奶感官、乳酸菌活力以及流變學特性的影響,結果表明木薯淀粉的添加可以改善椰子酸奶品質。韓喜艷等[5]利用椰漿為原料發酵制備出風味口感良好、理化性質優良的椰子植物酸奶。這些研究都豐富了植物酸奶產品種類。最近表明,利用植物資源對酸奶進行強化不僅可以提高酸奶的質量特性,還可以提高酸奶的功能活性[6]。椰子水作為優質的植物原料,具有較好的營養健康特性,例如抑菌、抗氧化、降血糖、抗炎及保護心臟等作用[7-9],加入到植物酸奶中可以起到協同增效作用,提高酸奶的抗氧化和降血糖功效。
課題組前期以椰漿和濃縮椰子水為原料,通過乳酸菌發酵制備了功能性椰子植物酸奶,并對加工工藝進行了優化,同時初步探討了抗氧化活性[1]。在此基礎上,本文進一步研究功能性椰子植物酸奶貯藏過程中的抗氧化與降血糖活性變化。分析貯藏過程中多酚和黃酮含量的變化,并通過自由基清除能力、還原力、抑制脂質過氧化能力、銅離子螯合能力來評價酸奶在貯藏過程中的抗氧化活性,采用α-葡萄糖苷酶和α-淀粉酶活性抑制率評價其降血糖活性,同時與對照酸奶進行對比。本研究為功能性植物酸奶的開發提供理論與技術支撐。
1 材料與方法
1.1 材料與儀器
原榨椰漿 海南文昌南椰實業有限公司;濃縮椰子水 上海欣融食品原料有限公司;添加劑(乙酰化二淀粉磷酸酯、單硬脂酸甘油酯) 上海華寶孔雀香精有限公司;沒食子酸 上海麥克林生化有限公司;蘆丁 生工生物工程(上海)股份有限公司;菌種(保加利亞乳桿菌Lactobacillus bulgaricus、嗜熱鏈球菌Streptococcus thermophilus) 西安千葉草生物科技有限公司;2,2-二苯基-1-苦基肼(DPPH) 梯希愛(上海)化成工業發展有限公司;2,2-聯氮-二(3-乙基-苯并噻唑-6-磺酸)二銨鹽(ABTS)、新亞銅、硫代巴比妥酸、卵磷脂 上海阿拉丁生化有限公司;鄰苯二酚紫 羅恩試劑有限公司;TPTZ(2,4,6-三吡啶基三嗪) 上海阿達瑪斯試劑有限公司;鄰苯三酚、PNPG(對硝基苯基-β-D-吡喃半乳糖苷)、3,5-二硝基水楊酸(DNS)、阿卡波糖 上海源葉生物科技有限公司;α-葡萄糖苷酶(來源于釀酒酵母,14.5 U/mg),α-淀粉酶(11 U/mg固體) 美國Sigma公司;其他試劑均為分析純。
Thermo Fisher離心機 廣州立諾自動化設備有限公司;Rolling Incubator QB-328旋轉培養器 海門市其林貝爾儀器制造有限公司;卡士Couss CF-3500發酵箱 中山卡士電器有限公司;Varioskan Flash 全波長多功能酶標儀 美國Thermo公司。
1.2 實驗方法
1.2.1 功能性椰子植物酸奶的制備 功能性椰子植物酸奶的制備參考趙曉明等[1]的方法。取鮮榨椰漿在低溫12000 r/min的條件下離心15 min,按重量計算,除去一定質量的上層油脂,混合均勻后獲得脂肪含量為10%的脫脂椰漿(蛋白質含量3.51%、還原糖含量1.03%、總糖含量4.92%)。將4%濃縮椰子水和添加劑(單硬脂酸甘油酯0.22%、乙酰化二淀粉磷酸酯0.13%)按相應比例加入到脫脂椰漿中,攪拌均勻,并在25 MPa的壓力下均質后,進行熱處理殺菌(65 ℃/30 min)。殺菌后冷卻到40 ℃左右按接種量3%、接種比例為1:1的嗜熱鏈球菌和保加利亞乳桿菌,然后在發酵箱中進行發酵8 h,發酵結束后迅速冷卻至10 ℃以下,放入4 ℃的冰箱中后熟48 h,即得功能性椰子植物酸奶。其中對照酸奶為不添加濃縮椰子水,其他工藝與功能性椰子植物酸奶一致。于第0、7、14、21、28 d分別測定對照酸奶和功能性椰子植物酸奶的各項指標。
1.2.2 酸奶提取液的制備 酸奶提取液參考文獻[10]中的方法進行制備并略作修改。取20 g酸奶樣品,用20 mL蒸餾水稀釋,在旋轉培養器中連續攪拌30 min,然后再在4 ℃、10000 r/min的條件下離心10 min,離心結束后迅速取出,收集上清液并用濾膜過濾(0.22 μm),濾液冷凍儲存在-20 ℃直至分析。
1.2.3 含量的測定
1.2.3.1 總酚含量的測定 采用福林酚-比色法測定總酚含量,參考劉夢瑤[11]方法并略做修改。準確取0.5 mL的酸奶提取液于試管中,加入2.5 mL福林酚試劑,充分混勻并靜置反應5 min,再加入2 mL 7.5%Na2CO3溶液,混勻后室溫下反應60 min,于波長765 nm處測吸光值。以沒食子酸(0~1.4 mg/mL)為標準品作標準曲線,其中以沒食子酸濃度為橫坐標,吸光值為縱坐標,得到的標準曲線方程為y=77.903x-0.9877,R2=0.9993。根據標準曲線計算酸奶樣品中的總酚含量。
1.2.3.2 黃酮含量的測定 采用亞硝酸鈉-硝酸鋁比色法測定黃酮含量,參考Zhang等[12]方法并略做修改。取0.5 mL的樣品于試管中,加入50 μL 5%亞硝酸鈉,室溫反應6 min后,再加入100 μL 10%的三氯化鋁,反應5 min,最后再加入0.5 mL 1 mol/L的氫氧化鈉,在波長500 nm處測吸光度。以蘆丁(0~1 mg/mL)為標準品繪制標準曲線,其中蘆丁濃度(mg/mL)為橫坐標,吸光值為縱坐標,得到的標準曲線方程為y=0.211x+0.0042,R2=0.9987。根據標準曲線計算酸奶樣品中的黃酮含量。
1.2.4 抗氧化活性的測定
1.2.4.1 DPPH自由基清除活性 DPPH自由基清除活性的測定參考趙曉明等[1]的方法。在2 mL試管中分別加入1 mL 2 mg/mL酸奶樣品提取液和1 mL 0.1 mmol/L的DPPH溶液,搖勻,室溫下暗處放置30 min后,在5000 r/min下離心5 min,取上清液于517 nm處吸光度。其中樣品對照組以等體積無水乙醇代替DPPH溶液,對照組以等體積蒸餾水代替樣品溶液,每組實驗平行3次。計算公式如(1)所示。

1.2.4.2 ABTS自由基清除活性 ABTS自由基清除活性的測定參考張玉鋒等[13]的方法,并稍作修改。取3 mg/mL的酸奶樣品提取液0.5 mL與4 mL的ABTS工作液(5 mL 7 mmol/L的ABTS溶液與88 μL 140 mmol/L過硫酸鉀混勻,室溫避光靜置12~16 h后,用無水乙醇稀釋至734 nm處的吸光值為0.70±0.02,即得ABTS工作液)充分混勻后,30 ℃水浴10 min后,以5000 r/min離心5 min,取上清液測定734 nm處的吸光值。其中對照組和樣品對照組分別以等體積無水乙醇代替樣品溶液和ABTS工作液,每組實驗平行3次。計算公式如(1)所示。
1.2.4.3 羥基自由基清除活性 OH自由基清除活性測定參考張玉鋒等[13]的方法,并稍作修改。在10 mL試管中依次加入1 mL的6 mmol/L硫酸亞鐵溶液和1 mL的6 mmol/L水楊酸-乙醇溶液;再依次加入1 mL 8 mg/mL的酸奶樣品提取液與1 mL的6 mmol/L的過氧化氫溶液,搖勻后室溫靜置30 min后,測定510 nm處吸光度。其中以等體積蒸餾水代替H2O2溶液作為樣品對照組,以等體積蒸餾水代替樣品溶液作為對照組,每組實驗平行3次。計算公式如(1)所示。
1.2.4.4 超氧陰離子自由基清除活性 超氧陰離子自由基清除活性的測定參考信亞偉[14]的方法,并稍作修改。取0.9 mL的0.05 mol/L pH8.2的Tris-HCl放置于室溫20 min,然后加入30 mg/mL的樣品提取液0.2 mL,再加入80 μL 7 mmol/L的鄰苯三酚溶液,混勻,置于室溫反10 min,然后加入2滴10 mol/L濃鹽酸終止反應,于325 nm處測定吸光值。其中對照組以蒸餾水代替樣品,空白組以蒸餾水代替鄰苯三酚,每組實驗平行三次。計算公式如(1)所示。
1.2.5 還原力的測定
1.2.5.1 總還原力的測定 總還原力的測定參考戴梓茹等[15]的方法。采用鐵氰化鉀法檢測還原力,取1.0 mL 35 mg/mL的樣品,先后向其中加入0.5 mL pH6.6的磷酸鹽緩沖液,0.5 mL 1%鐵氰化鉀溶液,混勻,置于50 ℃水浴20 min,加入0.5 mL 10%三氯乙酸以及0.1 mL 0.1%三氯化鐵,混勻靜置10 min,于700 nm測吸光值,以蒸餾水為空白,吸光值越高,表明還原力越強,抗氧化效果越好。
1.2.5.2 鐵離子還原力 鐵離子還原力的測定參考Muniandy等[16]的方法,并稍作修改。FRAP試劑由0.3 mmol/L醋酸緩沖液(pH3.6),20 mmol/L FeCl3·6H2O溶液和10 mmol/L TPTZ溶液混合而成,其中醋酸緩沖液:FeCl3·6H2O:TPTZ=10:1:1(v/v/v)。測定時將0.1 mL 25 mg/mL的樣品與0.8 mL FRAP溶液依次添加到具塞試管中,充分混合后在室溫下避光靜置30 min,在593 nm處測定吸光度,以蒸餾水調零,吸光值越高,表明抗氧化效果越好。
1.2.5.3 銅離子還原力 銅離子還原力的測定參考Karadirek等[17]的方法,并稍作修改。取25 μL 40 mg/mL樣品溶液于2 mL離心管中,并加入5 mmol/L的硫酸銅溶液250 μL、7.5 mmol/L的新銅溶液250 μL、1 mmol/L pH7.0的醋酸銨緩沖液250 μL以及250 μL的蒸餾水,混勻后置于室溫反應30 min,在450 nm處測吸光度,以蒸餾水為空白,吸光值越高,表明抗氧化效果越好。
1.2.6 抗脂質過氧化能力 酸奶中抗脂質過氧化能力參考曹煒等[18]的方法。在10 mL的玻璃試管中加入0.2 mL的脂質體液體和0.5 mL 40 mg/mL樣品溶液,混勻,再分別加入50 mmol/L FeSO4溶液50 μL和0.05 mol/L(pH=7.4)的磷酸緩沖液2.25 mL,然后置于37 ℃水浴中溫育40 min,每10 min振搖一次。水浴完成后,分別向各管加入1 mL 10%三氯乙酸和1 mL 0.8%硫代巴比妥酸,混勻,置沸水中水浴15 min,冷卻后8000 r/min的條件下離心8 min,取上清液在532 nm處測定吸光度。其中對照組以蒸餾水代替樣品溶液,樣品對照組以磷酸緩沖液代替FeSO4溶液。其中各酸奶樣品提取液的測定濃度均為40 mg/mL。
1.2.7 銅離子螯合能力 酸奶銅離子螯合能力的測定參考沈剛[19]的方法并稍作修改。取1 mL 50 mmol/L的乙酸鈉緩沖溶液,加入l00 μL 5 mmol/L CuSO4和100 mL 50 mg/mL的樣品溶液,混合均勻后靜置反應10 min,再向其中添加80 μL 4 mmol/L的鄰苯二酚紫溶液,搖勻后反應20 min,于632 nm波長處測定吸光度。其中對照組以蒸餾水代替樣品,樣品對照組以蒸餾水代替CuSO4溶液。計算公式如下:


1.2.8 降血糖活性的測定
1.2.8.1α-葡萄糖苷酶抑制能力 參考張玉鋒等[20]的方法,并稍作修改。在10 mL試管中分別加入0.4 mL濃度為10 mg/mL的酸奶樣品提取液、0.4 mL 0.04 U/mL酶液和0.4 mL的PBS(pH6.8,0.1 mol/L),在37 ℃的水浴鍋中加熱5 min;再分別加0.2 mL 0.5 mmol/L的pNPG溶液,混勻,繼續在37 ℃水浴鍋中加熱30 min,取出再加0.5 mL 0.2 mol/L的Na2CO3溶液,混勻。室溫下靜置5 min后,以5000 r/min離心5 min,取上清液于405 nm波長處測定吸光值。以磷酸鹽緩沖液作為空白調零,以磷酸鹽緩沖液分別代替對照組中的樣品,空白對照組中的酶液和樣品,樣品對照組中的酶液,每組實驗平行3次。計算公式如下:

1.2.8.2α-淀粉酶抑制能力 參考張玉鋒等[20]的方法,并稍作修改。將0.5 mL濃度為30 mg/mL的酸奶樣品提取液與0.5 mL 1 U/mL的α-淀粉酶溶液混合,并加入0.5 mL PBS(pH6.9,0.1 mol/L),在溫度37 ℃的水浴鍋中水浴10 min;加入0.5 mL 1%的可溶性淀粉,繼續在37 ℃水浴10 min;加入1 mL DNS試劑終止反應,并立即在水浴鍋中用沸水浴5 min,滅酶。待冷卻到室溫后,加入10 mL的蒸餾水稀釋,測定540 nm處吸光度。以磷酸鹽緩沖液作為空白調零,以磷酸鹽緩沖液分別代替對照組中的樣品,空白對照組中的酶液和樣品,樣品對照組中的酶液,每組實驗平行3次。計算公式如下:

1.3 數據處理
所有實驗均做三次平行,用SPSS(21.0)統計軟件對所有數據進行單因素方差分析(ANOVA),用Excel(2016)對數據進行作圖,每項分析的結果均以平均值±標準差表示。P<0.05表明在統計學上有顯著性差異。
2 結果與分析
2.1 酸奶貯藏過程中總酚和黃酮含量的變化
2.1.1 總酚含量的變化 貯藏期間各酸奶樣品的總酚含量變化如圖1所示。從圖1中可以觀察到,兩種酸奶在0~28 d內總酚含量均呈現出顯著下降趨勢(P<0.05),貯藏期間,功能性椰子植物酸奶和對照酸奶提取液的總酚含量分別從初期的(790.16±30.77)μg/mL、(495.82±28.09)μg/mL下降到末期的(248.38±19.09)μg/mL、(113.45±24.31)μg/mL,整個期間的降幅分別為68.57%、77.08%。Qiu等[21]研究添加玫瑰花提取物制作的酸奶和對照酸奶冷藏至21 d時的多酚含量也顯著降低(P<0.05);Cho等[22]研究表明添加橄欖葉熱水提取物的酸奶樣品的總酚含量也隨著儲存時間的延長而降低,與本研究趨勢一致。酸奶總酚的降低一方面可能是由于在冷藏儲存期間,在乳酸菌存在下聚合酚類物質的分解所導致的[23];另一方面也有可能由于活性酚類化合物與蛋白之間的相互作用,以及酸奶中某些熱、光或氧敏感酚類物質在貯藏過程中的降解所引起[24]。以上結果表明,貯藏期間,功能性椰子植物酸奶中總酚類物質的含量隨著貯藏時間的增加逐漸降低,但其含量和穩定性均高于對照酸奶。

圖 1 酸奶貯藏期間總酚含量的變化Fig.1 Changes of polyphenol content in yogurt during storage
2.1.2 黃酮含量的變化 貯藏期間各酸奶樣品提取液的黃酮含量變化如圖2所示。從圖2中可以觀察到,功能性椰子植物酸奶的黃酮含量在前14 d變化不大,14~21 d顯著下降(P<0.05),從(95.59±4.58)μg/mL降低至(75.01±2.04)μg/mL,后期略有升高,但變化差異不大(P>0.05),整個貯藏末期較初期相比,降低了12.31%。在0~28 d內,對照酸奶的黃酮含量略降低,從(75.72±2.56)μg/mL降至(64.09±2.47)μg/mL,下降幅度為15.37%。上述結果表明,貯藏期間功能性椰子植物酸奶的黃酮含量雖有所下降,但仍高于對照酸奶。

圖 2 酸奶貯藏期間黃酮含量的變化Fig.2 Changes of flavonoid content in yogurt during storage
2.2 酸奶貯藏過程中抗氧化活性的變化
酚類化合物可作為抗氧化劑,通過其提供氫或電子的能力導致鏈式反應的終止,或通過螯合過渡金屬離子從而終止Fenton反應[16]。直接清除自由基的化合物被稱為初級抗氧化劑,而通過Fenton反應防止自由基形成的化合物被稱為次級抗氧化劑,可通過測定自由基清除能力和還原力反映樣品的主要抗氧化性能,測定金屬螯合能力反映樣品的次要抗氧化性能[16]。由于酸奶樣品的總抗氧化能力可能是由多種反應機制導致的,單一的抗氧化測定可能無法完全準確反映樣品的抗氧化能力,因此,本研究使用自由基清除能力、還原力、抗脂質過氧化能力及銅離子螯合能力四種不同的方法來評估功能性椰子植物酸奶和對照酸奶的抗氧化活性。
2.2.1 自由基清除率的變化 酸奶貯藏期間自由基清除率(DPPH、ABTS、羥基及超氧陰離子自由基)的變化見圖3。由圖3可知,隨著儲藏時間的延長,功能性椰子植物酸奶的DPPH、ABTS、OH及O2-自由基清除活性表現出相似的變化規律,都是先升高后降低。在貯藏0~7 d,功能性椰子植物酸奶的DPPH、ABTS、羥基自由基的清除能力顯著升高(P<0.05),并在第7 d時活性達到了整個貯藏期內的最大值,分別為51.27%±1.83%、97.49%±0.09%、82.74%±1.67%,隨后都逐漸降低。兩種酸奶的超氧陰離子自由基清除能力在第14 d時達到最大,在14~28 d呈顯著下降趨勢(P<0.05),其中功能性椰子植物酸奶在14 d較0 d相比,其活性增幅為17.77%。自由基清除活性的降低,可能是因為在貯藏過程中,酸奶樣品中的蛋白-多酚類物質發生共和與非共和結合作用,使得體系中能夠參與自由基清除反應的游離態多酚類物質含量減少[25]。也有研究稱乳蛋白的交聯作用阻礙其酚環上羥基等活性基團的供電子能力[26],從而使抗氧化活性隨之降低。李郭浪等[27]報道了山藥山楂酸奶隨著貯藏時間的延長,其抗氧化活性也是先增高后降低,與本文研究結果一致。總體上看,功能性椰子植物酸奶在貯藏過程中對四種自由基清除率均顯著高于對照酸奶,可能是由于椰子水中的多酚、多糖及蛋白類等抗氧化成分發揮了作用。

圖 3 酸奶貯藏期間DPPH(a)、ABTS(b)、羥基(c)、超氧陰離子(d)自由基清除率的變化Fig.3 Changes of DPPH (a), ABTS (b), hydroxyl (c), superoxide anion (d) radical scavenging rates in yogurt during storage
2.2.2 還原力的變化 酸奶貯藏過程中還原力的變化如圖4所示,從圖中可以觀察出兩種酸奶隨著貯藏時間的增加,總還原力、銅離子還原力以及鐵離子還原力變化趨勢均不一致,在儲藏0 d時,功能性椰子植物酸奶的總還原力、銅離子還原力、鐵離子還原力均顯著高于對照酸奶(P<0.05)。功能性椰子植物酸奶和對照酸奶的總還原力的吸光度在7 d時達到最大,隨后略有下降;銅離子還原力在21 d呈現最低值,貯藏末期又有所提高,末期較初期相比,保留率分別為66.37%、51.25%。功能性椰子植物酸奶的鐵離子還原力在0~21 d逐漸降低,到28 d又顯著增高(P<0.05),這與銅離子還原力的變化趨勢一致。分析以上結果可以得知,整個貯藏期間,酸奶的總還原能力、銅離子和鐵離子還原能力均有所下降,其中功能性椰子植物酸奶的三種還原力都高于對照酸奶。Vital等[28]研究添加平菇水提物的低脂酸奶的鐵離子還原力等抗氧化活性隨著貯藏時間的延長而逐漸降低,Pan等[29]研究添加石榴汁粉的酸奶的鐵離子還原力和DPPH自由基清除能力也著貯藏時間的延長而逐漸下降,均與本研究結果趨勢一致。

圖 4 酸奶貯藏期間總還原力(a)、銅離子還原力(b)、鐵離子還原力(c)的變化Fig.4 Changes of total reducing power (a), reducing power of copper ions (b) and reducing power of iron ion (c) in yogurt during storage
2.2.3 抗脂質過氧化能力的變化分析 生物膜的主要成分是蛋白質和磷脂,其中磷脂含有多不飽和脂肪酸,最容易發生脂質過氧化,而脂質過氧化是引起許多疾病的重要因素之一。在本文中,Fe2+被用作脂質過氧化的起始因子,而卵磷脂脂質體被用作研究酸奶提取物抑制脂質過氧化能力的模型[18]。貯藏過程中酸奶的抗脂質過氧化能力變化如圖5所示,從圖中可以觀察到,功能性椰子植物酸奶的抗脂質過氧化能力在0~7 d顯著增高(P<0.05),從38.58%±3.09%增長至61.68%±2.33%,增加幅度為59.88%,在7~14 d沒有顯著性變化(P>0.05),在14~28 d顯著降低(P<0.05),從63.31%±2.33%降到41.93%±2.09%,降幅為33.77%,其中28 d與0 d相比,沒有顯著變化(P>0.05),但略增長8.68%;對照酸奶的抗脂質過氧化能力在第14 d達到最大,為42.99%±1.68%,到貯藏末期28 d結束時僅為18.22%±2.14%。綜合以上結果可以得出,功能性椰子植物酸奶在貯藏過程中的抗脂質過氧化能力的變化情況與自由基清除能力、還原力變化情況大致相同,貯藏后期活性均有所下降 ,且功能性椰子植物酸奶活性大于對照酸奶。

圖 5 酸奶貯藏期間抗脂質過氧化能力的變化Fig.5 Changes of anti-lipid peroxidation ability in yogurt during storage
2.2.4 銅離子螯合能力的變化分析 抗氧化劑可以分為三種不同的機制,即電子轉移(ET)、氫原子轉移(HAT)和金屬螯合,其中金屬螯合包括Fe2+、Cu2+和Zn2+。金屬的螯合能力被認為是評估抗氧化活性的次要機制化合物,最近的一些研究也證明了金屬,特別是Fe2+和Cu2+,能參與抵消一些非傳染性退行性疾病,如阿爾茨海默氏癥、帕金森氏癥和威爾遜氏癥以及心血管疾病[30]。如圖6所示,兩種酸奶對銅離子的螯合能力隨著貯藏時間的延長,呈現出先降低后增高的趨勢。功能性椰子植物酸奶的銅離子螯合能力在0~14 d內顯著下降(P<0.05),從83.32%±2.89%降至29.24%±3.82%,其中在14~21 d時,無顯著變化(P>0.05);21~28 d時,酸奶螯合能力逐漸上升(P<0.05),到貯藏末期升至57.07%±8.89%。但總體上,兩種酸奶在不同貯藏期的銅離子螯合能力變化規律相似,整體呈下降趨勢,但功能性椰子植物酸奶的螯合率始終大于對照酸奶。根據Oh等[31]的研究報道,添加植物提取物的酸奶具有更高的抗氧化活性,這很可能是植物提取物的植物化學成分和微生物代謝活動的結果,而且儲存過程中微生物的持續生長也有可能會改變一些酚類化合物,從而增加抗氧化活性。因此,補充植物提取物的酸奶具有與高抗氧化活性相關的潛在健康益處。
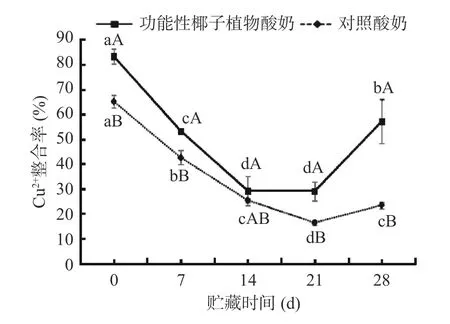
圖 6 酸奶貯藏期間銅離子螯合能力的變化Fig.6 Changes of chelating capacity of copper ions in yogurt during storage
2.3 酸奶貯藏過程中降血糖活性的變化
糖尿病是由遺傳性或獲得性胰島素分泌不足以及器官對分泌胰島素的反應性降低引起的代謝性疾病。治療糖尿病的一種有效方法是降低餐后高血糖,通過抑制消化道中的碳水化合物水解酶(如α-淀粉酶和α-葡萄糖苷酶)來延緩葡萄糖的吸收,這些酶的抑制劑(如阿卡波糖)會延遲碳水化合物的消化并延長整體碳水化合物的消化時間,導致葡萄糖吸收率降低,從而減緩餐后血糖升高[32]。因此,本文通過α-葡萄糖苷酶和α-淀粉酶活性抑制試驗來評價酸奶樣品的體外降血糖活性。
如圖7所示,兩種酸奶樣品都表現出α-葡萄糖苷酶和α-淀粉酶抑制活性,隨著貯藏時間的增加,α-葡萄糖苷酶的抑制作用呈增加趨勢,然而α-淀粉酶的抑制作用呈下降趨勢。功能性椰子植物酸奶的α-葡萄糖苷酶抑制率在0~14 d沒有顯著性變化(P>0.05),在14~21 d時顯著增長(P<0.05),從43.76%±4.17%增至53.30%±2.92%,增幅為21.80%,21~28 d變化不顯著(P>0.05)。而對照酸奶在7 d內沒有顯著變化,后期顯著升高,到28 d時達到最大抑制率,為45.66%±2.50%。在0~7 d,功能性椰子植物酸奶的α-淀粉酶抑制活性雖沒有顯著差異(P>0.05),但還是略增長了3.92%,而對照酸奶明顯下降;7~14 d,兩種酸奶的α-淀粉酶抑制率均有所下降,分別從79.33%±1.08%、15.77%±0.63%降至55.23%±1.01%、14.33%±1.73%,整個期間下降幅度分別為43.65%、10.00%。

圖 7 酸奶貯藏期間α-葡萄糖苷酶(a)、α-淀粉酶(b)抑制率的變化Fig.7 Changes of α-glucosidase (a) and α-amylase (b)inhibition rates during yogurt storage
本研究表明,整個貯藏過程中,功能性椰子植物酸奶對α-葡萄糖苷酶和α-淀粉酶抑制率均高于對照酸奶。Ni等[33]研究表明漿果酸奶、黑加侖果渣酸奶以及對照酸奶對α-葡萄糖苷酶的抑制能力隨著貯藏時間的增加而提高;Qiu等[21]研究添加食用玫瑰花提取物的酸奶樣品的α-葡萄糖苷酶的抑制能力也隨著時間的延長而提高,均與本文研究一致。Shori[24]研究孜然籽和香菜提取物制備的酸奶的α-淀粉酶抑制活性在0~7 d增長,在14 d后顯著降低,與本文對功能性椰子植物酸奶的研究結果一致。有人提出非糖類化合物可能通過疏水相互作用與酶的活性位點結合來發揮其抑制活性[34],但其確切機制尚不清楚。除此之外,濃縮椰子水中酚類物質的存在可能有助于更好地抑制α-葡萄糖苷酶和α-淀粉酶。研究表明椰子水具有降血糖活性[7],這可能對α-葡萄糖苷酶和α-淀粉酶抑制活性有直接影響。
3 結論
本研究通過對功能性椰子植物酸奶和對照酸奶貯藏過程中多酚、黃酮含量和抗氧化、降血糖活性的測定分析,結果發現,兩種酸奶的多酚含量隨著貯藏時間的增長而逐漸降低,功能性椰子植物酸奶的黃酮含量在0~14 d時沒有顯著變化(P>0.05),但隨后也有所降低,整個期間,功能性椰子植物酸奶的多酚和黃酮含量明顯高于對照酸奶。貯藏28 d較0 d,功能性椰子植物酸奶的ABTS自由基清除率和抗脂質過氧化能力沒有顯著差異(P>0.05),DPPH、羥基和超氧陰離子自由基清除率、總還原力、鐵離子和銅離子還原力、銅離子螯合能力、α-淀粉酶抑制率均有所降低,α-葡萄糖苷酶抑制率增高,且功能性椰子植物酸奶在抗氧化及降血糖活性上仍整體大幅度優于對照酸奶,一定程度上驗證了添加椰子水有利于提升酸奶的抗氧化、降血糖活性,也表明了功能性椰子植物酸奶在經過較長的貯藏期后仍然可以保持較好的活性。但引起活性變化的具體原因及機制需要進一步的研究。

