三維重建結合術中超聲在復雜肝癌切除中的應用效果
陳 琳 李 恒 孫思楠 涂從銀
復雜性肝癌主要是指肝惡性腫瘤中存在肝動脈、肝靜脈、門靜脈、膽管變異,腫瘤累及肝門,腫瘤擠壓引起肝內脈管系統變形,腫瘤巨大需行極量肝切除,腫瘤侵及肝臟第1段或第8段等情況[1]。由于解剖位置相對特殊、浸潤范圍較廣、累及重要血管或膽管,復雜性肝癌一直是肝切除的難點。臨床醫師主要依靠B超、MRI、CT等影像學檢查結果,結合臨床經驗對二維圖像進行抽象三維構想和理解,由于醫師經驗不足或三維重建水平限制,對復雜性肝癌的術前診斷和規劃,難以做到準確評估,易出現術中膽管或血管的損傷,導致圍手術期并發癥出現的概率相對較高。
隨著三維重建技術、術中B超引導技術和復雜肝癌切除技術的快速發展,復雜肝癌切除逐漸從傳統的經驗性手術向精準肝切除術轉變。對肝癌患者最佳預后的追求是最大限度地切除病灶、最大限度地減少創傷性侵襲,優化肝臟的保護,確保剩余肝臟功能和解剖的完整性,使患者獲益最大[2]。本研究回顧性分析21例復雜肝癌患者資料,術前采用三維重建技術評估患者肝臟腫瘤狀況行虛擬肝切除,術中結合B超導航指導手術治療。對比實際與虛擬切除肝體積,探討三維重建聯合術中B超引導在復雜肝癌切除中的臨床應用。
1 資料與方法
1.1 一般資料 回顧性分析2021年4月至2022年3月中國科學技術大學附屬第一醫院(安徽省立醫院)西區綜合外科收治的21例復雜肝癌切除患者的相關資料,其中男性18例,女性3例,年齡42~74歲,平均年齡63(52,68)歲。
1.2 納入排除標準 納入標準:①術前符合復雜性肝癌的定義,中國肝癌臨床分期為Ⅰa~Ⅲa期[3];②術前吲哚菁綠15 min滯留率<30%、Child-Pugh評分A級;③肝剩余體積必須占肝標準體積30%以上,對伴有肝硬化、肝實質損傷或慢性肝病者需40%以上。排除標準:①腫瘤遠處轉移;②既往肝手術后復發患者;③伴有嚴重大腦、肺部、心臟、腎臟等疾病。本研究經過醫院倫理委員會審查批準(倫理審批文件號:2022-ZHW-01),參與者均簽署知情同意書。
1.3 方法 使用128排螺旋CT行肝臟三期增強掃描,導入相關數據完成數字三維重建(安徽紫微帝星數字科技有限公司)。應用三維重建技術行虛擬肝切除,計算腫瘤體積、標準肝體積、虛擬切除肝體積、剩余肝體積及剩余肝體積占標準肝體積百分比。采用術中B超監測門靜脈左右支及三支肝靜脈直徑和血流,于肝臟表面用電凝鉤標記肝靜脈走行,觀察肝靜脈走行與三維重建圖像之間的吻合情況,以評估手術的安全性。采用排水法測量實際切除肝體積,對比實際切除肝體積與虛擬切除肝體積差異,評估三維重建的準確性,觀察患者術中、術后的并發癥。記錄手術情況、術中出血量、手術時間及圍術期并發癥。
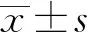
2 結果
2.1 手術情況 21例患者均完成術前三維重建,20例進行復雜肝癌切除,1例患者因腫瘤體積巨大行介入加靶向治療。20例患者中,1例行擴大的右半肝切除,1例尾狀葉切除,3例肝中葉切除,3例左半肝切除,5例右半肝切除,余7例行肝葉切除。2例患者術前三維重建未發現而術中超聲發現衛星病灶,直徑分別為0.8 cm、0.7 cm,術中更改了手術方案,術前3D重建虛擬手術方案與術中實際手術方案符合率為90% (18/20)。5例患者術中深部病灶定位不清楚,在術中超聲引導下精準切除。2例患者門靜脈內癌栓,術中超聲清楚地顯示了癌栓的位置、大小、走形,順利取出癌栓。手術中出血量100~3 000 mL,手術時間139~393 min,平均術中出血量600(200,1 000) mL,平均手術時間213(183,273) min。手術中未發生重要的膽管、血管損傷,未發生非計劃再手術,未出現圍手術期患者死亡情況。
2.2 術后并發癥 術后5天出現膽漏1例,術后5~6天出現呼吸衰竭2例,術后4~6天出現肺部感染3例,術后3~7天出現胸腔積液5例,對癥治療后均好轉。患者均未發生肝臟衰竭或者大出血等嚴重并發癥,20例患者全部恢復順利出院。
2.3 相關性分析 20例復雜肝癌切除患者的平均虛擬切除肝體積為(1 110±242)mL,術后平均實際切除肝體積為(1 069±197)mL,差異無統計學意義(t= 1.463,P=0.160),Pearson相關分析表明兩者之間存在相關性(r=0.857,P<0.001)。見圖1。

圖1 實際切除肝體積和虛擬切除肝體積相關性分析
2.4 典型病例 患者,男性,66歲,因“上腹部脹痛3月”入院。既往有“乙肝小三陽”病史。術前甲胎蛋白170 ng/mL,乙肝病毒核酸拷貝數9.83×106copies/mL。全腹部薄層增強CT:肝右葉多個結節狀腫塊,較大的腫塊約8.0 cm×6.3 cm,門靜脈右側鑄型軟組織影,考慮原發性肝癌伴肝內轉移并門脈右支癌栓形成(見圖2A)。三維重建顯示:右肝臟巨大占位,侵犯肝中及肝右靜脈,壓迫肝門部,門靜脈右支充盈缺損(見圖2B)。仿真手術:擬行擴大右半肝切除+膽囊切除+門靜脈切開取栓術。測算個體化肝體積:剩余肝體積420 mL,標準肝體積1 210 mL,剩余肝體積百分比為34.47%,術中B超引導顯示重要組織,術中所見與三維重建一致,順利切除腫瘤。術后病理學診斷為低分化肝細胞癌,肝斷面切緣未見癌累及。

注:A為腹部增強CT顯示右肝巨大占位,箭頭指示門脈右支癌栓;B為三維成像顯示肝右,肝中靜脈受侵犯。
3 討論
原發性肝癌患者早期大多沒有明顯癥狀,就診時多數已進入中晚期,手術是治療肝癌的主要方式。復雜肝癌切除術中,因腫瘤體積大或位置深,術中會有顯露困難、切除病灶范圍過大等風險,容易出現術中術后出血、膽漏和肝衰竭等并發癥[4-5]。在薄層CT掃描數據的基礎上,運用三維可視化技術可以生成3D圖像,更準確地計算標準肝體積和剩余肝體積,并結合吲哚菁綠清除試驗和Child-Pugh評分,進行術前評估[6]。術中超聲實時監測可提供肝靜脈表面投影和Glisson鞘走向,結合術前3D圖像,使術者準確掌握肝切除平面。同時術中超聲可以測量肝靜脈、第一肝門和下腔靜脈的距離,有效避免在術中損傷重要脈管[7]。
結合文獻[1、8]及本研究21例患者治療體會,筆者認為三維重建結合術中超聲在復雜肝切除術中具體有如下優勢:①三維重建技術可提供精確的肝臟三維定量分析、個體化分析肝臟的解剖和變異情況、測算標準肝體積和剩余肝體積等,確保剩余肝體積在安全范圍內,模擬手術切除方案,保證安全切緣,減少肝組織的損傷,降低圍手術期的相關風險。本組病例術前評估的虛擬切除肝體積與實際切除肝體積相比差異無統計學意義,Pearson相關分析表明二者間具有相關性。②在立體結構中,術者可在不同角度觀察分析腫瘤的大小、部位、數目和脈管比鄰情況,劃定預切肝組織的方位和分界線,制定最優手術路徑,減少殘余肝臟的血管及膽管受損幾率。③重建的立體圖像可以更加直觀的讓病人和家屬了解腫瘤情況,制定手術方案,了解手術的難度和相關并發癥情況,利于醫患溝通。④在手術中術中超聲可以迅速尋找瘤體,探查腫瘤范圍、周圍組織浸潤情況,指導醫生進行肝切除,在保證完整切除腫瘤的同時,可以避免過多的肝組織被切除。⑤對于直徑小于1 cm的微小病灶,術中超聲可精確定位,還可發現術前影像檢查未發現的微小癌栓,在切除過程中可實時調整切肝平面,減少離斷肝組織中產生的偏移,辨認腫瘤的邊緣,保護剩余的肝組織及脈管。杜毅斌等[9]對63例肝癌切除進行術中超聲,發現其對肝臟小病灶有極高的敏感性,在小病灶甚至微小病灶的診斷上遠優于術前B超和CT組。本組中發現2例病例術前CT檢查漏診的小病灶,在術中超聲引導下順利切除,提高了腫瘤檢出率,完整切除了腫瘤。
復雜肝癌三維重建及術中超聲有如下技巧:①增強CT檢查前和影像科醫生溝通,采集肝動脈、門靜脈和肝靜脈顯影清楚的圖像,在肝臟的三維重建中,選擇腹主動脈腹側分支的腹腔動脈CT平面作為每個CT序列的融合點,可以有效避免呼吸波動造成的影響。②在剩余肝體積較小時,應去除心包、膈頂、脾、胃等易引起和肝體積相混淆的影響,同時為了減少膽道引流管對圖像的影響,應在經皮肝穿刺膽道引流術或經內鏡鼻膽管引流術前進行CT檢查[10]。③當發現肝臟冠狀平面CT圖像中,肝門結構被包在肝實質中,在三維重建中可盡量去除肝門部主要的脈管結構,如有必要可以去除少量的尾狀葉體積。④在術中超聲探查肝臟時,只游離鐮狀韌帶,不打開左右三角韌帶,減少空氣進入韌帶中,避免影響肝靜脈和下腔靜脈的匯合點聲像。⑤在探查肝臟表面時候,因超聲看不清探頭下幾毫米的肝臟,可多加生理鹽水在肝表面,使得探頭距離肝臟表面約1 cm,利于觀察,同時避免擠壓肝臟導致肝內組織變形影響分辨[11]。
三維重建也有不足,如需要花費時間且費用較高,巨大型肝癌擠壓第二肝門,相應的肝靜脈在增強CT上顯露不全,導致三維成像中肝靜脈的走形無法準確顯示,影響術前手術方案的設計[12]。術中超聲也有不足,某些部位超聲探頭不能隨意旋轉角度,或者外科醫師不能熟練掌握操作技巧,直徑小于5 mm的微小病灶難以找到。
復雜性肝癌診治過程中,三維重建的技術優勢及意義逐步引起外科醫師重視,在手術進行中,結合術中超聲的實時引導,可進一步探查病灶周圍結構,運用精準肝切除理念,完整切除肝腫瘤,盡可能的保留肝組織,減少創傷,使得病人獲得最佳治療效果,在臨床上有重要的應用價值。

