基于PbTiO3表面原位納米酶的生物傳感平臺用于NF-κB p50檢測
陳彥如,張 嵐,王光麗
(江南大學 化學與材料工程學院,江蘇 無錫 214122)
NF-κB p50是一種關鍵的多效轉錄因子,在基因表達中起著重要作用。NF-κB p50的研究對白血病、乳腺癌、肺癌等相關癌癥具有重要意義[1]。近年來,針對NF-κB p50的檢測方法主要包括電化學法[2]、熒光法[3]和比色法[4]。其中,比色法操作簡便,易于可視化檢測、成本較低且無需昂貴復雜的儀器。因此,開發靈敏度較高、選擇性好的比色分析方法具有重要意義。
納米酶作為當前研究的熱點,具有合成簡便、穩定性高、成本低和催化活性可調等優點[5-6]。目前,比色分析中采用的納米酶不容易直接與生物反應結合構建巧妙的生物傳感平臺。雖然原位形成的納米酶為構建生物傳感器提供了新視角,但其形成仍受限于堿性磷酸酶介導的酶促反應并局限于免疫分析或酶分析[7]。因此,探索新型原位形成的納米酶與其他多樣化的生物反應相結合以構建新型生物傳感體系具有重要意義。
本文構建了一種將K4Fe(CN)6配位到PbTiO3表面獲得原位納米酶的新策略,且PbTiO3表面原位形成的納米酶活性可通過脫氧核糖核苷5′-單磷酸(dNMP)進行調節。基于這一發現,以NF-κB p50為目標物,開發了一種無標記、無固定且高靈敏的生物傳感平臺。當NF-κB p50不存在時,在核酸外切酶Exo III的作用下,dNMP不斷產生并結合在PbTiO3表面,阻礙了K4Fe(CN)6在PbTiO3表面原位形成納米酶。NF-κB p50存在時,dNMP難以產生,使得K4Fe(CN)6順利結合到PbTiO3表面,催化底物TMB氧化,以此實現NF-κB p50的定量檢測。本研究開發的一種原位形成納米酶新方法具有靈敏度高、選擇性好和操作簡便等優點。
1 實驗部分
1.1 儀器與試劑
JEM-2100plus型透射電子顯微鏡(日本日立株式會社);D8型X射線衍射儀(德國布魯克AXS有限公司);Nicolet FT-IR 6700型紅外光譜儀(美國賽默飛公司);UV-3600型紫外可見近紅外分光光度計(日本島津公司);InVia型共焦拉曼光譜儀(英國雷尼紹貿易有限公司);FS5型熒光分光光度計(英國愛丁堡儀器公司);SpectraMax M5型酶標儀(美國分子儀器公司);DYY-8C型凝膠電泳儀(北京六一生物科技有限公司)。
Pb(NO3)2、鈦酸四正丁酯、Tween 20、K4Fe(CN)6、叔丁醇、3,3′,5,5′-四甲基聯苯胺、KI、NaHCO3、對苯二甲酸、過硫酸銨和30%H2O2(分析純,國藥集團化學試劑有限公司);辣根過氧化物酶(HRP,≥250 U/mg)、超氧化物歧化酶(SOD,≥2 500 U/mg)購自Sigma-Aldrich公司;30%丙烯酰胺/雙丙烯酰胺(29∶1)溶液、4S Gel Red、N,N,N′,N′-四甲基乙二胺、牛血清白蛋白(BSA)、甲胎蛋白(AFP)、癌胚抗原(CEA)、前列腺特異性抗原(PSA)、人血清白蛋白(HSA)購自上海生工生物工程股份有限公司;NF-κB p50、NF-κB p65購自南京百斯凱科技有限公司。
實驗所用HPLC純化的DNA購于上海生工生物工程有限公司,所用序列如下:
單鏈DNA 1(P1):5′-TCA GGA AAG TCC C-3′;
單鏈DNA 2(P2):5′-GGG ACT TTC CTG AGA CTT AGC-3′(加粗序列表示NF-κB p50蛋白的識別序列);
發夾DNA探針:5′-GCT AAG TCT CAG GAA AG T CCC GAC TTA GCA TCG-3′。
1.2 PbTiO3的制備
PbTiO3的合成根據文獻稍作修改[8]:0.331 2 g Pb(NO3)2溶解于50 mL去離子水中,向該溶液中加入1.82 mL Tween 20,并在室溫下不斷攪拌。將0.35 mL Ti(C4H9O)4加至上述溶液,所得混合液在60℃劇烈攪拌30 min,收集的沉淀物在600℃下煅燒120 min。
1.3 NF-κB p50的比色測定
將2.0 μmol/L單 鏈DNA(P1和P2)在10 mmol/L pH 7.5的Tris-HCl緩沖 液(含10 mmol/L MgCl2,100 mmol/L NaCl)中混合并于95℃下加熱5 min,冷卻至室溫。將20 μL P1/P2與10 μL不同濃度的NF-κB p50蛋白在30 μL蛋白結合緩沖液(10 mmol/L Tris-HCl,包含100 mmol/L KCl、2 mmol/L MgCl2、0.25 mmol/L DTT,pH 7.5)中混合,室溫下孵育30 min,使NF-κB p50蛋白與其識別雙鏈DNA序列結合。隨后,向上述混合液中加入20 μL 1.0 U/μL ExoⅢ和20 μL 1 μmol/L發夾DNA探針,37℃下孵育1 h。
隨后,向上述混合液中加入20 μL 1.0 mg/mL PbTiO3懸浮液,反應2 min后,依次加入20 μL 0.05 mmol/L K4Fe(CN)6、20 μL 5.0 mmol/L TMB、20 μL 5.0 mmol/L H2O2和NaAc-HAc緩 沖 液(0.2 mol/L,pH 4.5),使反應混合物的最終體積為200 μL。充分混合后,35℃反應20 min,測定oxTMB在652 nm處的吸光度。
1.4 凝膠電泳
采用非變性聚丙烯酰胺(15%)凝膠電泳研究不同情況下的體系產物。將7.5 μL反應產物和2.5 μL 6×樣品緩沖液混合后加入聚丙烯酰胺凝膠泳道中,在1×TBE緩沖液(89 mmol/L的Tris-硼酸,pH 8.0)中進行凝膠電泳。先在80 V下電泳1 h,然后在110 V下繼續電泳1 h。最后,采用3×4S GelRed核酸染料在黑暗中染色30 min,Gel Doc XR+成像系統拍照。
1.5 HeLa細胞提取物中NF-κB p50的檢測
為評估所提出的比色分析的實用性,收集HeLa細胞提取物作為真實樣品。HeLa細胞按照文獻進行細胞培養[9],使用細胞核提取試劑盒(Active Motif,Carlsbad,CA)提取細胞溶液產物用于測定。向細胞核提取液中加入不同濃度的標準NF-κB p50溶液進行實驗,操作步驟同“1.3”。
2 結果與討論
2.1 PbTiO3及PbTiO3/K4Fe(CN)6復合物的表征
采用透射電子顯微鏡(TEM)對合成的PbTiO3進行表征,可觀察到PbTiO3為約30~45 nm的納米片(圖1A)。PbTiO3的X射線衍射圖(XRD)顯示PbTiO3的衍射峰歸屬于四方相的PbTiO3(JCPDS No.06-0452)(圖1B),表明已成功合成PbTiO3納米材料。

圖1 PbTiO3的TEM圖(A)及XRD圖(B)Fig.1 TEM image(A)and XRD pattern(B)of PbTiO3
分別考察不同物質氧化TMB后的吸收光譜(見圖2)。結果顯示,只有當PbTiO3、K4Fe(CN)6和H2O2同時存在時,TMB才能被催化為藍色的oxTMB,此時的吸收光譜最強,推測PbTiO3與K4Fe(CN)6反應形成的PbTiO3/K4Fe(CN)6復合物具有類過氧化物酶活性,能在H2O2存在下催化氧化TMB。根據報道可知[10],K4Fe(CN)6中C≡≡N基團可與TiO2納米顆粒表面暴露的Ti(IV)結合。考察了PbTiO3、K4Fe(CN)6以及K4Fe(CN)6/PbTiO3的吸收光譜圖。如圖3A所示,乳白色PbTiO3懸浮液在加入無色K4Fe(CN)6溶液后呈黃色,絡合后的吸收波長明顯紅移,證明PbTiO3與K4Fe(CN)6成功結合。從FT-IR光譜(圖3B)可以看出,經過K4Fe(CN)6處理的PbTiO3樣品中出現一個屬于—C≡≡N的伸縮振動吸收峰(2 023 cm-1)[11],該峰與純K4Fe(CN)6中的—C≡≡N位置接近,表明K4Fe(CN)6成功絡合在PbTiO3表面。如圖3C所示,配位后PbTiO3樣品的拉曼光譜也觀察到屬于—C≡≡N的特征峰(2 063、2 095 cm-1)[11],同樣表明PbTiO3與K4Fe(CN)6已成功結合。

圖2 不同反應體系的吸收光譜Fig.2 Absorption spectra of different reaction systems
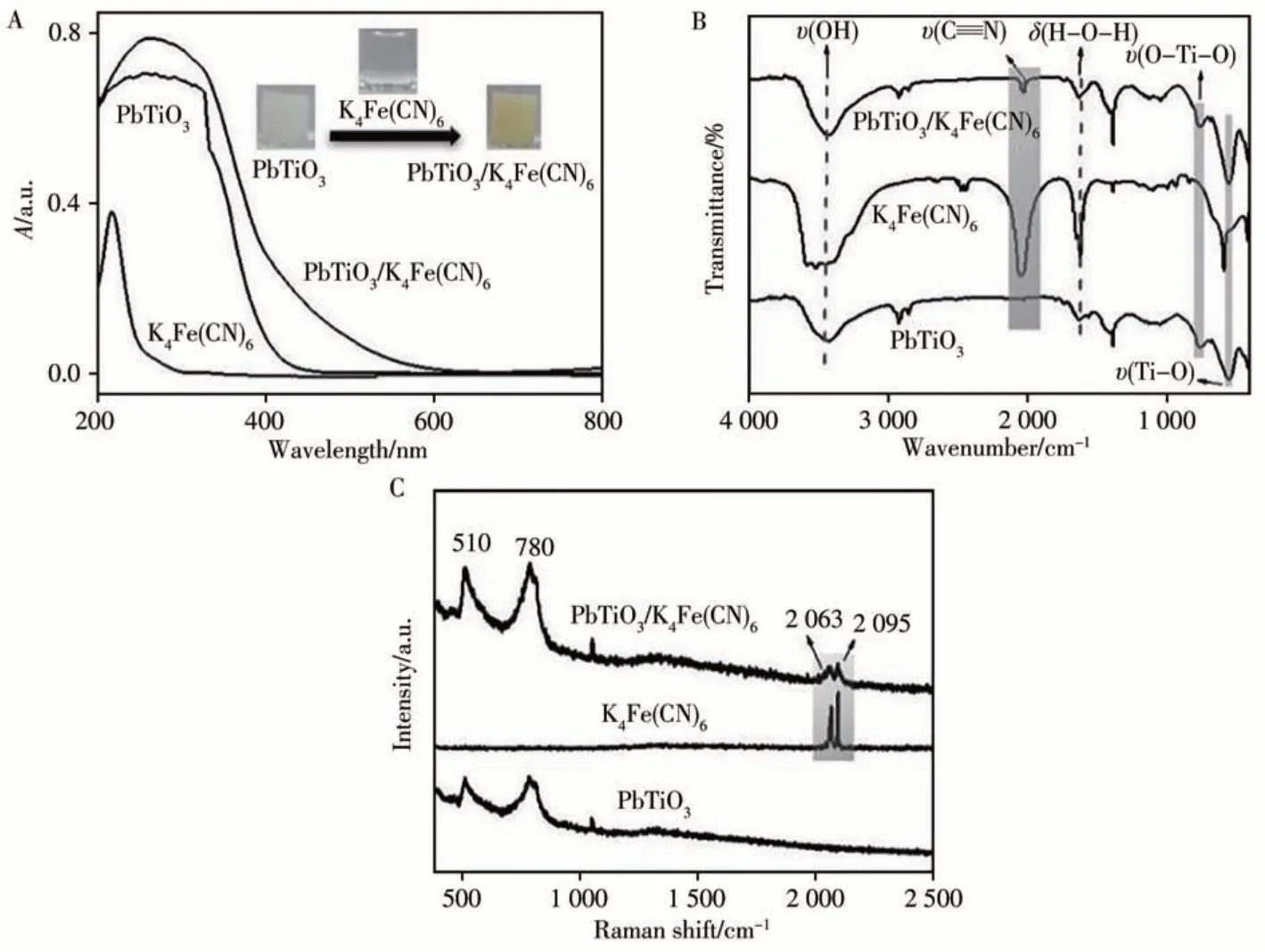
圖3 不同樣品的吸收光譜(A)、FT-IR光譜(B)及拉曼光譜(C)Fig.3 Absorption spectra(A),FT-IR spectra(B)and Raman spectra(C)for different samples
2.2 PbTiO3表面原位過氧化物模擬酶活性及催化機理探究
與天然酶和其他過氧化物納米酶相似,PbTiO3/K4Fe(CN)6的催化活性與反應溶液pH值、反應溫度及反應時間等參數密切相關。如圖4A所示,納米酶在pH 4.5時顯示活性最佳,與HRP(pH 5.5時活性最佳)相比,納米酶能在更酸性的條件下保持相對較高的催化活性。從圖4B可以觀察到,納米酶和HRP分別在35℃和40℃時表現出最佳催化活性,且納米酶在較高的溫度下仍能保持較好的活性。反應20 min左右,納米酶顯示出最佳催化活性(圖4C)。在上述最優反應條件下,探究了納米酶的穩態動力學參數,并通過公式V=Vmax·[S]/(Km+[S])進行計算(V為初始速度,Vmax為最大反應速度,[S]為底物濃度,Km為Michaelis-Menten常數)[12]。圖5A、B分別為不同濃度TMB、H2O2為底物時催化體系的吸光度隨反應時間的變化。通過A、B圖,得到反應速率與底物TMB或H2O2濃度的關系圖(圖5C、D),其插圖為反應速率的倒數與底物濃度的倒數的關系圖。以TMB和H2O2為底物時,計算所得的Km分別為0.199 mmol/L和0.131 mmol/L。與HRP相 比,PbTiO3/K4Fe(CN)6的Km明 顯 小 于HRP(TMB:0.434 mmol/L,H2O2:3.7 mmol/L[13]),說明PbTiO3/K4Fe(CN)6納米酶對TMB具有更高的親和力,并且在催化反應達到最佳活性時所需要的H2O2濃度更少。
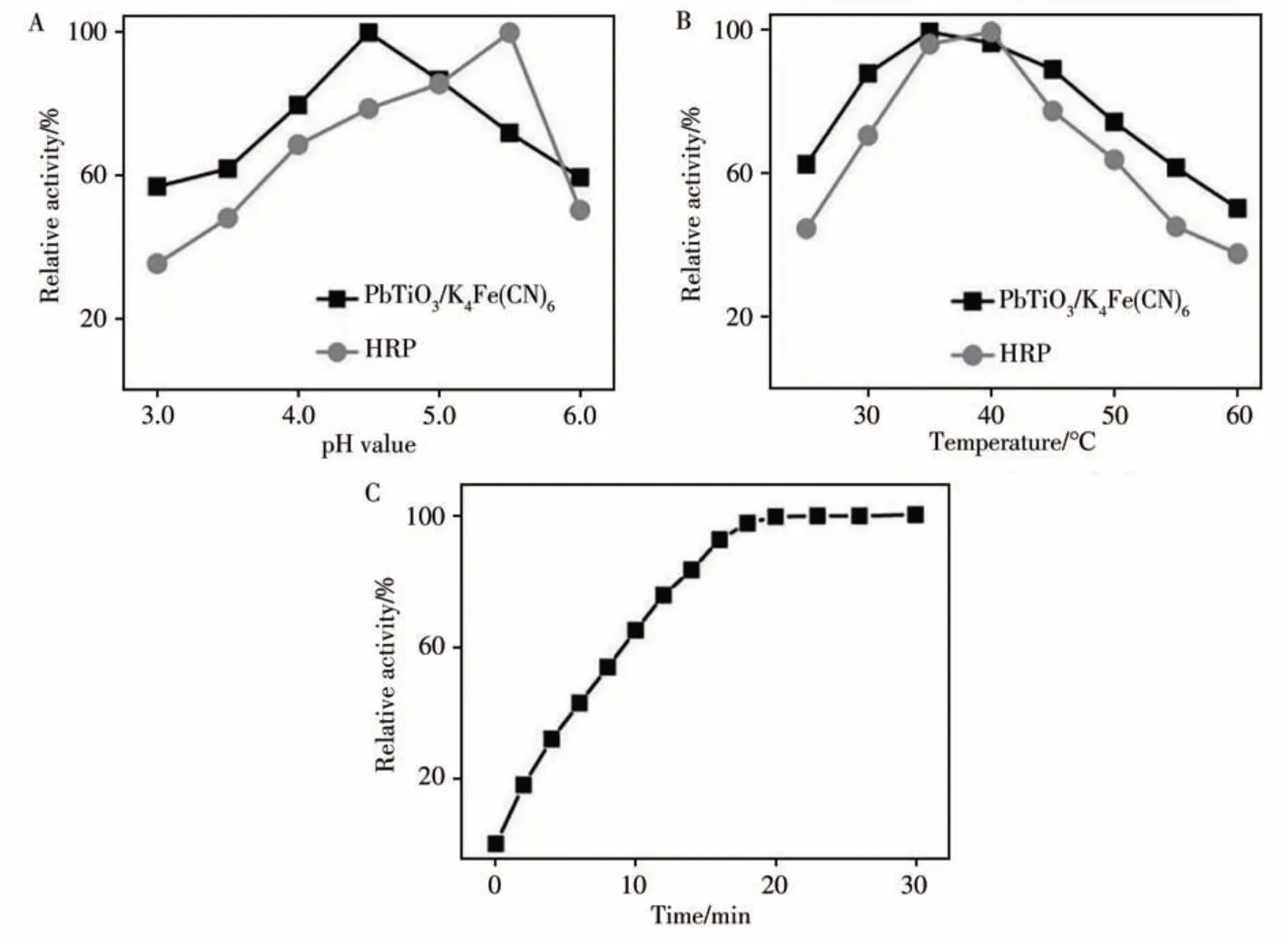
圖4 PbTiO3/K4Fe(CN)6和HRP在不同pH反應溶液(A)和不同反應溫度下的相對催化活性(B),以及PbTiO3/K4Fe(CN)6在不同反應時間下的相對催化活性(C)Fig.4 Relative catalytic activities of PbTiO3/K4Fe(CN)6 and HRP in reaction solution with different pH values(A)and reaction temperatures(B),relative catalytic activities of PbTiO3/K4Fe(CN)6 at different reaction times(C)
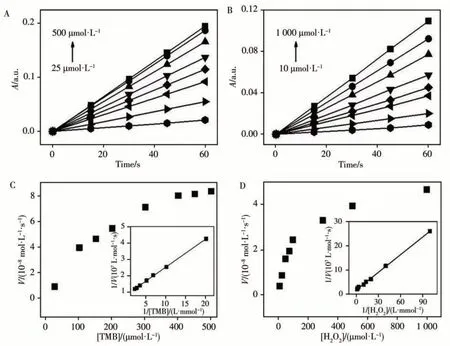
圖5 PbTiO3/K4Fe(CN)6在500 μmol/L H2O2和不同濃度TMB(A)、500 μmol/L TMB和不同濃度H2O(2B)存在下的吸光度;以TMB(C)、H2O(2D)為底物時PbTiO3/K4Fe(CN)6的穩態動力學分析Fig.5 Absorbance of PbTiO3/K4Fe(CN)6 in the presence of 500 μmol/L H2O2 and different concentrations of TMB(A),500 μmol/L TMB and different concentrations of H2O(2B).Steady-state kinetic assay of the PbTiO3/K4Fe(CN)6 for the catalytic reaction with TMB(C),H2O(2D)as substrate inset:the Lineweaver-Burk plots of the double reciprocal of the Michaelis-Menten equation
為了探究催化反應過程中的活性中間體,進一步向催化體系中加入叔丁醇和NaHCO3(?OH的清除劑[14])。結果顯示,催化體系的活性無明顯變化(圖6A),說明?OH不是催化反應的主要活性物質。進一步采用對苯二甲酸(TA)作為熒光探針[15]檢測?OH的產生(圖6B),結果顯示,TA本身或其與其它物質的混合物并無熒光產生(曲線a、b),TA與H2O2反應會在425 nm處產生微弱的熒光(曲線c),而TA在催化體系中的熒光(曲線d)比曲線c的熒光強度低,表明催化體系中未產生?OH。當存在O·-2的清除劑超氧化物歧化酶(SOD)[16]時,納米酶的催化活性明顯受到SOD的影響,表明在催化氧化TMB過程中,O·-2作為活性中間體催化氧化TMB。
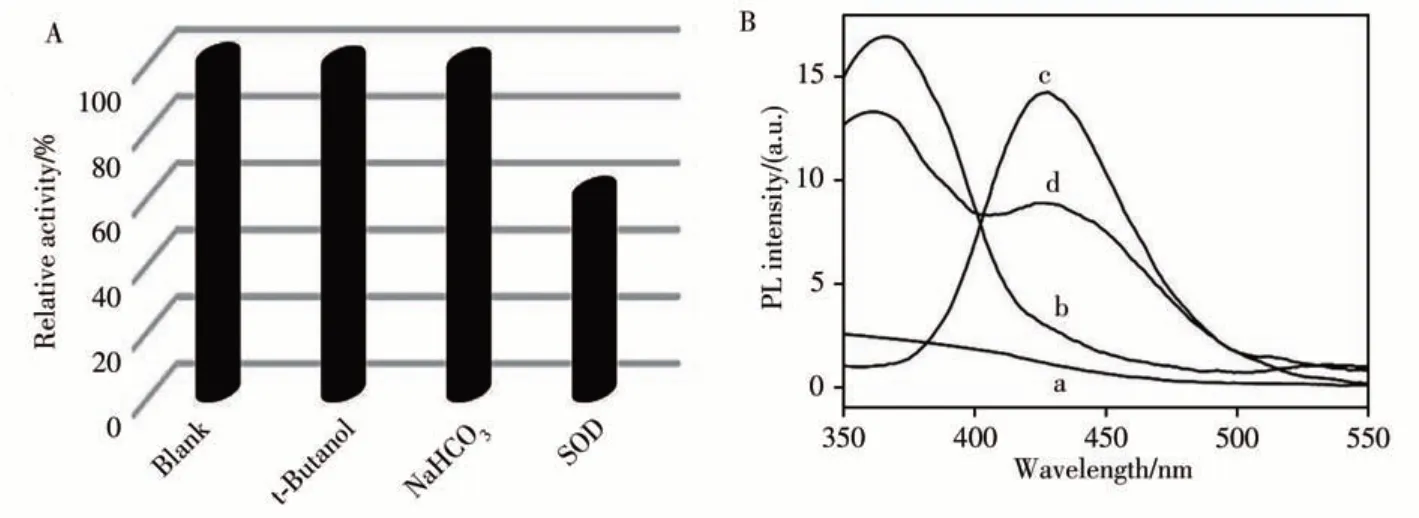
圖6 不同清除劑對PbTiO3/K4Fe(CN)6相對活性的影響(A),以及不同反應體系的熒光光譜(B)Fig.6 Effects of different scavengers on the relative activity of PbTiO3/K4Fe(CN)6(A),fluorescence spectra of different reaction systems(B)
2.3 NF-κB p50蛋白檢測原理及可行性證明
據報道,dNMP中的磷酸根可與PbTiO3表面的Ti緊密結合[17]。基于這一反應,設計了NF-κB P50蛋白的檢測體系,檢測原理如圖7所示:兩個反向互補的單鏈DNA(命名為P1和P2),雜交后得到具有NFκB p50特異性識別序列的雙鏈DNA(命名為P1/P2)。當NF-κB P50不存在時,P1/P2中的P1被ExoⅢ水解并產生dNMP,釋放的P2與隨后加入的發夾DNA繼續雜交并不斷被ExoⅢ水解,同時被釋放的發夾DNA不斷與剩余的P2雜交以啟動下一輪的水解,釋放的大量dNMP吸附在PbTiO3表面并阻止納米酶的形成。當存在NF-κB P50時,P1/P2在結合NF-κB P50后無法被ExoⅢ水解[18],反應體系中無法產生dNMP,使得K4Fe(CN)6順利與PbTiO3結合,催化TMB由無色變為藍色,基于此可實現對NF-κB P50的檢測。
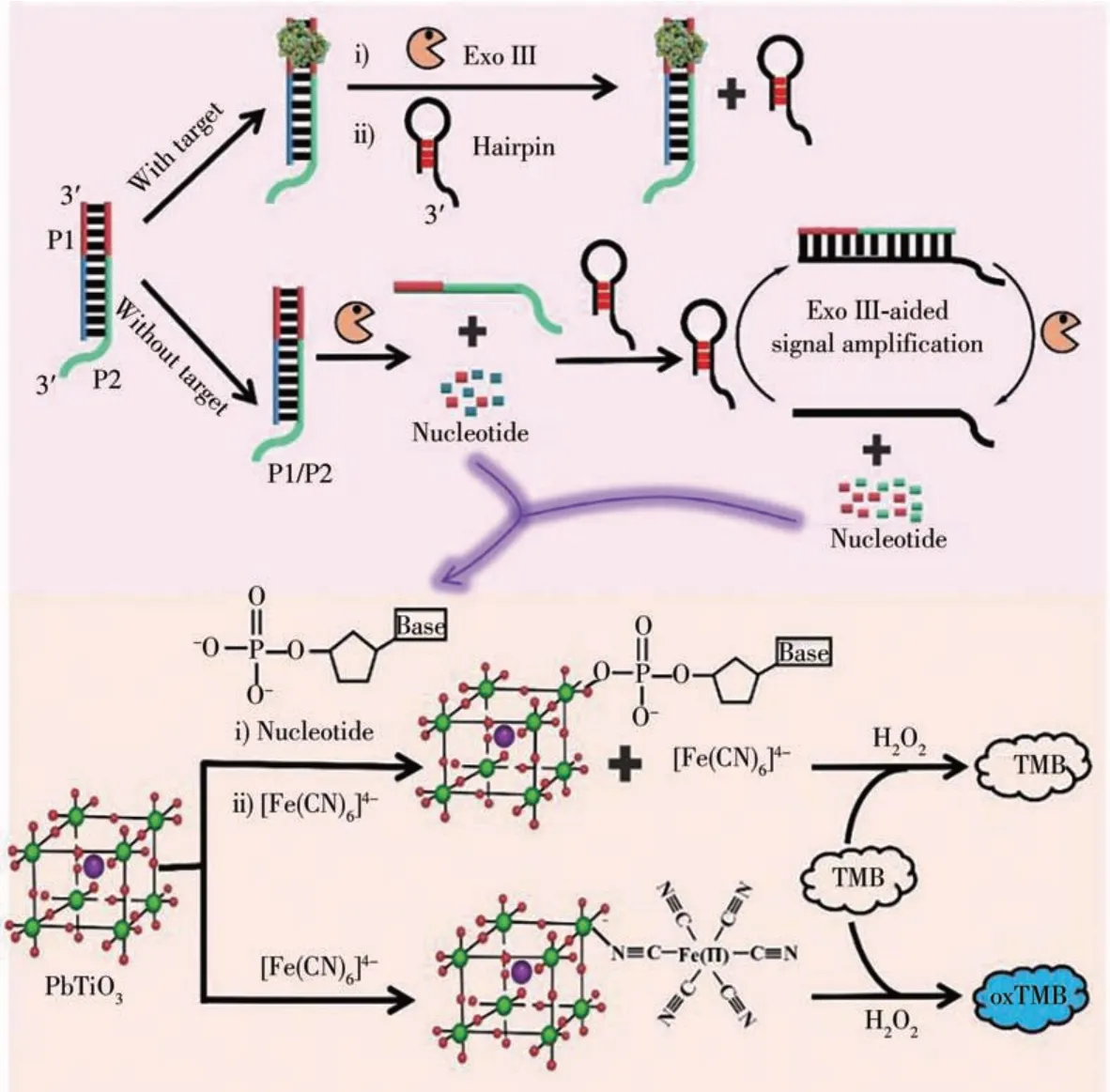
圖7 ExoⅢ輔助的信號放大反應比色檢測NF-κB p50的示意圖Fig.7 Schematic illustration of colorimetric determination of NF-κB p50 by ExoⅢassisted signal amplification
如圖8A和B所示,當不存在NF-κB p50時,P1/P2不影響整個體系的模擬酶活性(曲線a,b),添加ExoⅢ后,P1/P2被水解,產生的dNMP抑制納米酶的形成,導致吸光度顯著降低(曲線d)。引入發夾DNA(Hairpin)后,產生更多dNMP,導致吸光度進一步降低(曲線e)。而存在NF-κB p50時,無法通過ExoⅢ水解產生dNMP,使K4Fe(CN)6能順利結合到PbTiO3表面形成納米酶,導致吸光度恢復(曲線c)。采用凝膠電泳進一步驗證該策略的可行性(圖8C)。相對于泳道1~3中單獨的P1、P2或P1/P2,泳道4中的條帶歸因于DNA雙鏈P1/P2被ExoⅢ水解后的產物P2。將P1/P2、ExoⅢ和發夾DNA混合后(泳道6),由釋放的P2與發夾DNA形成的雙鏈DNA不斷被ExoⅢ水解,同時釋放出發夾DNA用于下一輪水解反應,其位置與泳道5中單獨的發夾DNA的條帶相近。而NF-κB p50的加入阻止了ExoⅢ的水解,因此在泳道7中產生一條遷移緩慢的條帶,上述結果證明該策略是可行的。
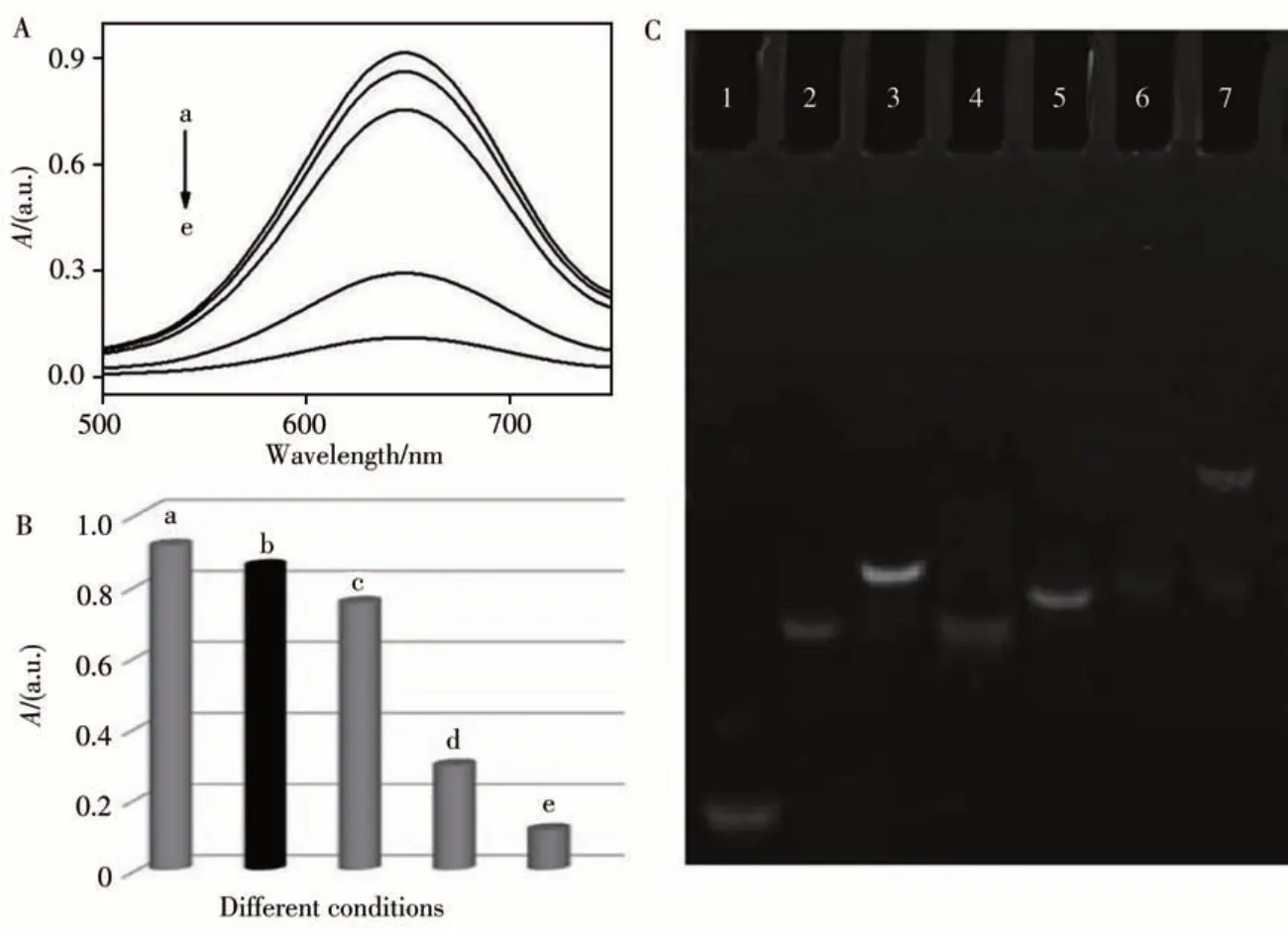
圖8 紫外-可見吸收光譜(A)和oxTMB在不同溶液中的相應直方圖(B),不同條件下的凝膠電泳圖(C)Fig.8 UV-Vis absorption spectrum(A)and the corresponding histograms(B)of the oxTMB in different solutions(C)Polyacrylamide gel electrophoresis image under different conditions
2.4 NF-κB p50的比色測定
考察了加入不同濃度(0、0.003、0.05、0.1、0.3、0.5、1、5、10 nmol/L)的NF-κB p50對體系在最大吸收峰(652 nm)處吸光度的影響。結果顯示,隨NF-κB p50濃度的增加,氧化TMB在652 nm處的吸收強度逐漸增加(見圖9A)。這是由于越來越多的NF-κB p50蛋白嵌入P1/P2,阻止了ExoⅢ對P1/P2的水解,使得反應體系中dNMP的產生較少,隨后K4Fe(CN)6順利與PbTiO3結合,形成的過氧化物模擬酶催化TMB由無色變為藍色。根據圖9B、C,NF-κB p50蛋白的線性范圍為3.0 pmol/L~10 nmol/L,檢出限(LOD,S/N=3)為1.2 pmol/L。與其他已報道的檢測方法相比(表1),該方法由于設計了信號循環放大策略,使得檢測靈敏度提高,具有較寬的檢測范圍和較低的檢出限。此外,與其他不同NF-κB p50的檢測方法相比,這種基于納米酶的比色生物傳感平臺操作更簡便且無需DNA修飾/固定等復雜步驟。

表1 不同NF-κB p50蛋白檢測方法的比較Table 1 Comparison of different methods for the detection of NF-κB p50
為了驗證該方法的選擇性,選取一些可能存在的干擾物,如5.0 nmol/L的牛血清白蛋白(BSA)、甲胎蛋白(AFP)、癌胚抗原(CEA)、前列腺特異性抗原(PSA)、人血清白蛋白(HSA)和NF-κB p65,并對比其與0.5 nmol/L NF-κB p50的信號響應情況。結果如圖9D所示,只有NF-κB p50能引起oxTMB在652 nm處的吸光度增強,說明該方法對NF-κB p50檢測具有較好的選擇性。
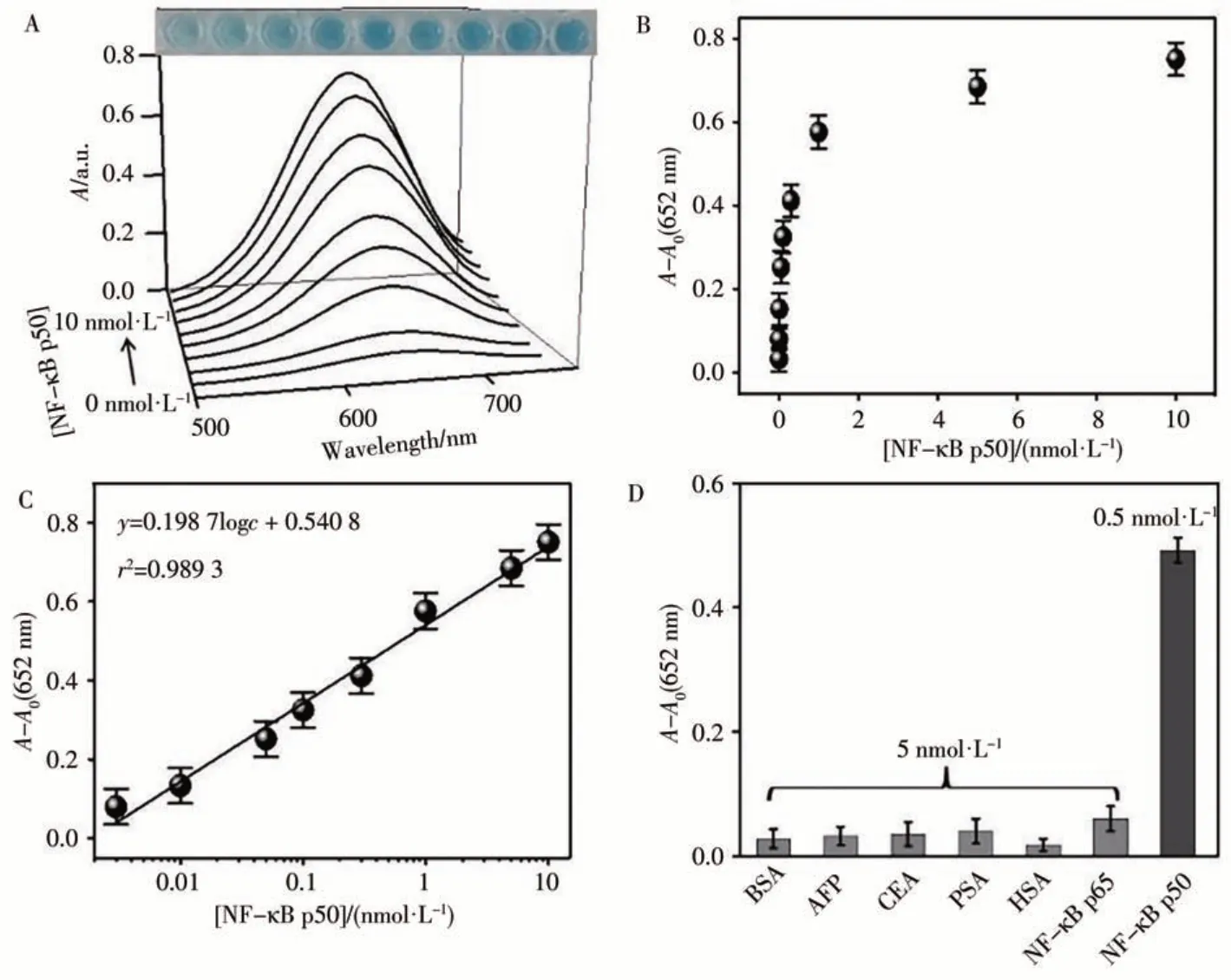
圖9 不同濃度NF-κB p50的吸收光譜(A),NF-κB p50蛋白檢測的線性關系圖(B、C),及檢測方法的選擇性(D)Fig.9 The absorption spectra of NF-κB p50 at different concentrations of NF-κB p50,the linear calibration plots for NF-κB p50 detection(B,C),and the selectivity of the method(D)
采用標準加入法,將HeLa細胞提取液稀釋10倍進行回收率考察(見表2)。結果顯示,NF-κB p50的回收率為99.1%~102%,相對標準偏差(RSD)不大于5.3%,表明該方法對HeLa細胞提取液樣品中NF-κB p50的檢測可行。

表2 HeLa細胞提取液中NF-κB p50的測定(n=3)Table 2 Determination of NF-κB p50 in HeLa cell extracts(n=3)
3 結論
本文通過將K4Fe(CN)6結合到PbTiO3表面原位形成納米酶。以NF-κB p50為目標物,通過引入發夾DNA并借助ExoⅢ輔助的水解過程控制dNMP產生,進而調控PbTiO3表面原位形成的納米酶活性,開發了一種基于納米酶的無標記、無固定和信號放大的生物傳感器,用于靈敏檢測NF-κB p50。本方法不僅提供了一種原位形成納米酶的新策略,還易與能產生dNMP的生物反應相結合,具有靈敏度高、選擇性好、操作簡便的優點。

