磁性側流層析技術在食品污染物快速檢測中的研究進展
翟文磊,韓晨瑞,4,韋迪哲,肖志勇,孔 聰,王 蒙*
(1.北京市農林科學院質量標準與檢測技術研究所,北京 100097;2.北京市農產品質量安全中心,北京 100029;3.中國水產科學研究院東海水產研究所,上海 200090;4.中國農業大學食品科學與營養工程學院,北京 100083)
側流層析法(Lateral flow assay,LFA)是一種基于層析原理建立的快速檢測技術。以條狀纖維為固相,借助毛細管作用使樣品在試紙條上移動,樣品中的目標物與試紙條上一定區域的生物活性材料(抗原/抗體/核酸適配體等)特異性結合,依據信號的變化實現定性、定量檢測[1]。試紙條一般由樣品墊、結合墊、層析膜、吸水墊和輔助結構組成,層析膜上固定兩條或多條不同的生物活性材料構成檢測線(T線)和質控線(C線)。LFA克服了傳統檢測技術步驟繁瑣、耗時長、成本高、依賴大型儀器等問題,具有操作簡單、快速實時、成本低等優點,適用于對特定目標物的現場快速篩查[2]。
磁性納米材料經化學修飾后具有良好的水分散性和穩定性,已被廣泛應用于多種物質的磁分離濃縮和檢測[3]。將具有強磁性和單分散性的磁性納米材料與LFA試紙條相結合,能顯著提高檢測方法的靈敏度、穩定性和重復性。近年來,磁性側流層析法(Magnetic lateral flow assay,MLFA)的開發逐漸成為LFA領域的研究熱點之一,在食品安全領域具有廣闊的應用前景[4]。圖1是在Web of Science數據庫上以“Magnetic lateral flow assay”為主題詞的檢索結果,可以看出,該方向論文的發表量呈逐年遞增的趨勢,表明相關研究已受到越來越多的關注。本文重點介紹近五年MLFA技術在食品安全領域的應用研究進展,根據檢測對象種類,分別從食源性致病微生物和小分子危害物質殘留的檢測兩個方面進行總結,并從技術原理、檢測性能、材料特點等方面展開討論,為相關領域的科研單位、市場監管部門和生產企業提供參考。
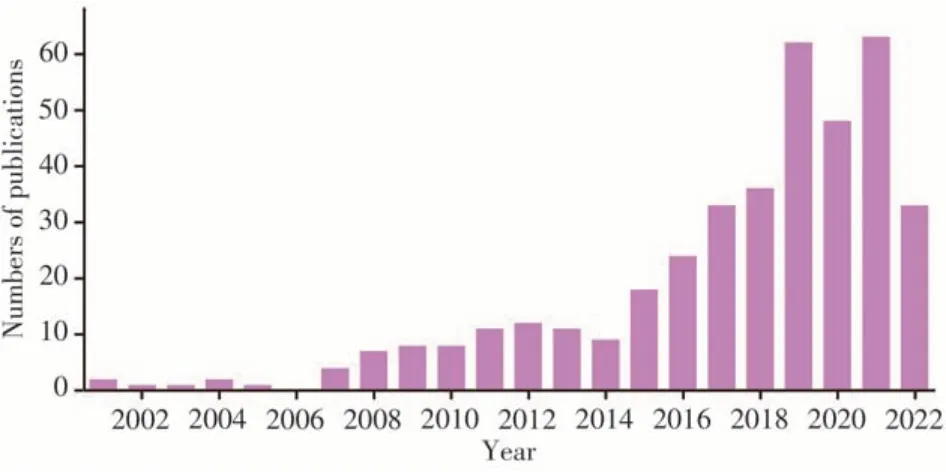
圖1 Web of Science數據庫上以“magnetic lateral flow assay”為主題詞檢索相關文獻按出版時間的統計結果,統計時間截止至2022年6月Fig.1 The data of new publications of MLFA in each year obtained by searching terms“magnetic lateral flow assay”in Web of Science database,the date was until June,2022
1 磁性納米材料
1.1 Fe3O4免疫磁珠
磁性納米顆粒(Magnetic nanoparticles,MNPs)是尺寸為納米級別的磁性材料,以Fe3O4納米顆粒為代表。經表面功能化修飾后的MNPs在外磁場作用下可實現快速分離和富集,高效簡便,適用于樣品檢測中的前處理[5-6]。
目前研究大多采用碳化二亞胺(EDC-NHS)接枝法將抗體修飾在MNPs表面,得到免疫磁珠用于目標物的快速分離與富集[7]。結合了待測物的免疫磁珠經試紙條層析后,根據試紙條上T線和C線的顏色對比進行定性檢測。通過建立目標物濃度與T線和C線上光密度或磁信號強度的關系,實現定量檢測。
1.2 多功能磁性納米復合物
單一的Fe3O4免疫磁珠雖然應用廣泛,但信號輸出方式單一。通過將MNPs與貴金屬、量子點等納米材料進行復合,可制備出兼具磁分離富集和信號輸出雙功能的納米探針,更好地滿足MLFA應用的需求。
將MNPs與金納米顆粒(AuNPs)結合的金磁納米復合物,既部分保留其超順磁性,又能增強其穩定性、電導率、光學性能和表面生物相容性。應用于試紙條中的金磁納米顆粒通常為“金包磁”核殼結構[8],通過自組裝或種子生長法將AuNPs包裹在MNPs表面,再修飾抗體得到功能化金磁納米顆粒。利用AuNPs的光學特性,通過比較試紙條T線和C線上的顏色變化可實現可視化檢測。此外,還可利用AuNPs本身的表面增強拉曼散射(SERS)活性,在其上修飾探針分子進行SERS檢測,提高靈敏度。另一方面,近期也有少量研究通過構建“磁包金”核殼結構[9],獲得兼具超順磁性和等離子體活性的復合納米材料用于血清等復雜生物樣品中特定物質的MLFA分析。
另一類可與MNPs復合的納米材料是量子點(QDs),通過靜電組裝等方法在MNPs上包裹QDs,得到磁性和熒光雙功能納米球[10-11]。利用該材料可在MLFA試紙條上實現熒光定量分析,且標記不同發射波長的QDs可實現對數個目標物的同步檢測,在多靶標檢測中具備優勢[12]。值得注意的是,除了AuNPs和QDs,近期也有將納米酶等材料與MNPs復合用于MLFA的研究報道[13],利用特有的類酶催化活性可實現更靈敏的分析,也為MLFA的發展提供了更多樣化的檢測模式。
2 MLFA用于食源性病原菌檢測
食源性病原菌是影響食品安全的重要風險因子之一,常見的食源性病原菌包括大腸桿菌O157∶H7(E.coliO157∶H7)、腸炎沙門氏菌(S.enteritidis)、傷寒沙門氏菌(S.typhi)、單增李斯特菌(L.monocytogenes)、霍亂弧菌(V.cholerae)、致病性副溶血性弧菌(V.parahaemolyticus)等[14]。這些細菌一般具有多抗原位點,MLFA中一般采取雙抗體夾心法,即結合墊或預處理時加入經標記的待測物的單抗1,T線固定識別待測物不同抗原位點的單抗2或多抗,C線固定抗種屬特異性的二抗,利用T線和C線特定信號強度的變化實現定量檢測。
2.1 E.coli O157∶H7
E.coliO157∶H7是腸出血性大腸桿菌的代表菌株,是引起出血性結腸炎的主要致病菌,很少量菌數的E.coliO157∶H7即可引發感染[15]。由于其嚴重危害,針對食品中E.coliO157∶H7的檢測顯得尤為重要。傳統的檢測方法包括增菌培養、LFA、酶聯免疫分析、聚合酶鏈反應(PCR)等[16]。由于在樣品前處理和檢測靈敏度上的優勢,MLFA近幾年也被用于E.coliO157∶H7的快速檢測。
Dou等[13]提出了一種非標記和雙信號輸出的病原菌檢測方法。如圖2A所示,通過制備聚多巴胺包裹的磁珠,并在其表面修飾鉑納米酶,得到Fe3O4@PDA@Pt復合納米材料。通過聚多巴胺與細菌細胞壁的粘附作用,該納米材料可附著在細菌表面(見圖2B)。當被標記的細菌通過試紙條上修飾了抗體的T線時,待測細菌被抗體特異性捕獲,通過納米材料在T線上的聚集變色實現可視化分析。此外,復合納米材料表面的鉑納米酶具有類似過氧化物酶的催化活性,可催化顯色反應,進一步提高檢測靈敏度(見圖2C)。該方法在目測和顯色模式下對E.coliO157∶H7的檢出限(LOD)分別為102和10 CFU/mL,實現了飲用水和雞肉樣品的快速靈敏檢測。
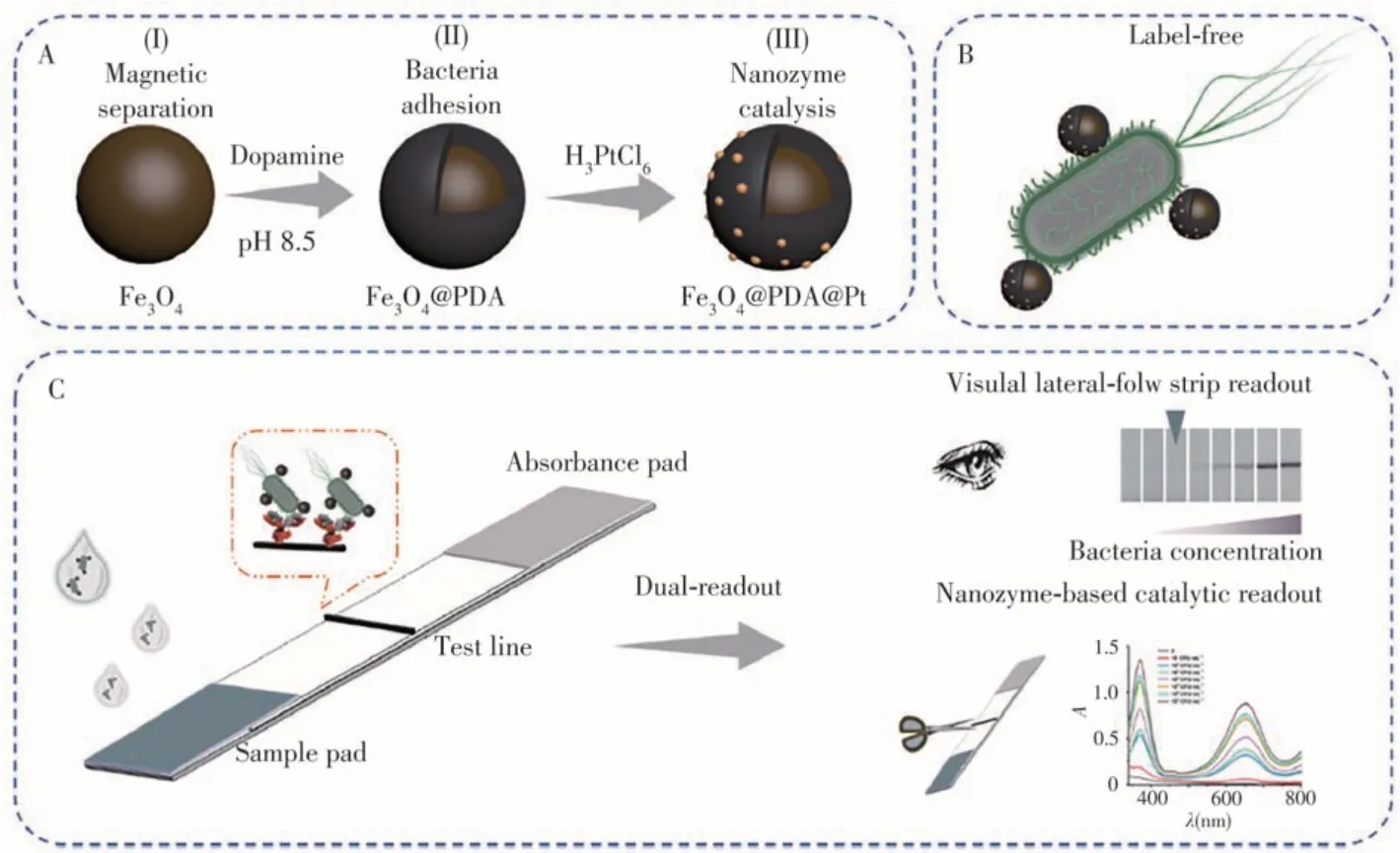
圖2 多功能Fe3O4@PDA@Pt納米復合物的制備(A);基于納米復合物和E.coli O157∶H7互作的非標記策略(B);利用多功能納米復合物和側流免疫層析試紙條實現E.coli O157∶H7雙模式檢測的原理示意圖(C)[13]Fig.2 Preparation process of the Fe3O4@PDA@Pt nanocomposite(A);label-free strategy based on the interaction of nanocomposite and E.coli O157∶H7(B);schematic illustration of the multifunctional nanocomposite mediated dual-readout LFA strip for E.coli O157∶H7 detection(C)[13]
Huang等[17]開發了基于免疫磁珠的MLFA方法用于E.coliO157∶H7的檢測。首先制備了抗體修飾的Fe3O4@SiO2@QDs核殼結構熒光磁珠,該材料在待測溶液中可選擇性結合E.coliO157∶H7,經外加磁場富集后,在免疫層析試紙條上進行檢測。Ilhan等[18]利用免疫磁珠對待測溶液中的E.coliO157∶H7進行富集和純化,同時制備抗體修飾的SERS探針并預先包埋在試紙條的結合墊上,當純化后的樣品溶液經過時,E.coliO157∶H7被SERS探針標記,根據T線和C線上SERS信號的強度實現定量檢測。
2.2 沙門氏菌
近幾年,因沙門氏菌感染引發的食物中毒事件時有發生。該病原菌不僅能感染禽畜導致發病死亡,造成嚴重的經濟損失,且人食用被污染的禽畜產品后,會導致急性腸胃炎等病癥[19]。為有效防范因其造成的食品安全事件,相關部門開展了大量沙門氏菌快檢方法的研究。
Hu等[20]報道了一種基于MLFA的病原菌快速靈敏檢測方法,實現了可視化、熒光和磁信號三種不同模式的信號輸出。如圖3所示,首先,利用抗體標記的Fe3O4@QDs磁珠對傷寒沙門氏菌進行分離和富集,然后滴加在樣品墊上,通過免疫層析試紙條進行分析。磁分離的引入提高了該方法的抗干擾能力和靈敏度,通過可視化和磁信號兩種模式,對該病原菌的檢測靈敏度分別為1.88×104和3.75×103CFU/mL。此外,通過熒光和磁信號兩種模式,可在1.88×104~1.88×107CFU/mL范圍內實現定量檢測。以自來水、牛奶、胎牛血清和全血作為基質,證實了該方法可滿足復雜基質中傷寒沙門氏菌的快檢需求。
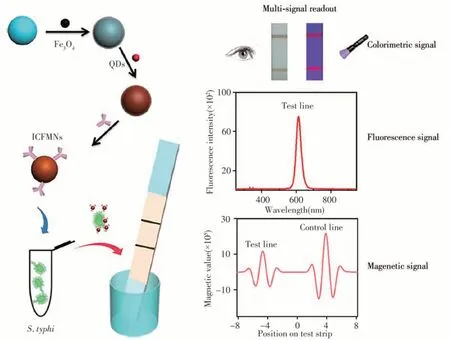
圖3 基于比色-熒光-磁性多功能納米球和側流免疫層析法的傷寒沙門氏菌多模式檢測原理示意圖[20]Fig.3 Illustration of multi-signal readout detection of S.typhi by colorimetric-fluorescent-magnetic nanospheres based LFA[20]
Wang等[21]提出了一種非標記的側流免疫層析法用于腸炎沙門氏菌的現場檢測。以類石墨相氮化碳(g-C3N4)為原料,經煅燒和蝕刻得到表面帶正電荷的富含氮的碳點。該碳點可通過靜電作用吸附在病原菌上,通過在T線上包埋特異性抗體,可將被標記的腸炎沙門氏菌捕獲,導致T線顏色逐漸加深,實現了對低至102CFU/mL目標病原菌的可視化檢測,且在不同的蔬菜沙拉和果汁加標樣品中均得到較好的回收率。此外,該課題組還開發了一種雙識別策略的MLFA技術,用于腸炎沙門氏菌的快速檢測[22]。分別選用抗生素和抗體作為目標病原菌的識別元件,首先制備了氨芐西林包裹的磁珠,該材料對細菌有很好的結合、分離和富集能力。在此基礎上,將T線上的抗體作為特異性識別元件,從待測溶液中選擇性捕獲腸炎沙門氏菌,可達到102~103CFU/mL的可視化檢測靈敏度。相比于傳統的雙抗體夾心法,該方法具有低成本、易制備、靈敏高效的優勢。
以上工作均基于免疫層析技術的原理開發。相比于抗體,核酸適配體具有篩選成本低、制備簡單、易進行化學修飾等優點,此外,通過引入核酸傳感中的信號放大策略,能顯著提高檢測靈敏度。因此,以核酸適配體作為識別元件應用于LFA受到越來越多的關注[23-24]。例如,Gao等[25]近期報道了一種基于適配體和磁分離的MLFA方法,實現了對傷寒沙門氏菌的靈敏檢測。如圖4A所示,修飾了適配體的磁珠與目標細菌結合后,釋放出單鏈DNA1,該核酸片段被修飾了互補DNA2的AuNPs捕獲,利用核酸側流層析試紙條檢測捕獲探針,可實現定量分析。此外,利用核酸雜交引起的AuNPs交聯,可將AuNPs聚集引起的顏色變化進一步放大,提高可視化檢測的靈敏度(見圖4B、C)。通過該方法對培養基中傷寒沙門氏菌的LOD低至8.6 CFU/mL,在牛奶實際樣品中也可達到4.1×102CFU/mL,可作為一種潛在的技術手段用于牛奶中傷寒沙門氏菌的靈敏檢測。

圖4 通過AuNPs聚集體信號增強和磁富集實現高靈敏檢測傷寒沙門氏菌的側流層析示意圖(A);當樣品中分別含(左)和不含(右)傷寒沙門氏菌時,AuNPs聚集體與T線的結合狀態(B);未經AuNPs聚集體信號增強的傳統檢測模式(C)[25]Fig.4 Schematic illustration for the detection of S.typhi using AuNPs aggregates enhanced LFA(A),multifold AuNPs on T line in the presence(left)and absence(right)of S.typhi(B),and single-dose AuNPs on T line in the unenhanced LFA(C)[25]
2.3 其他食源性病原菌
除E.coliO157∶H7和腸炎沙門氏菌以外,還有單增李斯特菌[26]、霍亂弧菌[27]等多種食源性病原菌可引發傳染性疾病,危害人類健康。針對這些病原菌的分析方法開發也是MLFA研究關注的熱點。例如,Li等[28]將免疫磁珠與核酸側流層析試紙條相結合,實現對單增李斯特菌的可視化檢測。首先利用生物素修飾的抗體識別目標細菌,然后加入親和素修飾的磁珠,利用生物素與親和素之間的特異性相互作用與細菌結合,再通過磁分離進行富集。所得產物先用疊氮溴化丙錠處理,以避免死細菌引起的假陽性,最后經DNA提取和PCR擴增,通過核酸側流層析試紙條對擴增產物進行檢測,可在6 h內完成,對生菜樣品中單增李斯特菌的LOD為3.5×104CFU/g。
在另一項研究中,Fang等[29]針對食源性霍亂弧菌開發了快速靈敏的側流層析試紙條檢測方法。以霍亂弧菌ctxA基因為靶標設計引物,并修飾生物素和熒光素。利用重組酶介導的擴增技術對靶標基因進行快速擴增,所得產物分別與熒光素抗體和親和素修飾的磁珠結合,形成的復合物被試紙條T線上的二抗捕獲,通過檢測磁信號強度實現對目標細菌的檢測。在50 min內對蝦仁中霍亂弧菌可視化和磁信號的LOD分別達到100 CFU/mL和46 CFU/mL,有望應用于食品中該致病菌的快速靈敏檢測。
除霍亂弧菌外,副溶血性弧菌是另一種在海鮮產品中較為常見的食源性病原菌。Ying等[30]開發了一種基于核酸適配體的MLFA檢測方法,以適配體為識別元件,通過生物素-親和素結合磁珠進行富集,利用雜交鏈式反應放大信號,通過核酸側流層析試紙條進行可視化檢測。該方法不依賴PCR儀和檢測設備,可在67 min內完成對副溶血性弧菌的特異性檢測。
以上研究表明,MLFA試紙條在多種食源性病原菌的快速檢測中具有很好的應用前景。此類方法結合了免疫磁珠快速分離和富集的特點,以及LFA技術操作簡便、結果可視化等優勢,特別適用于食品生產加工企業和市場監管部門的現場監測和抽檢。從識別原理來看,目前針對食源性病原菌的MLFA主要以抗體作為識別元件,也有少量研究利用核酸適配體對目標物的識別作用實現特異性檢測。而信號輸出方式較為多樣化,包括可視化、熒光、磁信號、SERS、納米酶催化顯色等,且雙信號和多信號輸出模式的策略在近幾年被越來越多的報道,為提升靈敏度和定量能力提供了新的思路。表1列出了部分MLFA用于食源性病原菌檢測的信號輸出模式、檢出限及線性范圍。
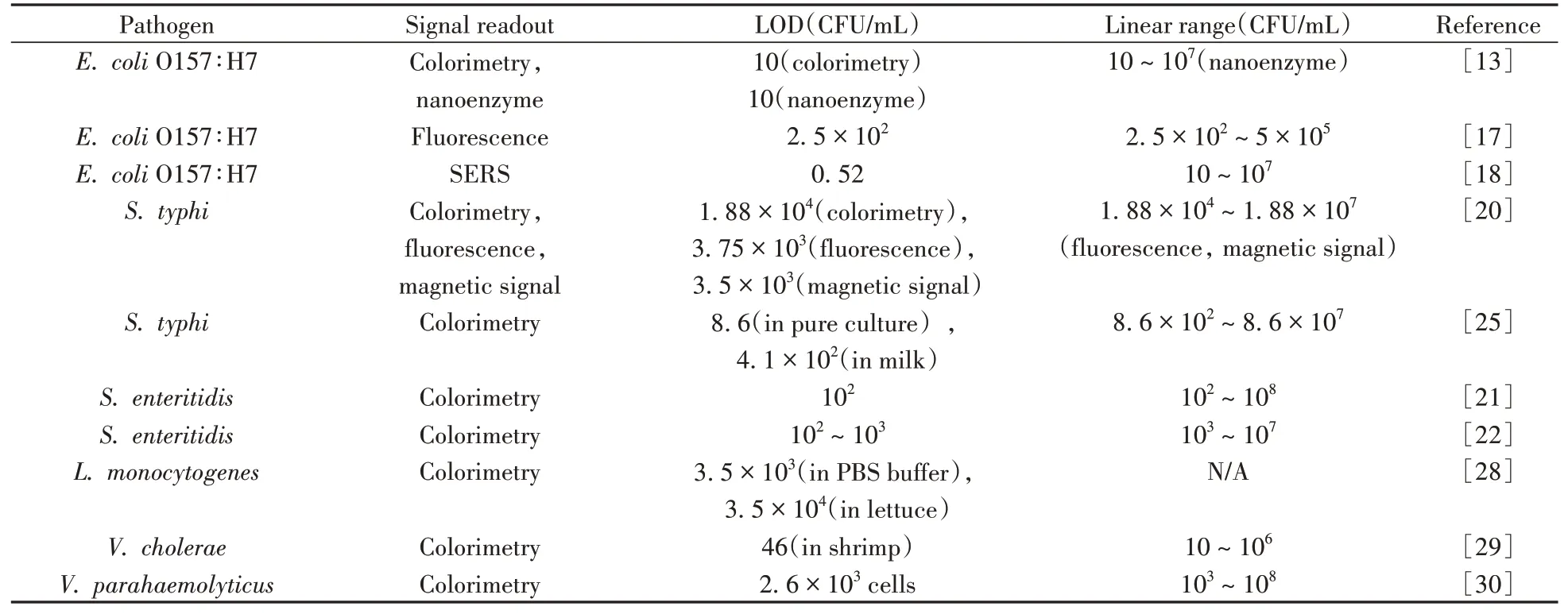
表1 MLFA用于食源性病原菌檢測的信號輸出模式、檢出限及線性范圍Table 1 MLFA detection of various foodborne pathogens with different signal readouts,LODs and linear ranges
3 MLFA用于食品中小分子污染物檢測
除食源性病原菌外,有毒有害的小分子污染物也是食品安全中重點關注的對象[31],包括真菌毒素[32]、農獸藥[33]、非法添加劑[34]等。這些小分子作為簡單半抗原,不具有免疫原性,與抗體的結合價為單價,難以通過類似病原菌的雙抗體夾心法進行檢測。因而,針對小分子靶標的LFA一般采用競爭法的檢測原理。在結合墊上固定或預處理時加入帶有標記物的能識別待測分子的單抗/多抗,T線上固定待測分子的完全抗原,C線上為抗種屬特異性IgG的二抗。當樣品中不含待測分子時,帶標記的抗體與T線上的抗原結合,可在T線處觀察到強信號;當含有待測分子時,其與T線上的抗原競爭結合抗體,T線信號強度隨之減弱,因此可以根據信號強度的變化與待測物濃度的關系實現對待測分子的定量檢測。
3.1 真菌毒素
真菌毒素是真菌侵染農作物產生的有毒次級代謝小分子化合物。常見的真菌毒素包括黃曲霉毒素B1(AFB1)和赭曲霉毒素A(OTA)等,具有致癌、致畸、致突變效應,嚴重威脅人類健康[35]。目前市場上主流的真菌毒素快檢產品多基于免疫層析技術開發。通過與磁性納米材料相結合,可從相對復雜的樣品基質中分離和富集目標毒素[36],進一步提高檢測方法的靈敏度和抗干擾能力。
Guo等[37]將QDs和MNPs包裹在核殼結構的聚合物微球中,制備出抗體標記的磁性和熒光雙功能納米材料,從醬油中純化和富集AFB1后直接用于免疫層析試紙條的分析,對醬油及其提取物中AFB1的LOD分別為51、3 pg/mL,遠低于傳統的熒光免疫層析試紙條產品。此外,該課題組還利用同樣方法制備了OTA抗體標記的核殼結構金磁納米復合物[38](見圖5A),并作為預處理材料對葡萄汁樣品中的OTA進行磁分離富集,重懸后滴加在試紙條上,通過納米復合物與T線上半抗原的競爭結合,讀取光密度值進行檢測(見圖5B)。與HPLC-MS標準方法進行比對,驗證了實際樣品中OTA靈敏快速檢測的可靠性。
AFB1作為毒性最強的真菌毒素而受到食品和飼料安全領域的重點關注,牲畜在食用了被污染的飼料后,AFB1在其體內被轉化成AFM1,有可能進入到乳制品中,進一步危害人類健康[39]。Liu等[40]針對牛奶中AFM1的快檢需求開發了MLFA試紙條,通過對免疫磁珠上抗體載量和磁珠尺寸的優化,在無需額外預處理的條件下對牛奶中AFM1含量的判定值為0.02 μg/L,符合歐盟規定的奶制品中AFM1殘留的最大限量要求。在使用同樣抗體的前提下,該方法的靈敏度比傳統的膠體金免疫層析試紙條提高近50倍。
除AFB1、OTA等霉菌毒素外,以玉米赤霉烯酮(ZEN)和伏馬毒素B1(FB1)為代表的鐮刀菌毒素也是污染農作物的常見真菌毒素。Hua等[41]報道了一種用于谷物中ZEN殘留快檢的磁性免疫層析技術,利用免疫磁珠先對樣品中的ZEN進行富集,再通過基于競爭法的免疫層析試紙條實現可視化檢測,并在智能手機上實現定量結果的直接讀取。所開發的試紙條對玉米和小麥中ZEN的判定值為2.5 μg/kg,產品可穩定保存6個月。
以上研究表明MLFA技術可用于農產品和食品中真菌毒素的快速檢測。然而,這些方法均針對單一目標物開發。近期,Zheng等[42]報道了可同步測定AFB1、OTA和FB1 3種真菌毒素的MLFA技術。通過分別制備不同抗體修飾的磁性QDs納米珠,得到集靶標捕獲和檢測雙功能于一體的免疫探針。分別在試紙條的三條T線上修飾AFB1、OTA和FB1的半抗原,根據免疫競爭原理可以實現3種毒素的熒光分析,并在大米、花生、玉米和果汁基質中進行驗證,實現了多種毒素的同步快速檢測,顯著提高了檢測效率。
3.2 獸藥殘留
隨著人們生活水平的提高,對乳制品和肉制品的需求量也在不斷上升。抗生素等獸藥在養殖業中過量使用,導致獸藥殘留超標的問題時有發生[43-44]。此外,瘦肉精等禁用藥物在牲畜養殖過程中的非法使用屢禁不止,給相關行業的日常監管帶來了嚴峻考驗[45]。
針對瘦肉精的快檢技術需求,Huang等[46]將免疫磁分離和熒光免疫層析技術相結合,開發了可用于豬尿液中克侖特羅的快速檢測新方法,相比于傳統的膠體金免疫層析試紙條,靈敏度提高了4倍,實際樣品中的LOD為0.22 ng/mL,加標回收率為79.1%~108.9%。此外,Wu等[47]通過乙烯基聚合反應將MNPs包裹在表面含磺酸基團的聚合物納米球中,該材料對克侖特羅和其他10種β-腎上腺素受體激動劑均有很高的吸附率,可在30 s內從0.5 g豬肉中提取出克侖特羅,與膠體金免疫層析技術相結合,對豬肉中克侖特羅殘留的LOD為0.1 ng/g。以上方法和材料開發為更有效監測瘦肉精在養殖業中的非法使用提供了新的技術手段。
除瘦肉精等違禁藥物外,抗生素類獸藥在乳制品中的殘留問題也日漸突出。針對這一問題,Liu等[48]構建了氟喹諾酮的免疫磁珠,并結合免疫層析試紙條實現了牛奶中10種氟喹諾酮類抗生素的檢測,檢出限為2~20 ng/mL。在另一項研究中,Yan等[49]建立了一種牛奶中呋喃唑酮的磁性免疫層析快速檢測方法,將MNPs分別標記單抗和羊抗鼠IgG二抗,通過形成帶有網絡結構復合物,只需要標記少量單抗即可達到較好的顯色效果,從而達到信號放大的目的[29]。
相比于病原菌,針對食品中真菌毒素、獸藥等小分子污染物的MLFA技術研究較少。然而,與傳統的膠體金免疫層析法相比,通過引入免疫磁珠,可顯著提高分析方法的靈敏度[50],并能滿足醬油、果汁、牛奶、肉類等復雜基質中微量化合物殘留的檢測需求,因而在對復雜樣品的現場快檢應用中具備一定優勢。表2列出了部分MLFA用于食品中小分子污染物檢測的信號輸出模式、檢出限及線性范圍。

表2 MLFA用于食品中小分子污染物檢測的信號輸出模式、檢出限及線性范圍Table 2 MLFA detection of small molecule contaminants in food with different signal readouts,LODs and linear ranges
4 總結與展望
LFA試紙條作為一種簡單快速的分析載體,在食品安全的多個方面均有廣泛成熟的應用。然而,社會的快速發展給食品安全領域不斷帶來新的挑戰,也對快檢技術提出了更高的要求。如何在現有基礎上,進一步提高LFA檢測的性能,拓展其應用范圍,已成為重點關注的問題之一。近年來,將磁性納米材料和LFA試紙條相結合的研究受到越來越多的關注。已報道的MLFA檢測技術可分為兩大類,一是利用免疫磁珠分離富集目標物后再通過試紙條進行檢測;二是制備多功能磁性納米材料,使其既可用于樣品前處理,同時又能作為標簽用于信號輸出。
目前MLFA技術已被成功應用于食品中致病菌、真菌毒素和農獸藥殘留等有毒有害物質的快速檢測,結果表明該技術能夠滿足復雜基質中目標物的分離富集與靈敏檢測,展現出一定的商品化前景。現階段該方向的研究熱點主要集中在新型磁性納米材料的制備,以及針對新目標物的檢測方法開發。然而,為實現MLFA技術的大規模應用仍需解決一些關鍵問題。首先需要提高磁性納米材料的穩定性,由于多功能納米材料結構復雜,用于MLFA檢測時信號的穩定性尚不理想,因此制備性質穩定、重現性好的磁性納米材料仍然是現階段的研究重點。其次,目前大多數MLFA均使用抗體作為識別元件,而采用適配體代替抗體在靈敏度和檢測成本等方面具有一定優勢[51],值得在后續研究中進一步關注。此外,相比于傳統的LFA,該技術如何在靈敏度、準確性、成本和易操作性上取得最佳平衡,也是需要進一步思考和探索的問題。例如,以智能手機作為檢測工具,可以充分發揮試紙條快速、低成本、易操作的優勢,在實際應用中取得更好的效果。同時,針對傳統LFA難以應對的復雜樣品開發檢測方案,可以發揮磁性納米材料在樣品前處理上的優勢,從而與LFA形成有機互補。最后,試紙條的信號讀取方式可以更加多樣化,例如利用SERS技術,既可提高靈敏度,又能實現多個目標物的同步檢測[52]。可以預期,隨著相關研究的不斷深入,MLFA技術在未來的食品安全快檢中勢必發揮更重要的作用。

