光子晶體微載體三維培養平臺用于HMSN復合載藥系統抗腫瘤效果的初步鑒定
郭欣,郭楠,蔡云朗,徐延華
(1.濟南市婦幼保健院 婦科,山東 濟南 250000; 2.山東省第一醫科大學附屬省立醫院 藥學部,山東 濟南 250000; 3.東南大學附屬中大醫院 婦產科,江蘇 南京 210009)
卵巢癌是女性生殖系統常見的惡性腫瘤之一,因早期癥狀不易被發現,多數患者就診時已處于晚期[1]。盡管目前抗血管生成藥物及聚腺苷二磷酸核糖聚合酶(poly[ADP-ribose]polymerase,PARP)抑制劑在卵巢癌的治療中已處于一線地位,但紫杉醇聯合鉑類的方案仍是治療基石。對于無PARP基因突變的患者,臨床治療仍以化療為主。紫杉醇聯合鉑類藥物的化療方式使得卵巢癌患者的5年生存率接近50%,在有效治療后仍有約70%的患者復發,且復發瘤表現出較強的耐藥性。腫瘤組織中的腫瘤干細胞在腫瘤的增殖、侵襲、復發、耐藥等過程中發揮著重要作用[2-3]。本課題組前期通過中空介孔二氧化硅(hollow mesoporous silica nanoparticles,HMSN)設計的HMSN-COOH@DOXfluorescence NVP包載阿霉素(doxorubicin,DOX)及胰島素樣生長因子-1(insulin-like growth factor-1,IGF-1)特異性的阻斷劑NVP-AEW541,可有效逆轉卵巢癌干細胞的耐藥性,促進其凋亡,抑制其增殖[4]。但前期實驗均在二維平面上進行,為進一步檢測此復合載藥系統的化療效果,本研究設計了三維細胞培養模型,此培養平臺上的細胞形態及微環境更接近體內真實狀態,藥物、營養物質和氣體擴散屬性更接近于活體組織,并且可以與相鄰細胞建立更為緊密的聯系,同時也可更為精確地預測動物實驗和臨床實驗的結果。
1972年,研究者們就已經開始探究細胞在平面及具備黏附功能的三維立體結構中的生長差異[5]。Bissell的研究強調了三維細胞培養在創建精準體外模型中的重要作用,并使三維細胞培養的理念及其獨特的仿生性等優勢被認同[6]。構建三維細胞仿生模型的宗旨即為使得單個細胞可維持正常的三維形狀,具備同在體相似的分化、接受及傳遞信號等功能。基于三維仿生模型在細胞分化、異質性、信息傳遞、基因表達等方面的優勢,使其成為藥物篩選、精準醫療等方面不可或缺的一部分[7-9]。
本研究采用的三維培養平臺為光子晶體微載體,光子晶體微載體利用單乳液微流控裝置生成單分散乳液液滴,再經緩慢干燥固化使得二氧化硅納米粒子自組裝形成光子晶體微載體,并通過高溫煅燒提高微載體的機械強度。由于微載體是通過單分散的二氧化硅納米粒子自組裝得到的,其納米粒子之間會形成貫通的納米孔道,再將生物相容性水凝膠灌注到載體中進行細胞培養[10-12]。本研究首先檢測常規化療藥物DOX、紫杉醇(PTX)、順鉑(CDDP)和5-氟尿嘧啶(5-FU)在三維培養平臺和二維培養平面對CD117+CD44+A2780和A2780細胞增殖抑制和促凋亡中的作用,再檢測課題組建立的復合載藥系統在三維和二維培養環境中對兩株細胞的化療效果。
1 材料與方法
1.1 實驗材料
CD117+CD44+A2780和A2780細胞株購自南京凱基生物公司,光子晶體微載體由東南大學生物電子學國家重點實驗室贈予。
1.2 實驗方法
1.2.1 細胞培養 干細胞完全培養基培養CD117+CD44+A2780,含有10%胎牛血清的DMEM培養A2780細胞,均置于37 ℃、5% CO2培養箱中培養,根據細胞生長情況3~4 d傳代1次。
1.2.2 三維細胞培養平臺的構建 分別收集CD117+CD44+A2780和A2780細胞,調整細胞密度為2×105個·ml-1。取多個光子晶體微載體鋪在96孔板的孔洞中,滴加1 ml的細胞懸液于光子晶體微載體表面,添加對應培養基。37 ℃、5%CO2培養箱中培養24 h,經Hoechst33342染色后熒光顯微鏡觀察并將這些光子晶體微載體轉移至6孔板中繼續培養,24 h后熒光顯微鏡再次染色觀察此微載體。
1.2.3 三維培養平臺及二維培養平面的細胞增殖 按照1.2.2的方式構建光子晶體微載體的三維培養平臺,細胞分別在6孔板中培養24、36、48、72 h后,將光子晶體微載體從培養基中取出并放置在平皿中,加入PBS后用吸管用力吹打微載體,顯微鏡下觀察當光子晶體微載體表面幾乎無細胞附著時取出,離心收集細胞加入培養基制成細胞懸液,使用細胞計數板計數,實驗重復3次。同時,在相同時間點胰酶消化收集二維平面培養的細胞,按照同樣的方式進行細胞計數。
1.2.4 三維及二維培養環境中細胞的化療敏感性 按照上述方式構建兩株細胞的三維培養平臺,待光子晶體微載體轉至6孔板后分別加入DOX、PTX、CDDP和5-FU,調整終濃度為20 μg·ml-1。再收集2×105個·ml-1的CD117+CD44+A2780和A2780細胞,以每孔2×105個細胞的密度接種在6孔板上,加入相應的培養基繼續培養24 h,同樣再加入DOX、PTX、CDDP和5-FU,并調整終濃度為20 μg·ml-1。每組細胞在與藥物共孵育24 h后通過MTT比色法測定抑制率。
1.2.5 三維及二維培養環境中細胞的化療凋亡率 按照1.2.2的方式構建光子晶體微載體的三維培養平臺和相應的二維培養平面,待細胞培養72 h后加入10 μmol的CDDP、DOX、PTX和5-FU共孵育12 h,各組收集5×105個細胞,加入500 μl的Binding Buffer懸浮細胞和5 μl Annexin V-FITC混勻后再加入5 μl Propidium Iodide,室溫下避光反應5~15 min后上機檢測各組的細胞凋亡率。
1.2.6 HMSN復合載藥系統對三維培養細胞的化療效果 根據課題組之前的研究,按照同樣的方法構建HMSN-COOH@DOXfluorescence NVP復合載藥系統,取1 mg分散在10 ml PBS中,在三維和二維培養的CD117+CD44+A2780及A2780細胞中每組分別加入200、400 μl后共孵育12 h,各組收集5×105個細胞,加入500 μl的Binding Buffer和5 μl Annexin V-FITC混勻后再加入5 μl Propidium Iodide,室溫下避光反應5~15 min 后上機檢測各組的凋亡率。
1.3 分組
再將實驗分為HMSN復合載藥系統組和游離藥物組,在三維和二維培養的CD117+CD44+A2780及A2780細胞中加入400 μl HMSN復合載藥系統,游離藥物組加入與此等量的游離DOX和NVP,分別與細胞共孵育12 h 后,按照上述方式檢測各組的細胞凋亡率。
1.4 統計學處理
2 結 果
2.1 光子晶體微載體三維細胞培養平臺的構建
將細胞接種于光子晶體微載體24 h后,經熒光顯微鏡觀察可發現大量的細胞已附著在此微載體上,接種48 h后附著的細胞逐漸增多(圖1)。

A.CD117+CD44+A2780接種24 h;B.CD117+CD44+A2780接種48 h;C.A2780接種24 h;D.A2780接種48 h圖1 光子晶體微載體三維細胞培養平臺A.The CD117+CD44+A2780 cell after inoculated 24 h; B.The CD117+CD44+A2780 cell after inoculated 48 h; C.A2780 cell after inoculated 24 h; D.A2780 cell after inoculated 48 hFig 1 3D cultivation of photonic crystal microcarriers
2.2 三維培養平臺和二維培養平面的細胞增殖
分別在24、36、48、72 h后收集三維平臺及二維培養平面中的CD117+CD44+A2780細胞,統計兩組細胞量;在相同時間點收集兩種培養平臺或平面中的A2780細胞,統計兩組細胞量(表1)。CD117+CD44+A2780細胞在三維培養平臺的增殖速度要明顯快于同時間的二維培養平面(P<0.05),同樣A2780細胞在三維培養平臺的生長速度也顯著增長(P<0.05),見圖2。

圖2 CD117+CD44+A2780和A2780細胞在三維培養平臺和二維培養平面的細胞增殖Fig 2 The cell proliferation of CD117+CD44+A2780 and A2780 on conventional and three-dimensional bionic platforms

表1 CD117+CD44+A2780和A2780細胞株在三維培養平臺和二維培養平面中的細胞量 ×105個·ml-1Tab 1 The cell count of CD117+CD44+A2780 and A2780 on conventional and three-dimensional bionic platforms ×105 ml-1
2.3 三維和二維培養環境中細胞的化療敏感性
三維和二維培養環境中20 μg·ml-1的DOX、PTX、CDDP和5-FU對CD117+CD44+A2780細胞的抑制率明顯低于對A2780細胞的抑制率(P<0.05)(表2)。三維培養環境中CD117+CD44+A2780細胞比二維環境中的CD117+CD44+A2780細胞表現出對以上化療藥物更強的耐藥性(P<0.05),同時三維培養平臺中的A2780比二維培養平面上的A2780的耐藥性更強,抑制率更低(P<0.05)(圖3)。

圖3 三維和二維培養環境中CD117+CD44+A2780和A2780細胞的化療敏感性(* P<0.05)Fig 3 The chemosensitivity in CD117+CD44+A278 and A2780 cell group on conventional and three-dimensional bionic platforms(* P<0.05)
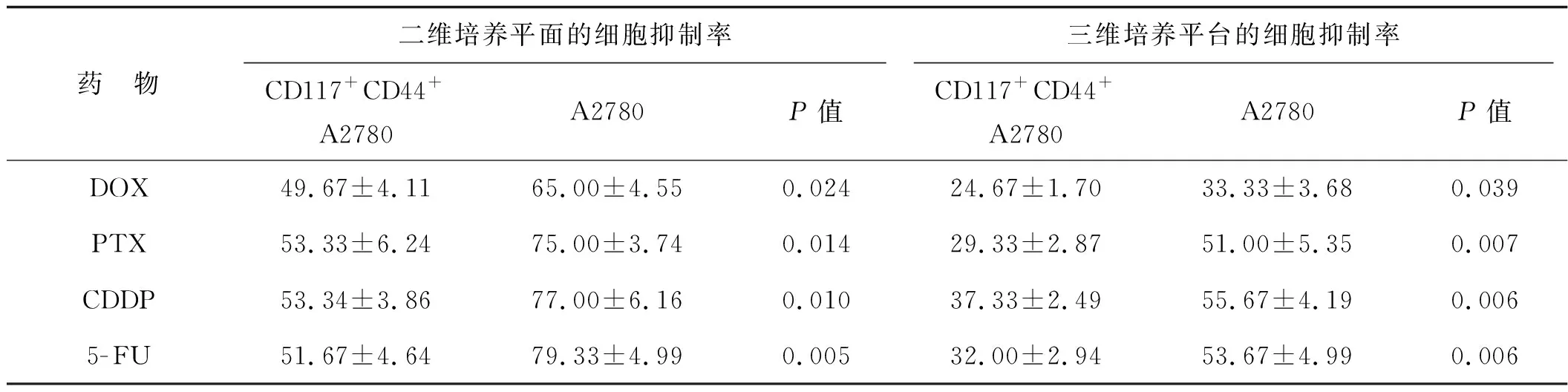
表2 化療藥物在二維培養平面和三維培養平臺對兩組細胞的抑制率 %Tab 2 The inhibition rate of chemotherapy drugs on two cell groups on conventional and three-dimensional bionic platforms %
2.4 三維和二維培養環境中細胞凋亡率
根據流式細胞儀檢測結果,三維培養環境中CD117+CD44+A2780和A2780細胞的凋亡率均低于二維培養環境中培養的細胞(表3),三維培養環境中的細胞表現出更強的抗凋亡作用和耐藥性(P<0.05)(圖4)。

圖4 三維和二維培養環境中CD117+CD44+A2780和A2780細胞的凋亡率(* P<0.05)Fig 4 The apoptosis rates in CD117+CD44+A278 and A2780 cell groups on conventional and three-dimensional bionic platforms(* P<0.05)

表3 CD117+CD44+A2780和A2780細胞株在兩培養平臺(平面)不同藥物組中的凋亡率 %Tab 3 The apoptosis rates of chemotherapy drugs in two cell groups on conventional and three-dimensional bionic platforms %
2.5 HMSN復合載藥系統對三維培養細胞的化療效果
HMSN復合載藥系統的用量在200、400 μl時,A2780在三維和二維培養環境中的凋亡率之間差異無統計學意義(P>0.05)。200 μl HMSN復合載藥系統對二維培養的CD117+CD44+A2780細胞的促凋亡作用要強于三維環境中培養的細胞(P<0.05);當HMSN復合載藥系統的用量提高至400 μl時,兩種培養環境中細胞的凋亡率差異無統計學意義(P>0.05)(表4)。不同濃度的HMSN復合載藥系統對三維和二維的培養環境中的細胞均有較好的促凋亡作用,HMSN復合載藥系統在三維細胞培養環境中對腫瘤細胞和腫瘤干細胞均展現出較為有效、穩定的促凋亡作用。

表4 HMSN復合載藥系統在三維及二維培養環境中對兩株細胞的促凋亡作用 %Tab 4 The apoptosis rates of HMSN compound drug delivery system on two cell groups on conventional and three-dimensional bionic platforms %
游離藥物對三維環境中培養的CD117+CD44+A2780和A2780細胞的促凋亡作用均小于二維培養環境(P<0.05)。在三維培養平臺中HMSN復合載藥系統組CD117+CD44+A2780和A2780細胞的凋亡率顯著高于游離對照組,說明在三維細胞培養環境中HMSN復合載藥系統依然能夠發揮有效的促凋亡作用,特別是對耐藥性和抗凋亡作用較強的CD117+CD44+A2780同時具有高效的殺傷作用,為進一步進行在體實驗提供了依據。見表5、圖5。

表5 游離藥物在三維及二維培養環境中對兩株細胞的促凋亡作用 %Tab 5 The apoptosis rates of free drug on two cell groups on conventional and three-dimensional bionic platforms %
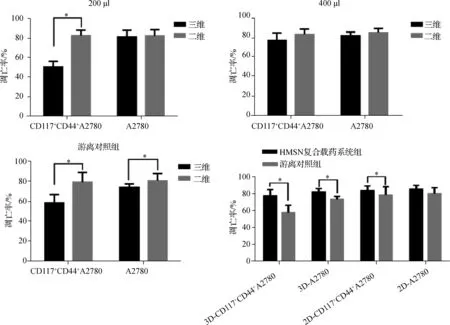
圖5 在三維和二維培養環境中HMSN復合載藥系統和游離對照組CD117+CD44+A2780和A2780細胞的化療敏感性(* P<0.05)Fig 5 The apoptosis rates of CD117+CD44+A278 and A2780 cells in HMSN compound drug delivery system and free drug groups on conventional and three-dimensional bionic platforms(* P<0.05)
3 討 論
卵巢癌的高死亡率與化療耐藥密切相關,近些年來針對卵巢癌的靶向治療一直是探究的熱點,其中借助生物材料的靶向藥物傳輸成為重點的研究方向[13]。針對卵巢癌研發的新型藥物除了在常規的二維培養平面進行其藥效的評估,更重要的是盡量模擬腫瘤細胞的在體狀態,將藥物應用在三維的細胞培養平臺中,更為精確地評估藥效,同時能更為精準地預測動物實驗效果。
本研究借助光子晶體微載體構建了腫瘤細胞的三維培養平臺,光子晶體微載體可為腫瘤細胞提供有效的附著表面,同時光子晶體微載體可懸浮在培養基中,卵巢癌細胞與表面接觸不如二維平面培養中那樣緊密,為卵巢癌細胞提供了更為立體的仿生的增殖環境[14-15]。通過熒光顯微鏡觀察,我們可以發現卵巢癌細胞在光子晶體微載體表面聚集,會形成丘狀細胞團,此三維培養平臺既實現了腫瘤細胞的貼壁培養又實現了懸浮培養。
在體的腫瘤細胞常常表現出更為頑強的耐藥性,進一步降低了臨床化療的效果,本研究將具有腫瘤干細胞特性的A2780和耐藥性強的CD117+CD44+A2780細胞接種培養在光子晶體微載體的三維培養平臺中[16],與傳統的二維培養平面相比,在此三維培養平臺中細胞對常規的化療藥物敏感性均顯著降低,進一步證實本研究的光子晶體微載體培養平臺具有良好的仿生效果,可以作為藥物初步篩選的平臺。我們課題組基于實體腫瘤的組織增強滲透和保留效應(enhanced permeability and retention effect,EPR)和卵巢癌腫瘤高表達IGF-1R設計了HMSN復合載藥系統,按照同樣的方式檢測此復合載藥系統在三維環境中的化療效果。HMSN復合載藥系統對三維培養環境中的CD117+CD44+A2780和A2780細胞均展現出較強的促凋亡作用,當HMSN復合載藥系統的劑量達到400 μl 時,其對三維培養和二維培養環境中的兩株細胞的促凋亡作用無明顯差異,同時其促凋亡作用顯著強于等量的游離對照組,HMSN復合載藥系統在三維培養平臺中對于腫瘤細胞和耐藥性強的腫瘤細胞均可發揮良好的促凋亡作用。
光子晶體微載體作為新型的生物仿生材料,為腫瘤細胞的三維培養模型的構建提供了基礎,為化療藥物的初步篩選提供了理想的仿生環境。HMSN復合載藥系統在三維環境中對腫瘤細胞,特別是耐藥性細胞仍然能夠發揮有效的抗腫瘤作用,為其在動物實驗和在體實驗效果的預期提供了有力的依據。

