大視場光學顯微成像技術
王義強,林方睿,胡 睿,劉麗煒,屈軍樂
(1. 深圳大學 物理與光電工程學院, 廣東 深圳 518060;2. 光電子器件與系統教育部/廣東省重點實驗室, 廣東 深圳 518060)
1 引 言
光學成像系統的信息通量常用空間帶寬積(Space-Bandwidth Product,SBP)來衡量,SBP是一個無量綱數,可以理解為系統視場(Field of view,FOV)內可分辨的像素點個數, SBP越大,系統可傳輸的信息就越豐富。常規的光學顯微鏡,其成像SBP在數百萬量級。系統的SBP提升主要受兩個因素限制:一是探測器的像素尺寸和像素數量,目前隨著以sCMOS為代表的大尺寸高分辨率相機的發展,探測器的像素數已經可以達到2×107,像素尺寸達1.5 μm,因此其已不再是系統SBP的技術瓶頸;二是成像光路,SBP的提升主要受制于顯微系統的成像物鏡。常用的商業顯微物鏡,其SBP在不考慮離軸像差影響的情況下,一般不超過107,因此提升成像光路的SBP是提升整個系統大視場光學顯微成像能力的有效途徑[1]。
提升系統SBP的基本思路有兩種,簡單來說,就是在保持分辨率的基礎上,擴大視場;或者在維持視場的基礎上,提升分辨率。目前,光學顯微系統的分辨率最高可達衍射極限(約200 nm),低至數個μm,由物鏡的數值孔徑(Numerical Aperture,NA)和工作波長λ決定。然而,在實際應用中,分辨率可提升的范圍有限,以熒光顯微成像中的結構光照明技術(Structured Illumination Microscopy,SIM)為例[2],使用線性結構光照明樣品的方法最多可以將分辨率提升一倍,雖然使用非線性結構光可以實現更高的提升倍率,然而其會產生強烈的光損傷,且實際可提升的倍數也有限[3],因此,這種方法并不常用。與之相似的還有傅立葉疊層顯微技術(Fourier Ptychography Microscopy,FPM)。其通過頻域多角度照明的方法實現視場內分辨率的數倍提升[4]。由此可知,利用分辨率提升的措施使SBP達到十倍百倍的提升,并不現實。
而基于擴大成像視場,進而提高獲取圖像像素數的方法,已經得到了有效的驗證[5-8]。一個常用的做法是用高NA,小視場的成像物鏡對樣品做多次成像,再用二維互相關技術等將各子視場的圖像拼接,獲取高分辨率的超大視場圖像。這一方法在組織切片成像,病理診斷等領域已得到廣泛應用[9-10]。拼接成像的優勢在于這一技術非常成熟,系統相對簡單。電動樣品位移臺可以實現樣品微米級精度的二維或三維移動,物鏡掃描系統和自動對焦算法也可以使物鏡在樣品每次移動后實現自動對焦并成像。因此無論是用現有顯微鏡改造,還是購置新品,實現拼接的大視場成像均不困難。然而,對于拼接成像技術,由于其每個子視場在時間上和空間上的采集都是離散的,因此需要更多的采集時間,這些時間更多地被用于樣品移動和物鏡對焦,而不是光子采集。長時間采樣時,來自溫度的變化或環境的振動有可能導致樣品離焦以及產生運動偽影,高NA的物鏡對于環境變化則更為敏感[5]。此外,較長的采樣時間也限制了這一方法的應用范圍,如無法用于大視場的生物樣本實時動態檢測。
綜上所述,通過提升分辨率或者是采用拼接成像的方法提升成像系統的SBP各有弊端:前者的提升能力有限,難以滿足大視場光學顯微生物成像的需求;后者耗時太長,不適用于快速的在體觀測。一類有效的解決辦法是通過直接擴大成像視場來提升SBP。它可以在較短的時間內獲取高像素數圖像[11]。但需要注意的是,系統的SBP受空間分辨率和視場范圍影響,會決定單次成像的像素數上限,而系統的實際像素數還會受探測器的限制,因此探測器的選型需要和系統設計匹配。
2 技術與應用
光學顯微成像系統的SBP常用公式SBP=0.612×π2×r2/F2計算,其中r為系統視場半徑,F為系統分辨率。本文重點介紹了幾種目前發展較好的大視場顯微成像技術,主要有以下4種:一是兼顧高分辨率和超大視場的大視場物鏡成像技術[1,11-12];二是通過曲面探測實現更大視場成像的曲面探測成像技術[7,13-14];三是基于“化整為零”思路的陣列顯微成像技術[15-17];四是徹底擺脫折射光學固有限制的無透鏡顯微成像技術[18-21]。這幾類技術在探索高像素數成像方面取得了卓有成效的進展。本文介紹了這些技術的原理和特點,以及它們在生物醫學領域的最新研究進展,并討論了它們在其他領域,如高速成像方面,存在的挑戰以及可能的解決方案。
2.1 大視場物鏡成像
通過自行設計和定制物鏡,實現大視場的高分辨率成像是近年來大視場物鏡成像的一個重要發展方向。定制的物鏡可以突破傳統物鏡的外形尺寸約束,使整個視場內的分辨率得到提升并提高SBP,目前已有多個設計成果和相應的應用出現。它們的特點是低放大倍率和高NA設計。低放大倍率一方面有利于產生大FOV(Field of View),另一方面也兼顧了實際探測器的感光尺寸。NA值一般在0.5到1之間,成像分辨率可達微米和亞微米級別。2015年,Tsai等人[6]依靠優化透鏡色差實現了10 mm直徑超大視場,但其設計基于4倍放大率0.28 NA物鏡,分辨率過低。McConnell等人[22]設計了一款大視場物鏡, 視場直徑可達6 mm,并具有4倍放大率,NA約為0.5,可用于共聚焦式的點掃描成像和寬場成像兩種模式。共聚焦模式可實現200 μm的成像深度,而落射寬場熒光成像可實現92 frame/s的成像幀率。為實現低放大率下的高NA,物鏡直徑需達63 mm,這幾乎是常用物鏡的兩倍。橫向分辨率為0.6 μm,軸向分辨率為6.3 μm,不考慮像差的影響(后續SBP的計算類似),SBP值約為9.2×107。該課題組使用落射寬場熒光成像模式實現了小鼠胚胎腦部神經元結構的高分辨率多色結構成像。同年,美國的Sofroniew等[12]使用大視場物鏡實現了5 mm超大視場的雙光子熒光成像,激發波長為970 nm時,橫向分辨率可達0.66 μm,SBP約為5.3×107。利用這一成像平臺,結合靈活的掃描策略,他們實現了活體小鼠皮下1 mm深度內的腦皮層神經元結構成像,如圖1所示。然而,大視場物鏡成像和傳統的顯微鏡一樣,都會受到離焦背景的影響,導致實際分辨率低于理論值[23]。雖然共聚焦成像和雙光子成像可以提供良好的光學層切能力,降低了離焦背景的干擾,但是其成像幀率受點掃描模式的制約。例如McConnell等人所設計的基于大視場物鏡的成像系統,采用共聚焦掃描模式時的幀率約為5×10-3frame/s[22]。
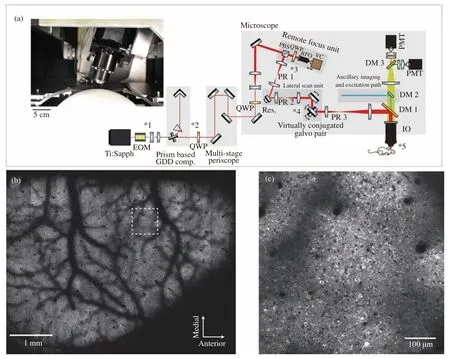
圖1 大視場物鏡雙光子腦成像[12]。(a)成像系統光路圖和物鏡實物圖(左上);(b) 活體鼠腦神經細胞的雙光子成像,深度為150 μm;(c)圖(b)中虛線框內的細節放大圖Fig. 1 Large FOV objective two-photon brain imaging[12]. (a) Optical path diagram of the imaging system and objective lens(upper left); (b) two-photon imaging of neuronal cells activity of mice brain in vivo, the depth of imaging is 150 μm;(c) magnification of some details in white box of (b)
因此,人們將注意力轉向了光片顯微成像(Light-sheet microscopy,LSM)[24]。這是一種可以兼具寬場成像的快速和共焦成像的光學層析技術。但是傳統LSM的聚光鏡和成像物鏡多為普通的商業顯微物鏡,激發區域和成像視場有限,未能突破SBP的限制。因此將光片照明和大視場物鏡結合,則可以實現優勢互補,2018年,Schniete等[25]利用McConnell設計的大視場物鏡,發展了一種基于散斑光片照明的大視場成像系統,實現了0.7 μm的橫向分辨率,7 μm的軸向分辨率。與基于該物鏡的共焦成像模式相比,分辨率幾乎一致,速度卻有了30倍的提升,并且像素數較傳統光片顯微鏡高一個數量級。 與落射寬場成像相比,光片成像拓展了深度成像的功能。利用這一方案,Schniete等實現了對斑馬魚全身的高分辨成像。系統光路和結果如圖2所示。
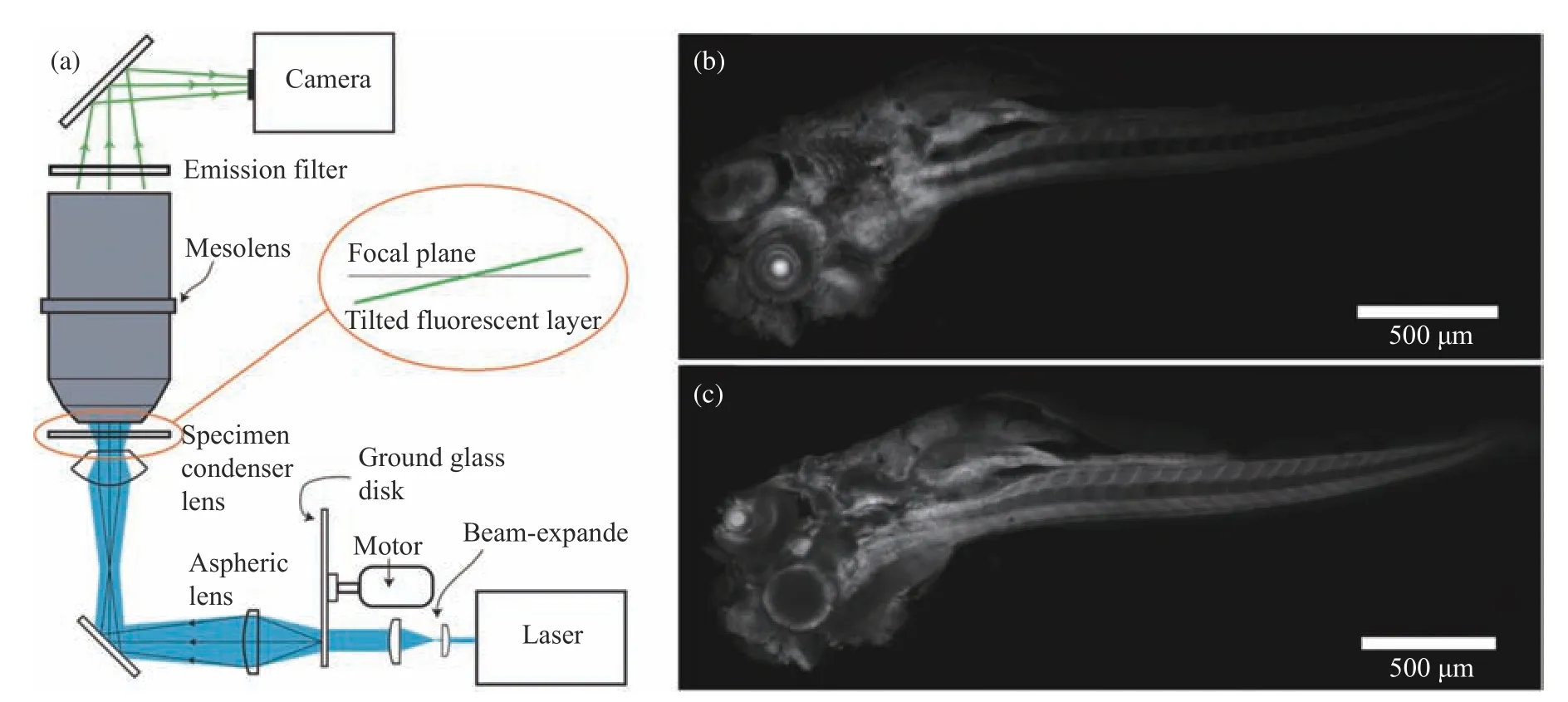
圖2 基于散斑光片照明的大視場成像系統[25]。(a) 系統光路示意圖,激光經磨砂玻璃片形成的散斑圖案投影在體積為4.4 mm×3 mm×3 mm的樣品內,形成厚度約為3 μm的散斑光片照明;(b) 用光片照明模式實現斑馬魚全身成像;(c)用共聚焦模式實現的斑馬魚全身成像Fig. 2 Speckle light sheet illumination-based large FOV imaging system[25]. (a) System setting, the speckle pattern formed by the laser through the ground glass disk is projected into the sample with a volume of 4.4 mm×3 mm×3 mm, forming a speckle light sheet with a thickness of about 3 μm for illumination; (b) Zebrafish whole body imaging with light sheet illumination; (c) Zebrafish whole body imaging with confocal microscopy
雖然大視場物鏡成像系統相對于傳統光學顯微系統實現了SBP一個數量級的提升,然而它所用的物鏡尺寸通常較大,這一方面是由低放大倍率和高NA值的設計要求所限制的,另一方面也是出于像差校正的需要,消除像差所需使用眾多透鏡,增加了成像物鏡的重量和體積,這導致通過移動物鏡來實現樣品體成像難以實現[26-27]。對于寬場成像,場曲等離軸像差會導致圖像中心和邊緣的分辨率產生較大差異,使這一技術難以在生物醫學領域得到廣泛的應用。對于點掃描成像方式,由于常規掃描元件的孔徑較小,若要將掃描光束填充物鏡的出瞳以達到最佳的分辨率,則需增加相應的擴束系統。然而,擴束系統會降低掃描視場角,這導致實際的掃描視場范圍縮小[28],因此需要相對復雜的掃描系統才能實現全視場成像。此外,視場中心和邊緣像差的變化同樣會對點掃描成像的圖像質量產生影響。因此在生物應用領域使用大視場物鏡直接成像依然面臨著諸多限制。
2.2 曲面探測成像
大視場物鏡成像系統雖然提供了大視場高SBP的成像技術,但它是基于物鏡直接成像設計的,大視場條件下離軸像差的影響導致這類透鏡的設計和制造極度困難,并且實際性能差強人意。而在各類離軸像差中,場曲的校正相對不同。根據Seidel像差理論[29],若某一折射面的球差系數為0,則其慧差和像散的系數也為0,而場曲包含匹茲伐爾場曲和像散,匹茲伐爾場曲系數的修正與球差的修正并不同步。一般顯微物鏡的場曲校正需要在實像面處增加負光焦度的場鏡,而這又會重新引入其他像差,使設計愈加復雜,需要更多的透鏡進行校正,并且場曲也是導致獲取的圖像中心和邊緣像質差異較大的原因之一。曲面探測成像技術則放寬了對場曲的限制,利用平面-曲面-平面的成像策略,降低了對主物鏡的像差修正要求,實現了高SBP成像并緩解了設計和制造方面的挑戰。這種曲面探測成像方式早在2002年就應用在天文望遠鏡領域[30]。此外,不同視場處分辨率不一致的情況被大大緩解,因此相對于平面成像,曲面探測可允許對更大的視場成像。其具體方式為:通過一個大視場成像物鏡,將平面物體成像在其后方的匹茲伐爾像面,一般是個球面;其次,將球面圖像光學轉移到傳統的平面探測器上,轉移方法可以是基于波導的傳輸或是使用小尺度相機,或是直接使用曲面圖像傳感器探測[31],但這一方法常用于超大視場全景成像,并不適用于生物顯微成像。
在生物醫學領域,曲面探測成像技術也有較大的進展。2005年Potsaid等[32]利用曲面成像和自適應掃描技術(Adaptive Scanning Optical Microscope,ASOM),將前置主透鏡的每個子像面的場曲交由后置小尺度相機補償,并配備了可變形鏡(Deformable mirror,DM)消除其他的離軸像差,并結合高速二維轉向鏡和定制的掃描透鏡組件,實現了單個后置小尺度相機對前置主透鏡形成的大尺度曲面圖像的串行采集,再通過數字合成,得到40 mm直徑的FOV和1.5 μm的分辨率,成像物鏡的SBP約為6.5×108,比平場設計的大視場物鏡SBP高一個數量級。但是這一方法由于受到串行采集速度的限制,難以用于大視場動態成像。
基于并行采集的成像技術可以有效解決這一問題。一種直接方法是利用與主物鏡像面平行排布的多相機陣列并行采集圖像。每個相機對應的像面則可以近似為平面。此外由于不同相機對應的不同像面具有不同的視場角和像差系數,因此各相機的鏡頭可以針對不同的像差系數做特異性補償,從而實現FOV內成像質量的均衡。清華大學戴瓊海院士課題組開發的RUSH系統就是其中的代表[14]。他們利用一個定制的大視場物鏡和一個5×7的相機陣列,實現了10 mm×12 mm的大視場成像,視場內的分辨率為1.1~1.4 μm ,差異較小。每幀圖像超過1.7×108像素,結合高速數據處理系統,該顯微系統每秒可獲取30幀圖像,共約5.1×109像素。利用這一裝置,該課題組實現了對活體小鼠腦部免疫細胞的長時間追跡。
曲面探測成像技術的核心思路和大視場物鏡成像技術類似,都是通過直接提升成像物鏡的SBP來實現大視場成像。因此,復雜的物鏡設計和高難度的制造工藝,導致系統成本無法降低,難以廣泛地應用到生物醫學研究中。但同時它還揭示了另一個事實,那就是小孔徑系統的像差大小和控制難度遠低于大孔徑系統。基于這一事實,一項新的大視場光學顯微成像技術發展了起來。
2.3 陣列顯微
既然單個顯微鏡的成像視場太小,那么是否可以多個顯微鏡并用以擴大成像視場呢?多軸顯微和陣列顯微回答了這一問題。多軸顯微是將多個顯微成像光路耦合,利用多個探測物鏡,同時探測不同的區域,觀察這些區域之間可能的相互聯系[33-34]。但是在實際應用中,由于光路設置空間的約束,往往只能實現雙光路耦合或三光路耦合[35],雖然這一技術在對如不同腦區的動態響應觀測應用中有良好的表現[36],但其最終SBP的提升有限。陣列顯微是另一類并行大視場顯微成像技術。其與曲面探測成像的區別是陣列顯微將曲面探測成像的主物鏡換成了微透鏡陣列,每一個微透鏡對應一個子FOV,并經過后續的光路成像在探測器上。從本質上看,陣列顯微就是將一組小視場顯微鏡陣列排布后對樣品并行采集,后合并為一張大視場的數字圖像,這與多軸顯微具有異曲同工之處。陣列顯微由Weinstein等[15]開發,該團隊使用的微透鏡陣列包含80個微透鏡,每個微透鏡的NA為0.65,FOV直徑為0.25 mm,對應SBP為~8.7×105,整個系統由80個微透鏡組成,單次成像可獲取一個總SBP為7×107的圖像,其性能已經超越了傳統顯微物鏡。使用該系統,他們展示了一個具有亞微米空間分辨率的225 mm2區域的大型病理切片數字掃描圖。陣列顯微的一個顯著的優點是:相較于需要執行二維掃描才能實現大視場成像的傳統小視場多次成像技術,陣列顯微由于其微透鏡陣列可以設計為傾斜排列,使一個方向上的視場在掃描時存在重疊,因此只需要執行一維掃描既可以實現全視場的覆蓋,結構更簡單,速度也更快,且降低了微透鏡之間的空隙[15,37]。微透鏡的排布示意如圖3所示。

圖3 微透鏡的排列與掃描方向示意圖[37]Fig. 3 Schematic diagram of microlenses arrangement and scanning direction
一個避免機械掃描,僅需通過數字合成的辦法是使用時間順序成像替代機械掃描,2011年McCall等[38]為每個微透鏡提供單獨的照明,且相鄰視場依次成像,從而保證每個微透鏡圖像可以在相機上相互重疊,其代替了機械掃描并且放寬了對放大倍率的約束。近年來陣列顯微和熒光成像的結合也取得了不少進展。早期的陣列顯微鏡,物鏡和管鏡均為微透鏡陣列,雖然結構緊湊,但也使濾光片的介入難以實現,從而無法有效分離激發光和熒光。2013年,Orth等[39]利用水浸的微透鏡陣列成一次像,再用單反相機做二次成像到傳感器上,并將一個高通濾光片置于CMOS傳感器和單反鏡頭之間,實現了小鼠腎臟切片的單色熒光成像,成像視場為1 cm×0.6 cm,橫向分辨率為1.7 μm,系統的總SBP達到了108量級,如圖4所示。Son等[17]利用具有更大NA值(約0.5)的GRIN透鏡陣列替代傳統的球面透鏡陣列,降低了陣列系統的成本和重量。
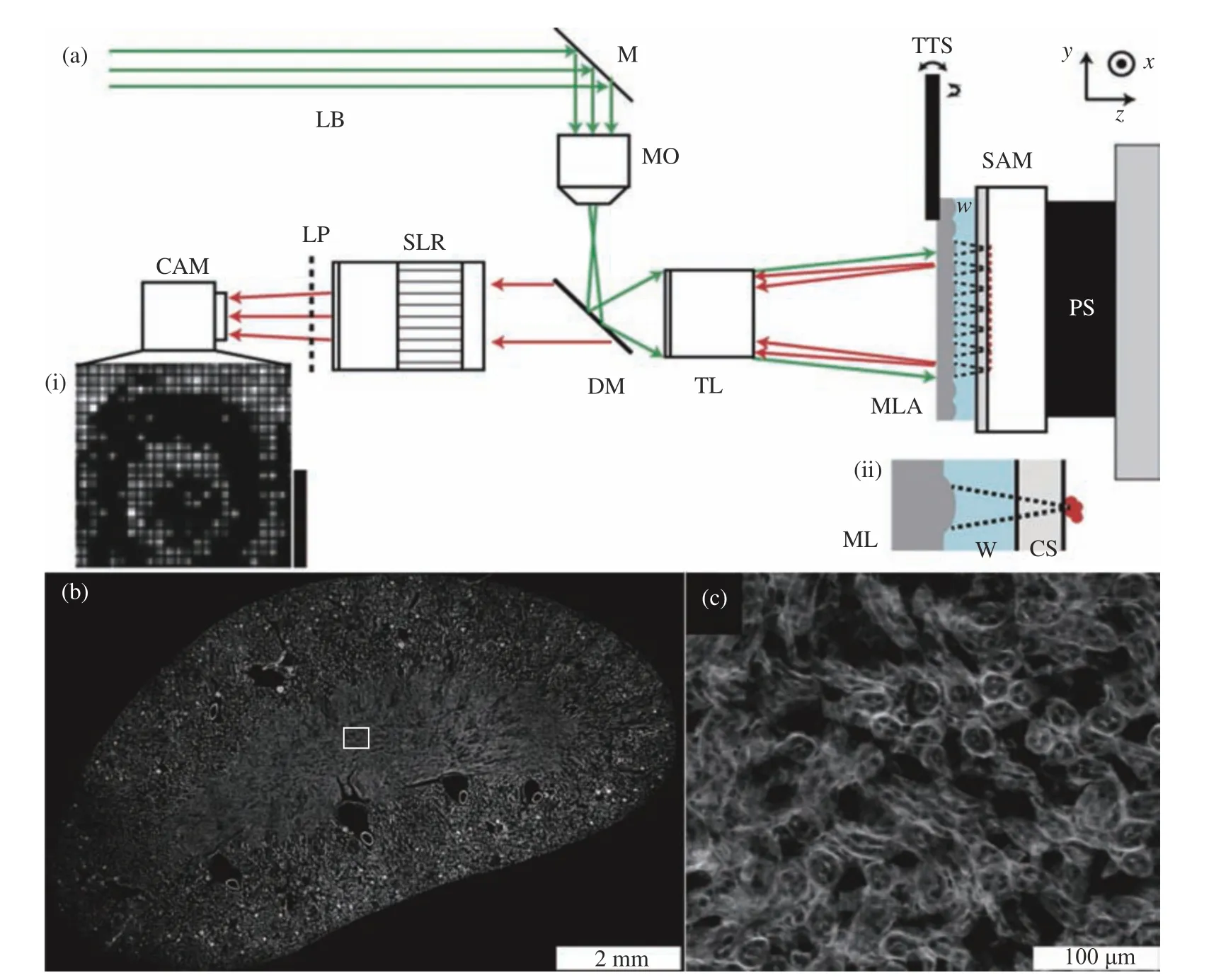
圖4 陣列顯微系統[39]。 (a) 陣列顯微系統光路設置;(b) 小鼠腎臟切片的高通量成像;(c)圖(b)中方框內的放大圖Fig. 4 Array microscopy system[39]. (a) The optical setting of array microscopy; (b) high-throughput imaging of mouse kidney slices; (c) magnification of the rectangle in (b)
陣列顯微成像另一個顯著的優點是由于微透鏡陣列的孔徑可以做到很小,因此一個微透鏡陣列可以由多個微透鏡組成,每個微透鏡所對應的視場角也可以做到很小,例如Orth課題組所使用的微透鏡陣列,其單個微透鏡的直徑為122 μm[16],對應視場角僅有2.5°,因此視場內焦斑的大小和形狀沒有明顯的差異,單個微透鏡對應的視場內分辨率的散布也很小,約1.30 ± 0.15 μm。此外,微透鏡陣列的透鏡數量可以根據需要靈活設置,視場的可拓展性更強,如前述Son的系統就實現了模塊化定制,因此相對于大孔徑物鏡而言便利性更好,結合高分辨率的面陣探測器,可以實現快速的高通量成像。用微透鏡陣列替代常規物鏡的好處在于可以使系統全視場內分辨率散布非常好,并且SBP的擴展相對容易。然而,平面排列的微透鏡陣列結合的焦深有限,使得系統對樣品的表面平整度要求苛刻,陣列顯微的應用場景也因此受到了極大的限制,目前主要用于對組織切片等表面平整的樣品進行成像[40]。
以上提到的3種技術,都是在高分辨率的基礎上通過擴大成像視場,進而提高系統的SBP,最終實現高像素數圖像獲取。這雖然是主要的大視場光學顯微成像方式,但是從系統結構的簡化和實現的難易程度上來講存在劣勢。以下提到的方法相對更具優勢,在一些特殊的大視場光學顯微成像應用領域,已然擁有一席之地。
2.4 無透鏡顯微
無透鏡顯微技術是一種舍棄了傳統的折射光學系統,使用探測器直接對薄樣品成像的技術。在系統復雜度方面,它比基于折射光學的顯微系統簡單的多。在技術難度方面,由于小像素尺寸高像素數量的數字圖像傳感器技術日漸成熟,以及對采集的衍射圖像的處理和重建算法的不斷進步,無透鏡片上顯微技術的實現難度大大下降,目前它的發展已經進入了快車道。按照技術原理,無透鏡片上顯微技術可以大致分為無透鏡陰影成像[41-42],無透鏡熒光成像[19,43-44],無透鏡全息成像[45-46]3種。無透鏡陰影和無透鏡熒光成像都是“所見即所得”的成像方式,傳感器芯片上樣品產生的陰影或熒光分布被傳感器記錄后直接形成圖像。區別在于熒光成像方式需要實現激發光和熒光的分離,具體措施多樣,常用的有利用全反射[19],或在樣品和探測器之間增加濾光片[44],以及將濾光片集成到探測器上[43]。無透鏡全息成像則不同,傳感器獲取的是樣品的相干衍射圖樣,需要利用重構算法恢復樣品的相位信息。
它們的成像視場主要由探測器的感光區域面積決定,目前CCD和CMOS的成像視場大小從20 mm2到20 cm2不等[8,47],取決于具體所用的傳感器。單就成像視場而言,已經遠大于折射顯微系統。就實際分辨率而言,3類技術存在差異,初始條件下,無透鏡顯微成像的分辨率極限基本取決于傳感器像素大小。系統的SBP和傳感器像素數一致,可達到107量級。無透鏡陰影成像可以利用樣品和傳感器之間的微孔徑陣列進一步提升分辨率。2009年Lee等[42]在一個像素數為1 024 pixel×1 280 pixel,像素尺寸為5.2 μm的CMOS芯片上,借助微孔徑陣列,實現了0.8 μm的分辨率,系統SBP約為2×108,提升了約15倍。無透鏡熒光成像則是借助了一些硬件和軟件方法,但目前分辨率通常低于1 μm[19,43-44,48],在SBP方面要低于陰影成像,因此這兩種方法本文不做過多介紹。
無透鏡全息成像的分辨率提升潛力則大得多,這是由于全息衍射成像方式使更多的樣品高頻信息得以被傳感器采集,雖然傳感器的欠采樣會導致部分高頻信息丟失,但是結合像素超分辨和圖像重構算法,能夠盡量還原這些高頻信息,合成高保真圖像,最終系統的SBP可以達到108像素或更多。像素超分辨技術是通過采集多個樣品亞像素移動后的圖像序列,使用多幀圖像的超分辨算法插值合成亞像素超分辨圖像[45,49-50]。常用移動樣品、傾斜照明[46]、旋轉掃描或多波長復用[51]方法獲取多幀圖像,再用移加法[52]或梯度下降法[18]確定插值的像素值。若能事先獲得關于傳感器的光敏區二維像素響應函數,合成后的高分辨圖像可以更精確。二維像素響應函數的獲取需要視情況而定,對于有較大像素尺寸(約5 μm以上)的傳感器(一般為CCD或大像素尺寸的CMOS),可以采用掃描顯微鏡形成直徑遠小于像素尺寸的掃描點,對傳感器像素的感光區域進門掃描,并以信號響應強度為z軸,感光區域為x-y面,形成初步的二維響應函數。其與掃描點的點擴散函數反卷積后可以得到更為精細的二維響應函數。但這一方法難以用于極小像素尺寸的傳感器,如高精度的CMOS,因為掃描點與像素大小相當(均在1 μm左右),此時可以利用二維高斯分布做像素響應函數的初步近似(中心位置一致,x-y方向半高寬與像素大小一致)[50]。值得注意的是,像素超分辨不是傳統意義上的超分辨成像,只是突破了有限像素數導致的有限采樣頻率,進而恢復了部分精細特征,得到更加精細的圖像。
2021年,南京理工大學左超教授團隊[51]利用基于多波長復用的像素超分辨算法,在一塊視場面積為29.85 mm2的無透鏡片上顯微成像系統上,實現了691 nm的線寬分辨率,而對應像素尺寸為1.67 μm,系統SBP約為2.3×108。他們使用了一個超連續譜連續激光器,可用波長范圍為430~1 450 nm,并利用聲光調制器控制輸出波長(450~520~nm),使用直徑為100 μm的針孔進行空間濾波,形成了一個用于照明樣品的準單色球面波前。利用這套系統,他們不但觀測到了單個HeLa細胞的有絲分裂期間不同階段的細胞形態,還可以在全視場內實現細胞追跡,并定量分析了單個細胞的干質量變化,展示了對傳統細胞培養的高通量、長期快速成像的能力。
Zhang等[20]發展了一款超大視場的無透鏡片上顯微成像系統,FOV達到了18.15 cm2,由于他們開發的這套系統是用于高通量的封裝胰島膠囊分析,對分辨率要求不高,因此圖像重建并沒有涉及像素超分辨,最終系統的SBP為6×107。Jiang等[53]將圖像傳感器相對樣品傾斜放置,引入了一個沿橫向線性增加的相位調制,使系統可以在橫向位移的同時完成樣品的離焦多高度測量,解決了傳統多高度相位檢索中精確軸向定位的難題。結合像素超分辨算法,他們在一個120 mm2的視場內實現了690 nm的線寬分辨率,系統SBP超過2.9×108。他們還通過對全視場內1 014個白細胞的自動計數追跡,展示了系統的高通量成像能力。后來,他們又提出了一種分辨率增強的并行編碼疊層高通量成像技術[21],采用了類似散射透鏡成像[54-55]的思路,將傳感器表面的保護玻璃蓋換成了自制的無序表面,如圖5(a)(彩圖見期刊電子版)所示。實現了240 mm2視場內,308 nm的線寬分辨率,SBP約為3×109。他們自制的這一無序表面是由化學刻蝕技術形成亞微米級的相位散射體,并在刻蝕表面印刷了隨機分布的碳納米顆粒后形成的。相位散射體可以將目標相位信息變化轉為強度變化進行檢測,而碳納米顆粒可以將大角度的衍射分量重新定向到小角度,這意味著物體的高頻信息被調制到光學系統的通頻帶[56],因此分辨率能夠得到進一步增強。利用這一系統,他們在像素尺寸為1.85 μm的傳感器上實現了308 nm的線寬分辨率,可以識別樣品中緩慢的相位變化,并利用染色切片驗證了系統的高通量成像能力,如圖5(b)(彩圖見期刊電子版)所示。相較于傳統顯微鏡,這一系統可以用更短的時間對大視場的切片樣品成像,并且系統結構大大簡化,穩定性更高,成本也更低。
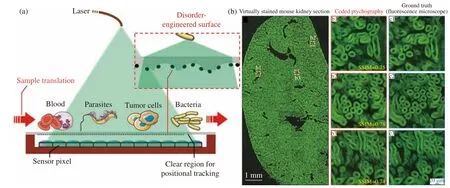
圖5 無透鏡分辨率增強成像系統[21]。(a) 系統結構和其使用的無序表面示意圖;(b) 系統對小鼠腎臟切片的高通量成像,并選取三個子區域b1, b2, b3(圖中紅色框內)的成像結果與使用20 X, 0.75 NA物鏡的熒光顯微鏡成像結果做對比,兩者的相似度約為0.75Fig. 5 Resolution enhanced lensless imaging system[21]. (a) Schematic diagram of system design and the disordered surface;(b) high-throughput imaging of mouse kidney slices. Imaging results of three sub-regions b1, b2, b3 (red boxes) are compared with that of the fluorescence microscope using an objective with 20 X and 0.75 NA. The similarity is about 0.75
總的來說,無透鏡顯微的優缺點都很突出,其最突出的優點在于成功地解耦了分辨率和視場,使其系統SBP提升的方式與傳統解決方法截然不同,其可以通過更少的硬件投入,更多的計算輔助,獲得同樣SBP的成像系統,而且其成本和系統復雜度要遠遠優于傳統的折射顯微系統。同時,它也有明顯的缺點,就是對成像樣品有較高的要求。探測器直接成像模式使得無透鏡成像無法有效區分信號光和散射背景光,因此,實際分辨率受信噪比的影響強烈。此外,衍射全息成像的相干成像條件限制也使得無透鏡成像的樣品厚度有限(<1 mm)[47]。對于不透光,較厚或密集標記的樣本難以使用無透鏡成像技術進行觀察,此外成像的保真度也還有待提升。因此,無透鏡成像目前只適用于一些特殊的應用場景,如高通量的快速切片成像,細胞識別與自動計數等。
2.5 幾種技術的比較
以上簡要回顧了4種高SBP成像技術,雖然它們只是高SBP成像技術的一部分,但卻具有相當的代表性。按照大類它們可以分為基于折射光學的有透鏡成像技術和基于計算成像的無透鏡成像技術。按照小類,對于有透鏡的成像技術,前文著重介紹了其中3種大視場高分辨的成像技術[12-14,17,25,31,34],無透鏡的成像技術重點介紹了無透鏡片上全息顯微成像技術[21,46,51,53],并分享了它們的一些最新進展和成果。對以上這4種技術,就分辨率、視場、適用場景和技術難度進行簡要的總結,如表1所示。
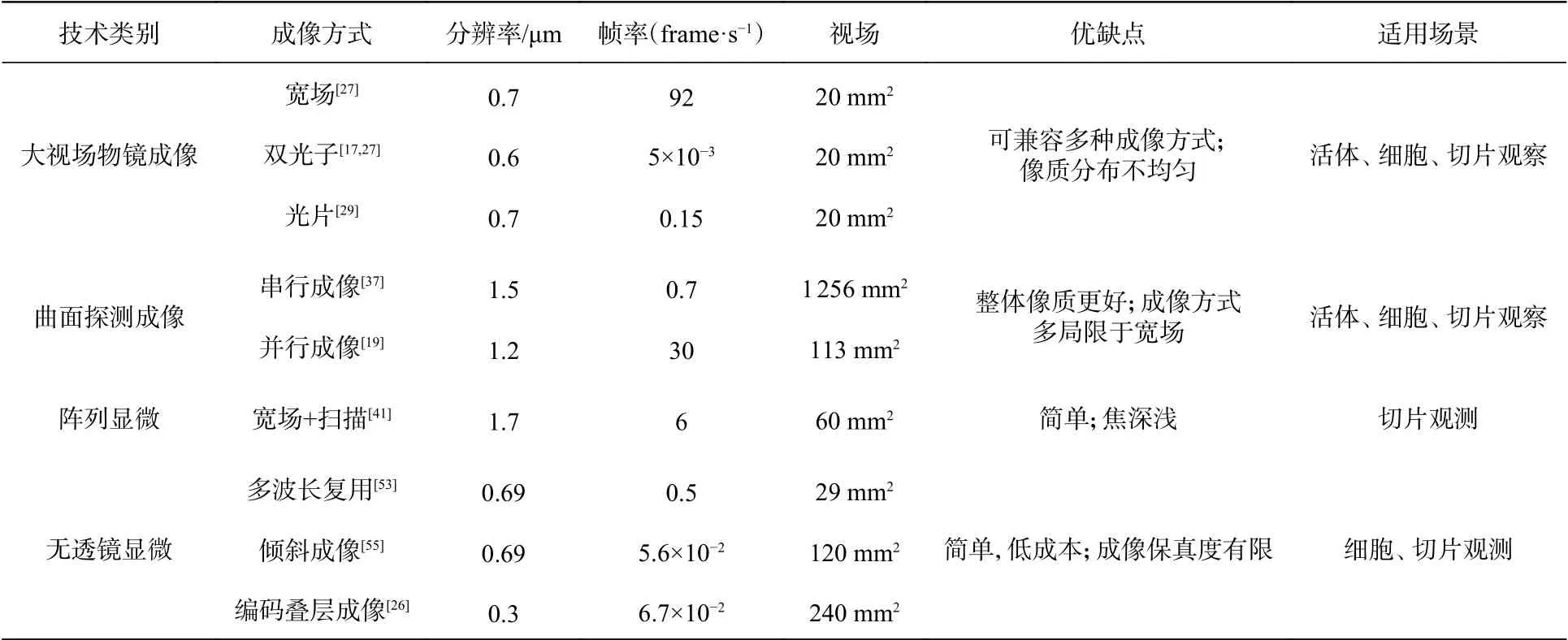
表1 4類典型的大視場光學顯微成像技術參數對比Tab. 1 Comparison of four representative optical microscopy imaging techniques with large FOV
對于大視場物鏡成像技術,使用低倍鏡固然可以獲得更大的視場,但卻損失了分辨率,故其視場擴展潛力相對較小。在保持微米級別分辨率的前提下,其已報道實現的最大視場也沒有突破1 cm2,這樣的物鏡雖說可以兼顧點成像和面成像,但是鏡頭本身的設計制造難度和配套光學系統的設置難度都是極高的。從光學原理出發,使用大視場物鏡成像的技術路線在視場的擴大和SBP提升上的應用前景非常有限,并且只在視場中心附近區域可以實現高分辨率。與之相比,曲面探測成像技術更有潛力,就面成像而言,視場直徑已可達4 cm。但是曲面探測成像的技術難點除了復雜的光路設計以外,還由于需要設置多個相機,導致體積龐大和標定過程復雜。不過就分辨率而言,曲面探測成像的整體效果要好于大視場物鏡成像[14],SBP的上限更高。目前曲面探測成像的發展方向之一是提高成像速度,如RUSH系統可以達到30 frame/s的幀率,但其時間分辨率仍然不能實現成像細胞動作電位的傳播——電位信號的上升和衰減在幾個毫秒內完成。進一步提升成像幀率需要解決高速數據采集、處理、傳輸和多相機同步等問題,最終目標可能需要達到每秒上千幀的成像速率。
陣列顯微因采用并行化的采集思路,視場拓展空間和難度要低于前面兩種。從理論上講,微透鏡陣列的SBP可以隨微透鏡數量的提升不斷提升[15],對于單個微透鏡還可以采用高NA設置實現高分辨率。然而在實際應用上,仍然存在很多限制:微透鏡陣列的物理尺寸本身就難以做的太大。此外,還要考慮實際傳感器的尺寸和數量、中繼光學系統的承接能力、對微透鏡的數量和尺寸依然有限制。此外,物鏡的NA和焦深負相關,高NA設置會使焦深變淺,圖像錯位的概率也會大大增加,因此,陣列顯微單次快照的SBP并不十分突出。但是陣列顯微在病理切片成像,活細胞觀測等領域已有很好的發展,這是因為:相較于傳統的高NA物鏡拼接成像的方式,陣列顯微的單次成像面積更大,所以圖像采集次數更少,成像時間更短,便于實現快速大規模成像;其次,切片樣品薄而平整的特點非常適合陣列顯微;另外,陣列顯微已經發展出多色成像功能,可以快速對切片樣品實現多色成像或光譜成像[40],改善了早期只能單色成像的缺點。已經有研究人員對陣列顯微和傳統的共聚焦顯微鏡結合進行了初步探索[57],有望實現兩種成像方式的優勢結合。
相對而言,無透鏡成像系統非常簡潔,多數元件都來自成熟的商業化產品,另外視場的擴展空間也很大,可以多個芯片并行成像而無需掃描[56],因此它可以在一個成本相對低廉的小型化平臺上實現大視場高分辨成像。雖然只適用于特定范圍的樣品,無法對活體目標等直接成像,但是在細胞計數,細胞示蹤和染色切片成像等領域,無透鏡成像還是展現了極好的應用前景。目前無透鏡成像的發展主要有兩個方向:一是分辨率提升,目前的成像分辨率達不到理想衍射極限,這主要受光源的相干性和傳感器結構設計等的影響,這可通過選擇相干性較好的激光光源、多角度頻移照明和數字解卷積等方法改善;二是成像結果保真度有待提高,這是由于無透鏡成像的實際成像過程會受到多種環境因素影響,實際成像模型與理論模型存在偏差,使得計算重構出的結果和基于透鏡成像的結果存在差異,為改善這一問題,深度學習已經被大量引入,多種基于深度學習的無透鏡成像得到發展,并有效降低了對實際成像過程精確建模的需求,圖像的保真度有望得到進一步提升。此外還有其他幾個方向有待發展,如快速動態全視場無透鏡成像,離焦距離精確測定的無透鏡層析成像等。
3 前景與挑戰
3.1 深度成像
正常的生物樣本都具有一定的厚度,不同深度處的生物組織之間的相互聯系也是生物研究感興趣的重要內容,利用光學顯微技術實現生物樣本的深度成像可以幫助人們有效獲取三維組織和器官的生理信息。由于光在生物組織中存在散射和吸收效應[58-59],導致光學顯微在正常生物組織中的成像深度存在一個軟極限(約1 mm),限制了成像深度的進一步提高。但是在生物研究領域,許多感興趣目標所處深度均超過1 mm。例如在腦科學研究中,哺乳動物的大腦皮層下數個毫米內有豐富的神經元和毛細血管分布,對神經元活動的研究有助于理解大腦功能實現的原理,而對腦部血管的精確成像能夠對一些腦部疾病進行輔助診斷和病因分析,如阿爾茨海默[60]和腫瘤[61-62]等。此外,在大腦內部更深處還有許多其他重要的部分,如負責記憶的海馬體和負責激素調節的下丘腦,垂體等,對它們的成像需要現有的光學顯微鏡在成像深度上取得更多的進步[63]。因此若能實現成像深度的進一步提升,則有望在以腦科學研究為代表的諸多生物研究領域取得更多進展。
傳統的三維成像方法是利用層切技術,即通過機械清除[64-65],或者激光消融[66]等,使較厚的生物組織實現逐層的光學顯微成像,再通過后期處理實現三維圖像恢復,這一點和利用機械掃描方法實現二維大視場拼接成像在思路上是一致的。后來開發出的一系列組織光透明方法[67-69]可以改變生物組織的折射率分布,使其分布更加均勻,從而降低生物組織的高散射特性,增強光在組織中的穿透深度。這一技術目前已應用在皮下微血管成像[70]、神經系統成像[71-73]等領域。隨著基于近紅外II區波段的顯微成像技術的發展,利用近紅外II區在生物組織內低吸收和低散射特性的共聚焦[74]和多光子技術[75-79]均實現了光學成像軟極限的突破,并在活體成像領域取得了豐富的成果。
對于本文提到的4種技術,實現深度成像的適用技術則各不相同。對于大視場物鏡成像系統,使用傳統的層切技術實現三維成像面臨新的問題:由于傳統的層切技術要求形成均勻厚度的薄切片,因此切片的面積往往很小,可能需要多張切片才能使大視場物鏡的FOV得到有效利用[80]。一個可行的思路是利用光片顯微的光學層切能力[24,81-82],通過合理的照明物鏡選型,實現大視場物鏡全FOV內的均勻照明。這一思路同樣適用于曲面探測成像技術。這一技術路線有一個明顯的優勢:由于光片的瑞利長度和厚度正相關,實現毫米視場的光片照明對應的光片厚度很容易達到10 μm以上[82],但是大視場物鏡由于大入瞳直徑和長工作距離的特點,其焦深也可達到數個微米[6],因此大視場物鏡成像和曲面探測成像對厚光片的離焦背景具有更好的魯棒性。此外,由于大視場物鏡具有相對更長的工作距離,與光片技術和組織透明技術結合后,相對于傳統的光片成像技術,有可能實現更大的成像深度。而基于近紅外II區激發的共聚焦或多光子大視場物鏡成像技術可能是個有前景的方向,其可以兼顧大視場和大深度成像,只是在成像速度和分辨率上需要做出一定的取舍。對于陣列顯微和無透鏡顯微,由于只是用于對較薄的樣品進行成像,若要實現深度成像,則還是需要通過多次切片成像。
3.2 超分辨成像
前面提到的高SBP顯微成像儀的分辨率均受衍射極限的限制,若是可以發展一種可以在大FOV的基礎上,實現亞衍射極限分辨率的超分辨成像系統,則可以為探索生物大分子和整體細胞/組織功能之間的聯系提供重要思路[1,83-84]。這是因為,對于生命科學而言,發展一類具有大視場超分辨成像能力的顯微成像技術具有重要意義。一般來說,生物樣本的活體原位觀測最為客觀,最能反映生物組織內最真實的場景。例如,活體器官中的諸多細胞構成了一個精密的微觀世界,細胞之間、細胞和細胞器之間的物質交換、相互作用和遷移等在各種生理現象中發揮著重要作用[85]。而體外觀察很難去重建一個具有眾多生理信號和完整周邊組織的環境,因此所觀測到的動態過程也非自然狀態下的,這一點在駱利群教授課題組[86]近期的果蠅神經發育實驗中得到進一步的證實。然而,觀測這些亞細胞結構或信號大分子需要具有超分辨成像能力的顯微系統,傳統的超分辨成像技術是以犧牲單次成像通量為代價的,完成具有多個細胞的較大視場的超分辨成像需要很長時間,其時間分辨率不足以解析組織內的相互作用和動態過程,影響了生命科學的進一步發展。因此,有必要發展一類不僅可以同時對多個細胞成像且具備亞細胞甚至單分子級別分辨率的大視場的超分辨成像顯微成像系統,它在時間分辨率上的提升有望幫助生命科學領域獲取新的成果。
常用的超分辨技術包括基于點掃描的受激發射損耗[87](Stimulated Emission Depletion,STED),基于單分子定位(Single-Molecule Localization Microscopy,SMLM)的隨機光學重構顯微[88](Stochastic Reconstruction Microscopy,STORM)、光激活定位顯微[89](PhotoActivated Localization Microscopy,PALM)和結構光照明技術[90](Structured Illumination Microscopy,SIM)等,對于可以實現單分子分辨率(10到100 nm)的超分辨技術,其成像視場多在10 μm×10 μm到50 μm×50 μm之間,這一視場只能覆蓋兩三個小細胞或大的細胞的一部分,無法實現高通量成像。
目前原理上可適用于大視場成像的超分辨技術主要集中在SMLM和SIM兩類,而STED受限于點掃描模式,用于大視場成像時速度太慢,一般不被考慮。近年來,大視場的超分辨成像技術主要有以下幾種實現路線:一類是解耦照明和檢測光路,包括基于光子芯片的納米顯微鏡技術[91-93]和基于光片顯微的超分辨技術[81,94-95];二是在傳統的寬場顯微成像的基礎上改進照明模式實現大視場超分辨成像[96-99]。這兩種技術路線目前均能夠使FOV突破100 μm × 100 μm,且分辨率優于100 nm,SBP可以達到107以上。其中,光子芯片是利用全內反射實現均勻照明,主要用于薄切片樣品成像,目前使用低倍率高NA的商業顯微物鏡,最大成像視場可以達到毫米級別,將來有望和大視場物鏡或微透鏡陣列結合使用。而基于光片顯微技術單幀成像視場相對較小,光片的瑞利長度可以表達為2λ/πNA2,其中λ為照明波長,NA為照明物鏡的數值孔徑。因為照明物鏡的NA難以降低,對于0.06>NA>0.02的照明物鏡,通常可以覆蓋50~500 μm的FOV(λ=488 nm),再考慮到生物組織內散射對光片的影響,實際FOV會更小。因此目前借助光片顯微實現超分辨成像的,主要有晶格光片+SIM/PALM的模式[94],或者和寬場成像類似,結合膨脹顯微技術[100]和低倍率物鏡實現超分辨成像。其中膨脹顯微是近幾年的新興技術,其利用聚丙烯酸水凝膠等化學物質吸水膨脹的方法實現生物樣品各向同性的物理放大,從而揭示樣品的納米信息,但系統并未突破衍射極限,這一點和常見的超分辨技術并不相同。目前4倍的膨脹技術已經十分成熟,可以和多種顯微成像方式結合,并成功應用于一系列動物模型,如小鼠[101],斑馬魚[102]和果蠅[103],因此膨脹顯微和前文提到的諸多高SBP顯微成像儀的結合是實現大視場超分辨成像的一個可能解決方案。至于基于照明模式改進方法實現的大視場超分辨,目前實現的成像視場在100 μm到200 μm之間,仍然面臨的一些技術問題限制了其視場的進一步擴大。這些問題包括視場內照明的均勻性問題,樣品表面散斑干擾問題,以及大功率激光照明對物鏡涂層可能的損傷問題等。隨著這些問題的逐步解決,其與大視場物鏡和曲面探測結合將會是個有前景的方向。
4 結束語
綜上所述,高SBP顯微成像儀的發展路線多樣,在性能上也各自取得了很好的突破。基于透鏡成像的3種系統實現SBP的突破相對更復雜,成本更高,但成像的保真度更高,應用場景更廣;而基于無透鏡計算成像的片上顯微實現SBP的突破更簡單、更直接、對算法和傳感器技術進步的依賴更強,但是其分辨率和成像保真度均有待進一步提升,應用場景相對受限。目前,高SBP顯微成像儀多用于寬場成像,其與相對成熟的各類成像模態(雙光子,超分辨等)、制樣技術(組織光透明、層切、膨脹等)的合理搭配,將會使它的應用場景得到有力拓展,文中也介紹了一些成功的實踐案例。除了以上提到的4類光學顯微成像技術外,光學相干層析(Optical Coherent Tomography, OCT)、光聲顯微成像等也在大視場成像領域取得了很好的成果[104-108],其成像原理雖有差異但實現大視場顯微成像的方法相似——多次掃描與應用高SBP成像物鏡等。目前大視場光學顯微成像技術仍普遍面臨成像幀率低這一瓶頸,但隨著傳感器性能和計算機技術的進步,這一問題也必將獲得有效解決,其有望為大視場顯微生物成像提供更好的工具選項。