用于多尺度高分辨率三維成像的雙環光片熒光顯微技術
王 鵬,周 瑤,趙宇軒,費 鵬,2
(1. 華中科技大學 光學與電子信息學院, 湖北 武漢 430074;2. 華中科技大學 武漢光電國家研究中心, 湖北 武漢 430074)
1 引 言
熒光顯微成像技術的誕生與發展為人們探索生物微觀世界的構造與運行機制提供了強大的觀測手段,并極大地推動了生命醫學領域相關研究的進展[1]。近些年來,隨著物理光學、分子生物學、材料化學、計算機等學科的發展,熒光顯微成像技術也在交叉學科研究中得到了廣泛的創新與應用。其中,擁有良好光學層析能力的光片熒光顯微成像技術因其具備傳統寬場和共聚焦這兩種成像方式無法比擬的高軸向分辨率、高通量、低光毒性等優勢在生物細胞和組織器官的三維熒光成像中得到了越來越廣泛的應用[2-3]。
根據光片產生的方式,可以將光片顯微鏡分為選擇平面照明顯微鏡(Selective Plane Illumination Microscopy, SPIM)[4]和數字掃描光片顯微鏡(Digital Scanned Light Sheet Microscopy, DSLM)[5]。選擇平面照明顯微鏡是在照明光路中引入一個圓柱透鏡對光束進行單維度壓縮,在探測物鏡焦面位置形成一個二維平面靜態光片來照亮樣本,讓樣本移動,通過光片就可以依次獲得逐層的圖像信息。數字掃描光片顯微鏡是先將激發光束聚焦成為光線,再用振鏡掃描的方式在成像面快速生成一個虛擬光片來照亮樣本。
目前主流的光片技術中生成光片所用的光束類型主要是高斯光片和貝塞爾光片兩種。高斯光片的厚度與瑞利距離成平方反比,也就是軸向分辨率與成像視野兩者之間存在相互制約。雖然可以利用軸向掃描的方式擴增成像視野,但這種方法顯著降低了時間分辨率[6]。貝塞爾光片是具有自愈特性的無衍射光束,在傳播時能夠保持截面輪廓與光強不變,其干涉可用范圍較長,故可以具有更大的成像視野[7-9]。但光的干涉效應會引入較重的旁瓣,從而導致出現額外的離焦激發與光漂白,這也是貝塞爾光片無法進行活體三維長時程觀測的重要原因。
晶格光片顯微鏡(Lattice Light Sheet Microscopy, LLSM)[10]通過利用空間光調制器產生多束并行排列的貝塞爾光束,再讓它們相干疊加產生一個傳播不變的二維光學晶格,最后沿橫向方向進行一小段距離的快速抖動以形成時間平均的光片,這在一定程度上抑制了無衍射光束的旁瓣效應。但晶格光片無法同時進行多色成像,而且由于對波長敏感、所用設備昂貴、需要二維掃描且能量利用率低等原因尚未在常規實驗室普及。場合成(Field Synthesis)[11]的方法是在特制掩模上掃描線光束再經中繼透鏡將光線圖案共軛到照明物鏡的后瞳,這樣任意掃描或抖動形成的光片都可作為其瞬時強度分布的非相干總和,但這種方式對掃描的硬件控制和精度提出了更高的要求且降低了時間分辨率和光能利用率。不同于傳統的光片成像系統,單物鏡光片顯微鏡不是采用照明物鏡與探測物鏡正交放置解耦合的方式,而是利用同一個物鏡作為激發與收光單元,這一點與寬場和共聚焦類似,但同時又保留了光片顯微鏡層析能力強、光毒性低、具有高通量的優勢,這大大解放了光片顯微鏡固有的空間限制,解決了傳統光片顯微系統光路結構復雜的問題[12-13]。
然而,每一種光片顯微成像系統往往僅是針對某種特定應用場景進行設計搭建的,無法同時滿足多尺度樣本不同的成像需求。比如,以接近衍射極限的超高空間分辨率觀測單細胞尺度精細結構的成像系統無法快速地獲取全器官尺度下整個組織或器官的三維圖像數據,而適用于全器官亞細胞分辨率圖像采集的高通量成像系統無法達到接近衍射極限的分辨率水平。所以能夠兼容單細胞超高分辨率成像乃至打破衍射極限的超分辨成像、針對大體積樣本的高通量成像等不同應用場景,實現多尺度成像的光片熒光顯微成像系統對于節約系統搭建資源、拓寬系統應用領域、提高成像效率有著極其重要的意義,這也是科研工作者們一直致力研究的科研目標。
本文提出一種雙環掩模調控的方法不僅能夠抑制傳統貝塞爾光片旁瓣,而且能夠產生不同尺度類型的無色差靜態光片。基于此方法,設計搭建了雙環調控光片熒光顯微鏡(Double-Ringmodulated Light Sheet Fluorescence Microscopy,DR-LSFM)。該光片系統具備軸向分辨率從數百納米跨越到數微米的能力,并能夠結合不同尺度應用場景的具體成像需求,完成對活細胞、膨脹細胞和全器官尺度透明化樣本的多種成像應用[14]。
2 原 理
傳統貝塞爾光片由于自身嚴重的旁瓣效應會造成較強的離焦激發,這會顯著降低圖像的對比度并給樣本帶來額外的光漂白與光毒性。本研究中在激發物鏡后瞳共軛處放置雙環形掩模,通過干涉兩個同軸貝塞爾光片的方法來降低旁瓣能量占比并產生無色差的靜態光片[15],其光束整形方案如圖1(a)(彩圖見期刊電子版)所示:沿光束傳播路徑依次放置柱透鏡、雙環強度調制掩模和球透鏡,柱透鏡與球透鏡組成4f系統,雙環掩模放置在二者焦點重合處;柱透鏡將入射的圓高斯光束在掩模位置單維度匯聚為線高斯光束,雙環掩模對該線光束進行二元強度調制以得到分段線光束,分段線光束由于球透鏡的匯聚作用發生多級干涉從而在焦點位置左右形成無色差的低旁瓣靜態貝塞爾光片;之后再接入套筒透鏡和物鏡組成的4f系統即可產生符合具體應用需求的光片類型。
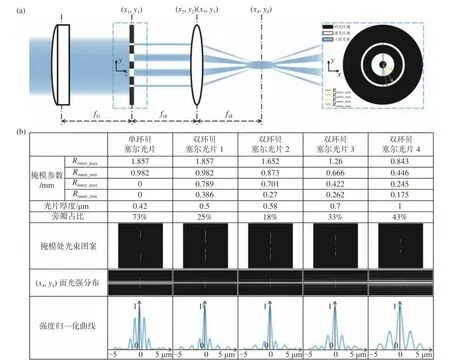
圖1 光束整形原理和光片性能表征。(a)雙環掩模調控生成低旁瓣貝塞爾光片;(b)不同尺度類型光片性能表征及對比Fig. 1 Principle of double-ring beam reshaping and its comparative performance. (a) Lowsidelobe Bessel light sheet obtained by the modulation of a double-ring mask; (b) characterization and comparison of performance of our multi-scale low sidelobe light sheet
為了表征該方法產生的低旁瓣貝塞爾光片的具體特征參數,基于以下理論并結合MATLAB仿真展開相關研究[16-17]。假設入射線光束的光場分布是U0, 掩模的光學透過率函數是P,可以得到掩模后的光場分布為:

由菲涅爾衍射可以得到球透鏡前表面處的光場分布U2:
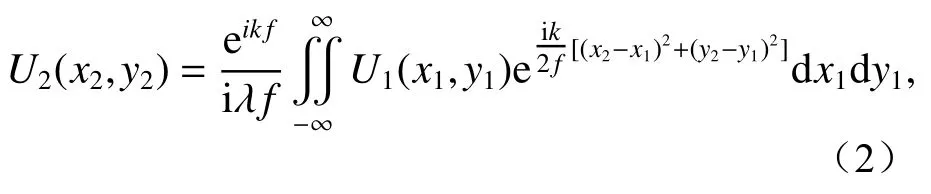
其中λ是入射光波長,之后球透鏡會對入射光進行相位調制,那么經過球透鏡相位變換后的光場分布U3為:
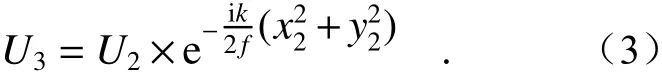
同理,從球透鏡到后焦面處的傳播過程也可以由菲涅爾衍射過程進行推導,則球透鏡后焦面處的光場分布U4為:
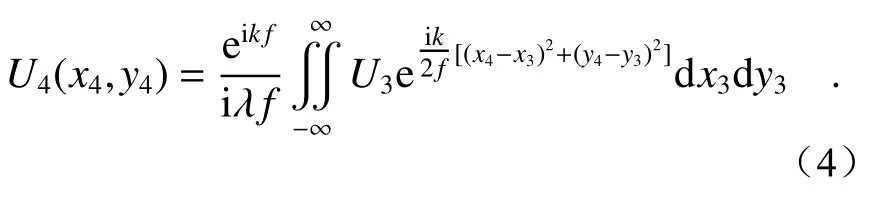
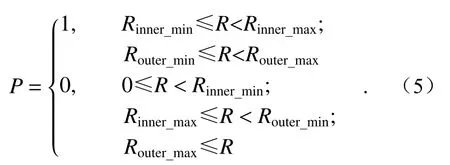
將上式中的焦距值f替換為變量d時就能得到距透鏡任一距離d處的光場分布,進而可以實現低旁瓣貝塞爾光片三維強度信息的重構。通過觀察屏上的光強分布發現其主要受雙環強度調制掩模的光學透過率函數P影 響,而P由雙環的幾何尺寸決定,也就是內環與外環的4個半徑參數:Router_max、Router_min、Rinner_max與Rinner_min,所以其透過率函數P應為:
精細調整雙環掩模4個半徑之間的數值關系,也就是改變其透過率函數,采用上述整形方案不僅可以得到高斯、單環貝塞爾、雙環貝塞爾這些不同類型的光片,同時也可以得到不同厚度與旁瓣占比的多尺度雙環貝塞爾光片。
圖1(a)中的光束整形方法會在球透鏡后焦面位置形成初級雙環貝塞爾光片,實際應用中會在該球透鏡后接入套筒透鏡與照明物鏡組成的4f系統,從而將初級光片放縮至照明物鏡的工作距離處以產生實際可用的雙環貝塞爾光片。由于球透鏡與套筒透鏡也按照4f系統放置,二者的功能是將掩模處調制后的光束圖案傳遞至物鏡后焦面,因此可以將圖1(a)中的球透鏡視作照明物鏡來執行上述光學衍射傳遞過程。
通過MATLAB仿真重構出雙環貝塞爾光片的三維強度分布模型,提取(x4,y4)面的強度分布信息如圖1(b)所示,在該面中心位置沿y方向做強度歸一化曲線即可得到光片的旁瓣占比;另外,將歸一化曲線的中央主峰數值做高斯擬合:

得到擬合方程后,計算強度下降到最大值一半時所覆蓋的范圍即是光片的厚度參數h:

圖1(b)是基于Special Optics公司的一款長工作距離水鏡(焦距為7 mm,工作距離為3.74 mm)在不同的掩模參數下獲得的多種類型光片的仿真結果。當換用不同的照明物鏡時,最終產生的光片的整體尺寸會根據焦距值的變化產生數倍的放縮。
3 基于雙環調控的多尺度光片顯微成像系統
顯微成像系統大體分為4個模塊,包含光片整形及照明模塊、雙色同時探測模塊、樣本運動及時序控制模塊和寬場模塊。系統光路如圖2(a)(彩圖見期刊電子版)所示。
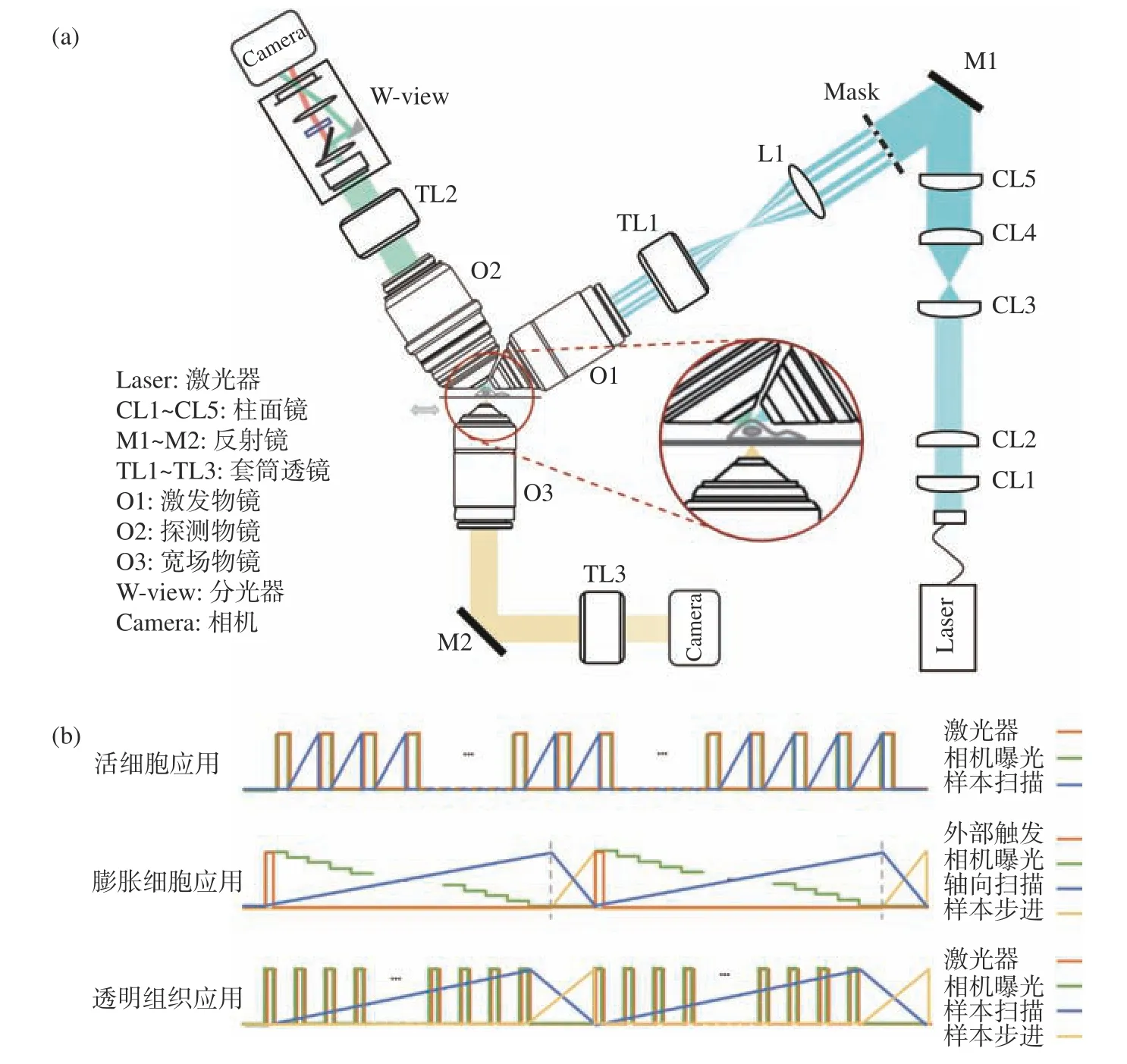
圖2 系統光路圖與時序控制圖。(a)多尺度光片顯微成像系統光路圖;(b)不同應用場景的時序控制圖Fig. 2 Schematic diagrams of the proposed system and the timing control flow charts. (a) The optical design of our multi-scale light sheet fluorescence microscope; (b) the control charts for different imaging applications
3.1 光片整形及照明模塊
該模塊包括激光產生模塊、光束整形模塊以及光片激發模塊3個部分。
3.1.1 激光產生模塊
考慮到系統需要進行多色同時成像應用以及光學元件對入射光的衰減作用,需要峰值功率較高且穩定并且能夠進行多波長激發的激光器。這里選用Cobolt Skyra系列的一款四波長合一激光器,能夠同時進行405、488、561、633 nm 4個波段的激發并且每個通道都能夠達到50 mW的出射功率。
3.1.2 光束整形模塊
如圖2(a)(彩圖見期刊電子版)所示,入射激光由光纖準直頭準直后引入光路,先經過兩組柱透鏡分別在兩個維度進行5倍擴束,再經一個柱透鏡聚焦為線高斯光束,掩模放置于該柱透鏡焦面處形成衍射圖案,之后經過一組中繼透鏡將衍射圖案投影在照明物鏡的后瞳面上,照明物鏡對其進行傅立葉變換并在其焦點附近產生光片。通過移動掩模板位置讓線高斯光束入射到不同尺寸的雙環圖案上,從而產生不同厚度類型的低旁瓣貝塞爾光片。
3.1.3 光片激發模塊
光片激發模塊中,核心元件是照明物鏡。在單細胞尺度的成像應用中,選用Special Optics公司的28.6倍水鏡作為照明物鏡,考慮到系統搭建過程中各個元件的空間位置及角度擺放,將照明光軸設計為與水平面成31.5°角傾斜。在更大尺度的膨脹細胞成像應用中,在照明物鏡端安裝物鏡掃描器增加光片的軸向掃描功能,實現掃描范圍和深度的數倍擴增。在全器官尺度樣本的高通量成像應用中用Olympus的4倍長工作距離空氣鏡作為照明物鏡,一方面給樣本在大范圍內的掃描移動提供足夠的空間,另一方面可在保證入射光能量利用率的前提下產生數微米厚度的光片。此外,搭配自主設計定制的樹脂隔離罩以避免折射率匹配液對鏡頭的損傷。
為了讓該系統具備優異的多色成像能力,系統搭建時選用的所有透鏡元件與物鏡均具備良好的消色差功能,可以讓不同波長的激發光能夠在光軸上的同一位置形成雙環貝塞爾光片。這樣不同波長的激發光形成的光片在空間位置上就具有高度的重合性,使得探測端不同波長通道內的信號擁有一致焦面與成像視野。
3.2 雙色同時探測模塊
圖像的光學分辨率與探測物鏡的數值孔徑(Numerical Aperture, NA)直接相關,物鏡的NA值越大收光能力越強,獲取的圖像分辨率越高。在單細胞尺度的成像應用中,對分辨率有著較高的要求,選用Olympus的60倍水鏡(LUMFLN×60/1.1 W, Olympus)作為探測物鏡,可為圖像提供較高的橫向分辨率。通過在探測光路中加入消色差分光器件(W-View),使得相機的上下靶面能同時記錄不同通道的熒光信號。全器官尺度的高通量成像應用中圖像只需達到三維亞細胞分辨率水平,所以選用Olympus的10倍水鏡(UMPLFLN×10/0.3 W, Olympus)作為探測物鏡,最大程度提高成像通量。
3.3 樣本運動及時序控制模塊
光片成像系統中需要針對不同應用場景編寫合適的時序控制程序來協同控制掃描位移臺、相機、激光器等硬件設施,圖2(b)(彩圖見期刊電子版)是該系統在不同應用場景下的時序控制原理示意圖。活細胞成像應用中,掃描位移臺為壓電陶瓷線性精密定位器,膨脹樣本應用中增加探測物鏡掃描器,全器官尺度樣本高通量成像應用中增加步進位移臺(步進方向與掃描方向垂直)。基于LabVIEW軟件編寫對應的時序控制程序來完成成像目標的三維數據獲取。
3.4 寬場模塊
在活細胞和膨脹細胞的成像應用中,基于光片的熒光探測光路可以實現極高的空間分辨率,但是高倍物鏡下的成像視野有限,不利于快速篩選合適的成像樣本及成像區域。因此在系統中加入寬場光路,選取低倍率空氣鏡作為寬場照明及探測物鏡,利用大視野實現對樣本的高速篩選與定位。
4 多尺度高分辨率三維成像應用
4.1 單環貝塞爾光片與雙環貝塞爾光片成像性能對比
為了驗證DR-LSFM相對于單環貝塞爾光片旁瓣減弱的效果,在該系統上分別使用厚度同為2.5 μm的雙環貝塞爾光片與單環貝塞爾光片對直徑為100 nm的熒光微球進行三維成像,獲取可以驗證光片性能的點擴散函數。
在該對比實驗中,掩模位置的光入射功率保持一致,曝光時間均為30 ms。由于雙環掩模光能量利用率更高,獲得的圖像對比度更好,這一點
在圖3(彩圖見期刊電子版)的成像結果中也得以驗證。另外,更重要的一點,由圖3可見,單環貝塞爾光片的旁瓣能量占比嚴重,而DR-SPIM的旁瓣抑制效果明顯,這不僅可以提升生物樣本三維體成像的圖像質量,而且能夠降低光片激發給樣本帶來的光漂白與光毒性。

圖3 單環貝塞爾光片與雙環貝塞爾光片成像性能對比。(a)使用旁瓣占比73%的2.5 μm單環貝塞爾光片獲得的點擴散函數x-z面最大強度投影;(b)使用旁瓣占比18%的2.5 μm雙環貝塞爾光片獲得的點擴散函數x-z面最大強度投影Fig. 3 Comparison of imaging results between single-ring Bessel light sheet and DR-SPIM. (a) x-z plane max intensity projection of point spread function by 2.5 μm single-ring Bessel light sheet with 73% side lobes; (b) x-z plane max intensity projection of point spread function by 2.5 μm DR-SPIM with 18% side lobes
4.2 線粒體外膜的高速低光毒性成像
為了證明DR-LSFM可以對活細胞的動態過程進行高速、長時程成像,以1 vol/s的體成像速度對U2OS細胞中的線粒體外膜進行了連續數百個時間節點的觀測。
由圖4(彩圖見期刊電子版)的可視化結果可以看出,該系統能夠以1 vol/s的體成像速度快速獲取整個細胞內線粒體外膜的三維圖像數據,對樣本進行連續180 s的觀測后圖像信噪比沒有明顯降低,說明該長時程成像過程并沒有給細胞帶來嚴重的光漂白或光損傷。
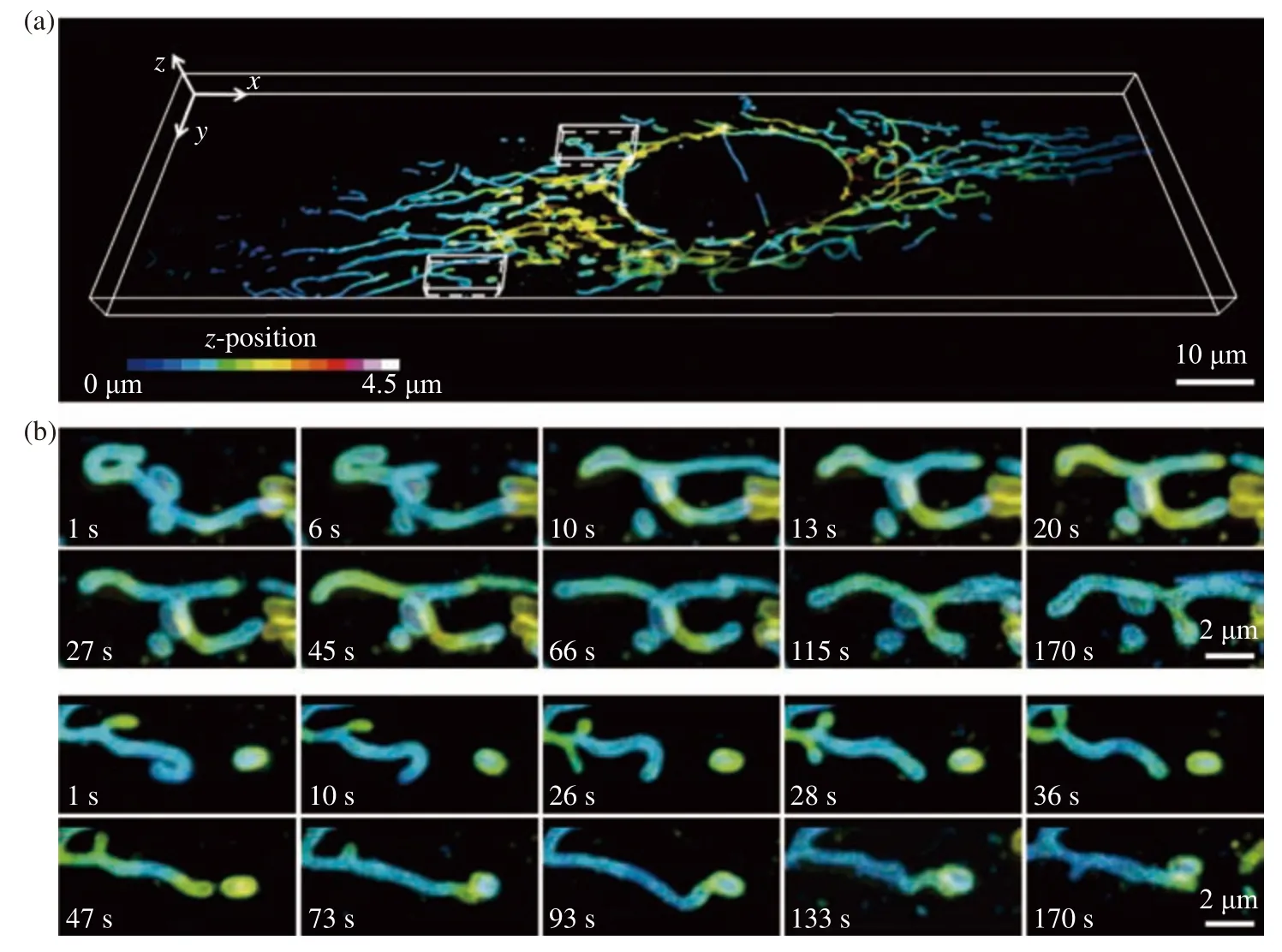
圖4 U2OS細胞中線粒體外膜的分布及其運動變化。(a)整個細胞中線粒體外膜的三維分布圖,比例尺:10 μm;(b)局部線粒體外膜的運動變化過程,比例尺:2 μmFig. 4 3D dynamics of mitochondrial outer membrane in U2OS cell. (a) Three-dimensional distribution of mitochondrial outer membrane in a whole live cell, scale bar: 10 μm; (b) the movement of local mitochondrial outer membrane, scale bar: 2 μm
4.3 線粒體外膜與Drp1相互作用的雙色成像
細胞能夠保持正常的生理功能得益于細胞器間的協同工作,功能各異的細胞器形成互作網絡,它們之間發生相互作用,可實現快速的物質交換和信息交流,為生命體的正常運轉提供保障;而一旦細胞器互作網絡紊亂,就會隨之引起多種疾病的發生。因此研究細胞器之間的互作方式,對于分析復雜生命活動的調控機制、理解細胞器互作在生理功能和疾病發生中的作用有著十分重要的幫助。
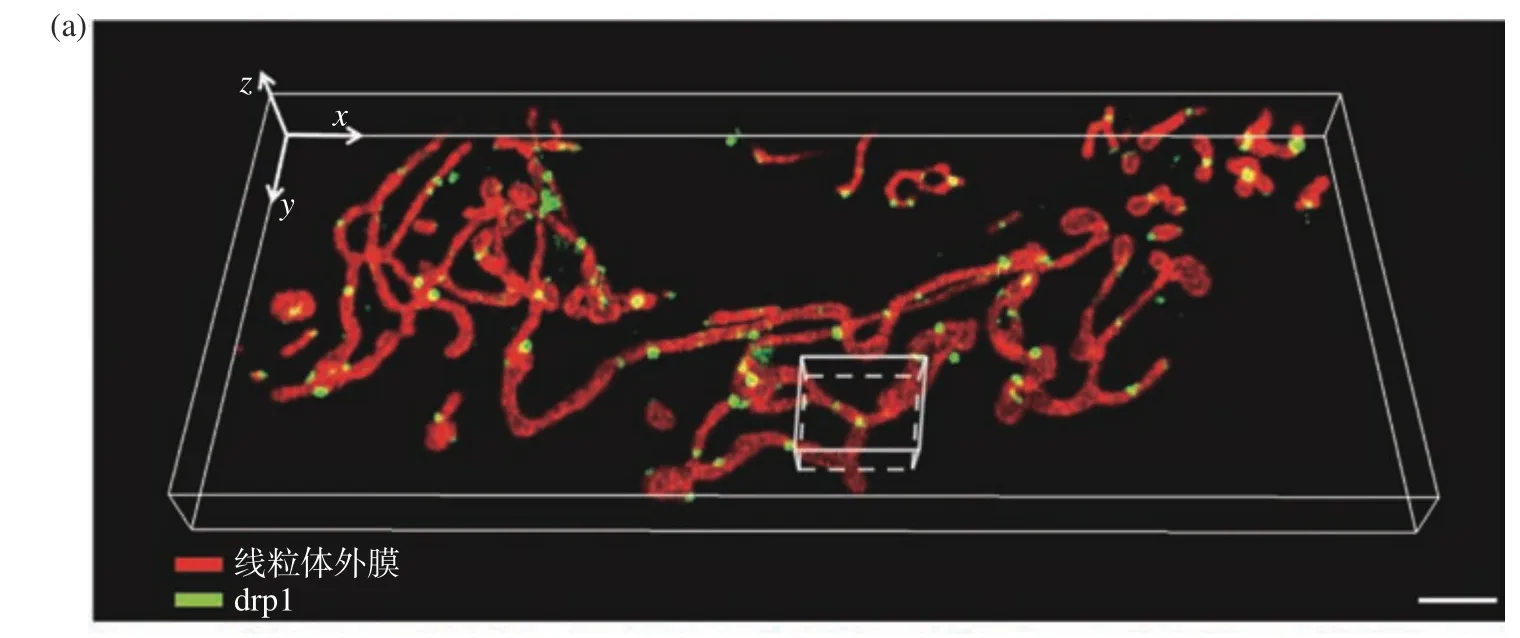
線粒體的分裂與一種動力相關蛋白1(Dynamin-related Protein 1, Drp1)有關,雖然Drp1光敏性強,但DR-LSFM的時空分辨率和低光毒性可以讓人們觀測到Drp1與線粒體相互作用的動態過程,見圖5(a)(彩圖見期刊電子版)。在具體實驗中分別用mCherry和EGFP標記U2OS細胞中的Drp1與線粒體外膜,采用1 vol/s的體成像速度進行了連續400 s的雙色同時成像,并成功觀測到Drp1調控分裂線粒體現象。雖然在連續400 s的時間跨度內由于光漂白的作用信號亮度存在一定程度的下降,但總體還是在一個良好的信噪比水平上完整觀測了此次動態互作過程,在觀測范圍內的其他區域也存在類似的調控分裂現象,僅選擇白色框區域做放大展示,圖5(b)(彩圖見期刊電子版)是此次相互作用的過程。本次實驗也證明了該光片系統具備優異的雙色同時成像能力。
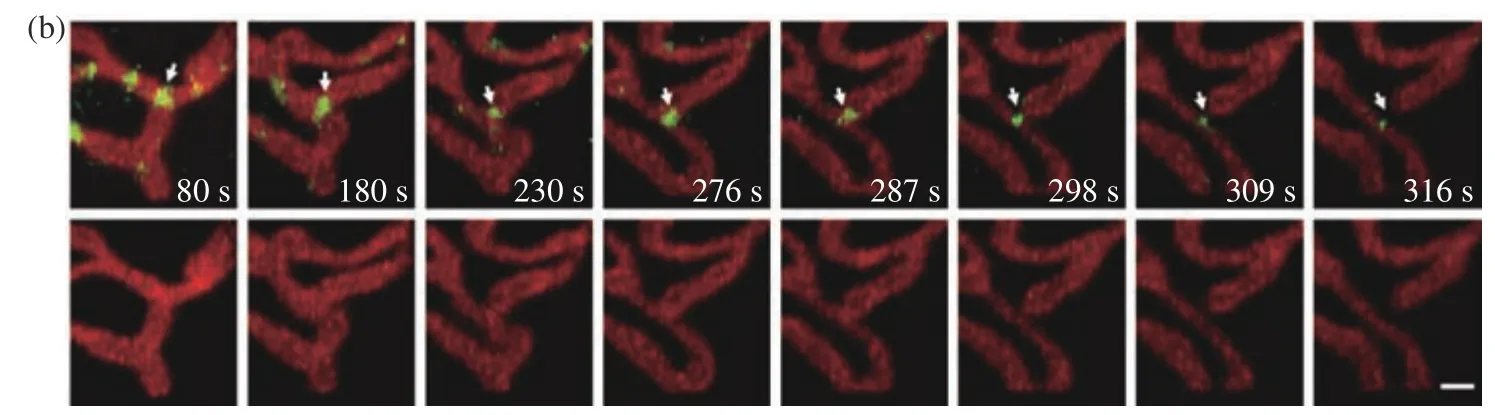
圖5 U2OS細胞中線粒體外膜與Drp1的分布與相互作用。(a)線粒體外膜與Drp1的三維分布圖,比例尺:3 μm;(b)感興趣區域內線粒體外膜與Drp1相互作用過程,比例尺:1 μmFig. 5 Interactions between mitochondrial outer membrane and Drp1 in U2OS cell. (a) Three-dimensional co-localization of mitochondrial outer membrane and Drp1, scale bar: 3 μm; (b) interactions between mitochondrial outer membrane and Drp1 in a region of interest, scale bar: 1 μm
4.4 膨脹細胞以及全器官尺度樣本的多尺度成像
超分辨顯微成像技術的出現為人們打開了探索衍射極限下微觀世界的大門[18-25]。與光學硬件系統上的創新突破不同,細胞膨脹技術是通過對樣本結構進行物理放大,將衍射受限下的微觀結構特征放大至常規光學顯微鏡所能觀察到的尺寸范圍,以此實現超分辨效果[26-27]。膨脹樣本的放大倍率一般在4~10倍之間,與活細胞相比,其需要在更大體積范圍內進行數據采集。而DR-LSFM不僅能以超高的空間分辨率(280 nm×280 nm×500 nm)完成活細胞尺度的高速、長時程多色成像,還可以利用軸向掃描的方式實現膨脹細胞這種更大尺度樣本的三維超分辨數據獲取。
在膨脹細胞的成像應用中選用光片厚度為500 nm的超薄光片以滿足較高的軸向分辨率,但在干涉可用范圍只有約12 μm的情況下樣本掃描深度受限,這嚴重限制了數據采集效率。為了在一次掃描中獲得更深層范圍內的樣本信息,使用物鏡掃描器將光片沿傳播光軸進行軸向掃描,配合相機的卷簾曝光模式,使得靶面上有效信息的覆蓋范圍達到1 024行像素。這樣可以充分利用相機的畫幅,擴大成像視野,在保證軸向分辨率的同時又提升了成像效率,可以獲取更多的信息。本文所用壓電陶瓷的行程范圍為100 μm,一次可以采集280 nm(x) ×280 nm(y) ×500 nm(z)的空間分辨率獲取約5×105μm3體積內的樣本信息,經過4倍的膨脹倍率折算后所達到的實際分辨率約為70 nm(x)×70 nm(y)×125 nm(z)。圖6(a)~6(e)(彩圖見期刊電子版)是由該系統采集的4倍膨脹核孔數據的三維可視化結果,從所選小區域的x-y面的最大強度投影可以明顯觀察到核孔的中空結構,而該結構一般需要100 nm左右的分辨率才可以解析[28]。這說明該光片系統結合細胞膨脹技術成功獲取了突破衍射極限的超分辨數據。
多種透明化方法的發展為實現大體積樣本深層組織熒光成像提供了強大的助力,其與光片成像技術結合能夠實現全器官尺度樣本的高通量數據采集[29-33]。而利用DR-LSFM自身可以產生多尺度光片的能力也可以完成透明化鼠腦這種全器官尺度樣本的高通量數據獲取。
對于全器官尺度的透明化鼠腦,選用厚度為3.5 μm的光片照明與10倍物鏡探測來滿足亞細胞空間分辨率水平,此時光片的干涉可用范圍可以覆蓋約相機畫幅的一半,獲取的單張圖像對應的真實視野約為1.2 mm×0.6 mm。掃描方式不再使用短行程的步進模式,而是換用長行程的勻速掃描模式,進行大體積樣本的數據獲取,設置合適的曝光時間來避免運動模糊。掃描方向的位移距離取決于樣本的長度(約為12 mm), 這樣每次掃描可以獲取約12 mm(x) × 0.6 mm(y) ×0.3 mm(z)體積內的樣本信息,再依次進行逐行、逐層掃描最終得到整個鼠腦的三維圖像數據。根據奈奎斯特采樣定律設置掃描方向的采樣步長為2 μm,在60 Hz的圖像采集幀率下可以用5小時的純數據采集時間完成整個鼠腦約480 mm3(12 mm×8 mm×5 mm)體積內的信號采集。使用ImageJ插件“Stitching”對獲取的圖像進行橫向與軸向拼接,對原始數據每個維度進行4倍降采樣后再進行拼接以降低計算機負荷。圖6(f)(彩圖見期刊電子版)是拼接后的整個鼠腦神經元信號的三維可視化結果,其中在皮層區域與丘腦區域分別選取兩個小塊進行放大展示,成像效果如圖6(g)~6(h)所示。
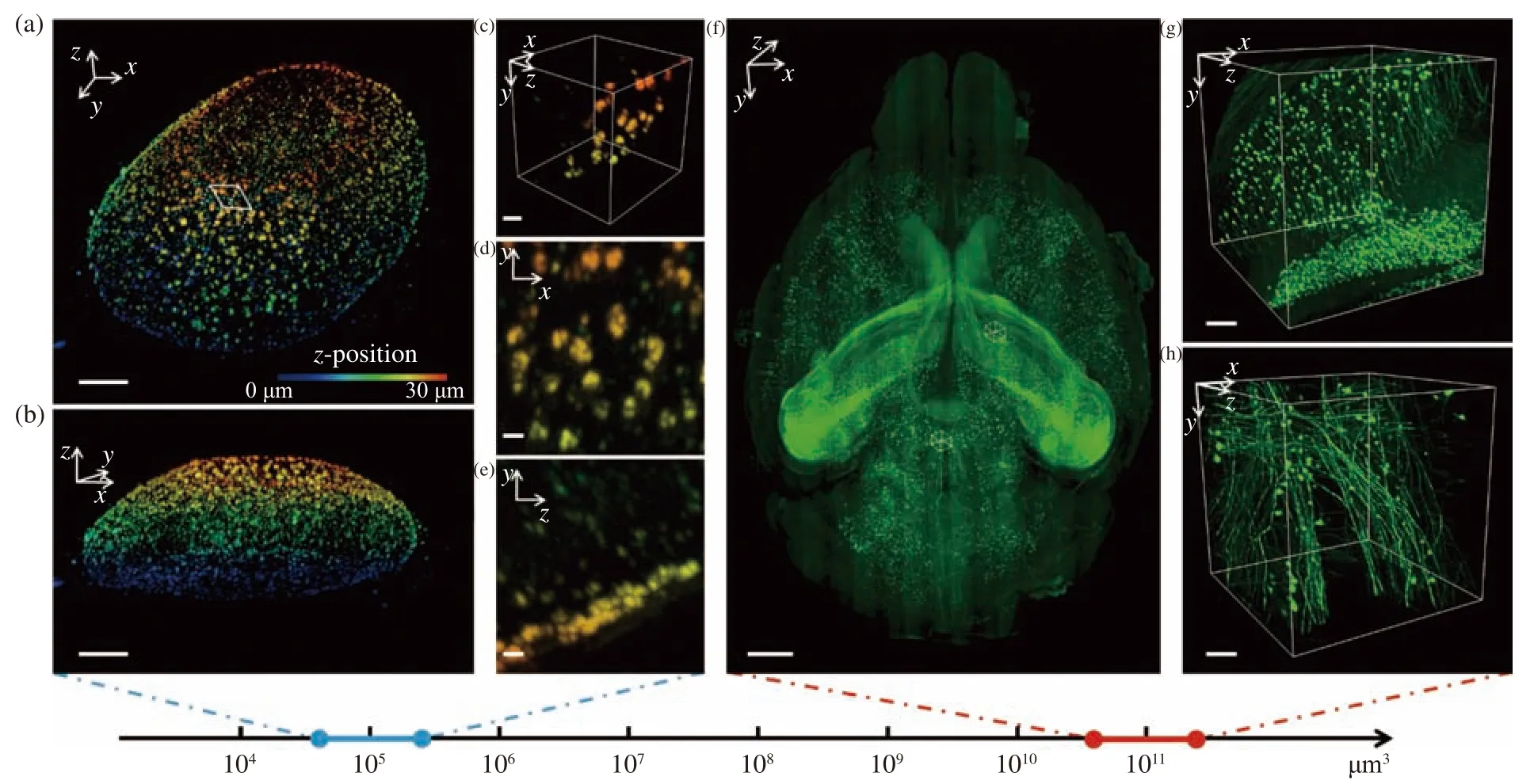
圖6 多尺度成像應用可視化結果。4倍膨脹核孔(a)可視化結果及其(b)軸向視角,比例尺:10 μm;(c)區域三維可視化,比例尺:2 μm;(d)區域x-y面和(e)區域y-z面最大強度投影,比例尺:1 μm;(f)鼠腦全腦可視化結果,比例尺:1 mm;(g)位于皮層和(h)位于丘腦的感興趣區域三維可視化結果,比例尺:100 μmFig. 6 3D visualization of multi-scale imaging results. (a) 3D visualization and (b) axial 3D view of an expanded nuclear hole(expansion factor: 4), scale bar: 10 μm; (c) 3D visualization of a selected small region, scale bar: 2 μm; max intensity projection of the (d) x-y plane and (e) y-z plane of the region, scale bar: 1 μm; (f) 3D visualization of a whole mouse brain, scale bar: 1 mm; 3D visualization of a region of interest in (g) cortex and (h) thalamus, scale bar: 100 μm
4.5 圖像處理及多尺度成像實現方法
雙環掩模產生的光片仍然存在一定的旁瓣,可以先對熒光微球進行三維成像獲得該系統的點擴散函數;之后對圖像進行反卷積操作來進一步消除旁瓣;接著,使用Fiji插件對三維圖像進行顏色編碼以展示其深度信息,最后導入商業Imaris軟件中進行可視化。
DR-LSFM的系統架構可以兼容多種生物樣本的成像應用,但為了滿足不同應用場景中的成像需求需要在不同類型的掩模與物鏡間切換,將不同應用所用的掩模參數與物鏡型號整理如表1所示。
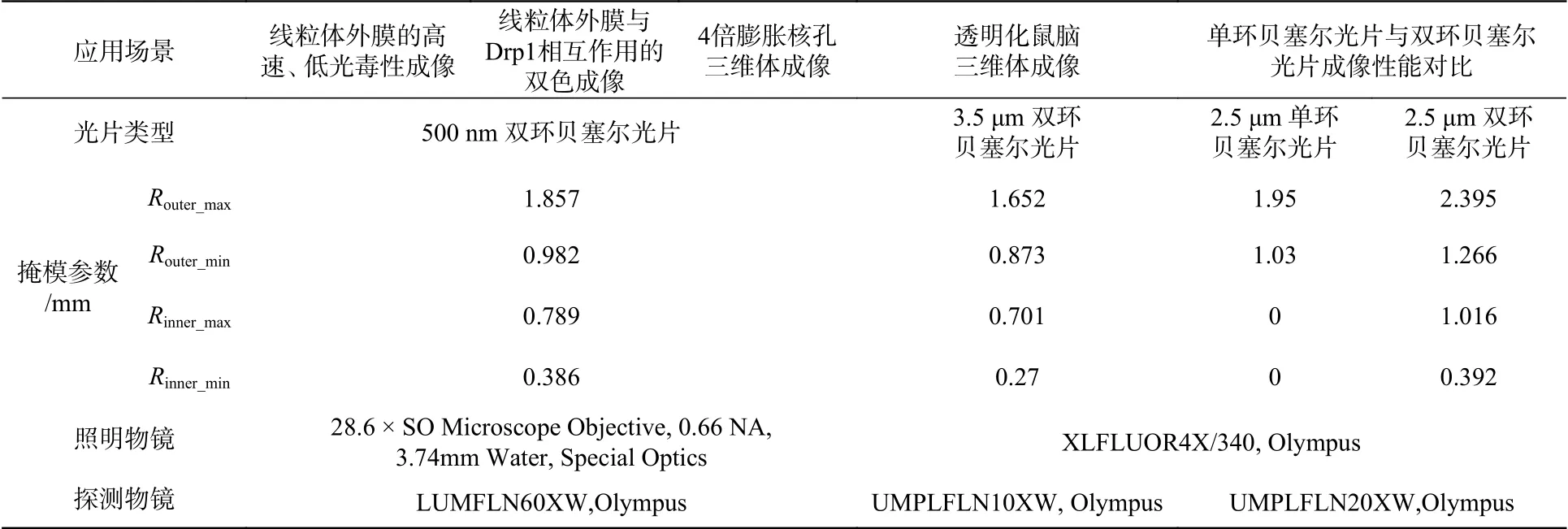
表1 不同應用場景下所用的掩模參數與物鏡型號Tab. 1 Mask parameters and objectives in different application scenarios
5 結 論
本文基于雙環調控產生低旁瓣靜態貝塞爾光片的方法,通過對光片系統進行合理的光路設計與硬件選型,構建了一種能夠兼容活細胞動態多色成像、膨脹細胞超分辨成像與全器官尺度樣本高通量成像的多尺度光片熒光顯微成像系統。利用該光片成像系統完成了對活細胞的高速、長時程動態雙色成像,結合生物細胞膨脹方法獲得了打破衍射極限的細胞器三維微細結構數據,完成了全器官尺度透明化樣本三維圖像數據的高通量采集。實驗結果證明DR-LSFM可以實現不同分辨率需求的多尺度成像應用。