三磷酸腺苷酶家族蛋白3A、缺氧誘導因子-1在結直腸癌中的表達及與患者臨床特征的關系△
米會敏,孫麗,蔡媛
寶雞市中心醫院病理科,陜西 寶雞 721000
結直腸癌是發生于結腸的消化道惡性腫瘤,好發于直腸和乙狀結腸交界處,以40~50歲發病率最高,其發病率居胃腸道腫瘤的第3位[1]。結直腸癌發病隱匿,臨床癥狀不典型,多數患者確診時已進展至中晚期,延誤了最佳的治療時機,導致治療效果受限,患者的預后較差,因此早發現、早診斷結直腸癌對降低患者的病死率有重要意義[2]。晚期結直腸癌患者的生存率僅為50%,主要是由于缺乏合理的評估體系,使臨床決策缺少決定性證據[3]。目前結直腸癌的病因和發病機制尚不清楚,近年來研究發現,結直腸癌與原癌基因活化、腫瘤抑制基因失活有關,提示結直腸癌的發生發展過程中存在復雜的分子事件[4]。相關研究顯示,三磷酸腺苷酶家族蛋白3A(ATPase family AAA domain containing 3A,ATAD3A)、缺氧誘導因子-1(hypoxia-inducible factor-1,HIF-1)均與腫瘤的發生發展及不良預后有關[5]。本研究探討ATAD3A、HIF-1在結直腸癌中的表達及與患者臨床特征的關系,現報道如下。
1 資料與方法
1.1 一般資料
選取2020年1月至2021年8月寶雞市中心醫院收治的結直腸癌患者。納入標準:①符合《結直腸癌肝轉移診斷和綜合治療指南(V2016)》[6]中關于結直腸癌的診斷標準,經病理檢查確診為結直腸癌;②均首次接受結直腸癌根治術治療;③溝通能力良好;④臨床資料完整。排除標準:①近1個月內有炎癥病史;②術前行新輔助化療導致病理組織改變;③存在活動性細菌或真菌感染;④存在精神疾病,無法配合治療;⑤肝腎功能異常及重要臟器嚴重疾病等。依據納入和排除標準,本研究共納入118例結直腸癌患者,其中男70例,女48例;年齡23~75歲,平均(48.22±5.12)歲;體重指數(body mass index,BMI)16~26 kg/m2,平均(20.01±1.22)kg/m2;結腸癌68例,直腸癌50例;腫瘤直徑2~8 cm,平均(5.51±0.35)cm;臨床分期:Ⅰ期 40例,Ⅱ期28例,Ⅲ期30例,Ⅳ期20例;浸潤深度:淺肌層88例,深肌層30例;有神經侵犯45例,無神經侵犯73例;有脈管受累60例,無脈管受累58例;有淋巴結轉移38例,無淋巴結轉移80例;分化程度:高分化50例,中低分化68例。另同期選取100例結直腸良性病變患者,其中男60例,女40例;年齡25~76歲,平均(48.30±5.02)歲;BMI為17~25 kg/m2,平均(20.12±1.29)kg/m2。兩組患者性別、年齡、BMI比較,差異均無統計學意義(P>0.05),具有可比性。本研究經醫院倫理委員會批準通過,所有患者均知情同意并簽署知情同意書。
1.2 免疫組化法檢測ATAD3A、HIF-1表達情況
取118例結直腸癌患者的結直腸癌組織和100例結直腸良性病變患者的良性病變組織,石蠟包埋切片,烤箱烘烤90 min,浸入二甲苯中,脫蠟10 min,逐級放入100%、90%、70%乙醇及純水中浸泡5 min,3%過氧化氫孵育10 min,沖洗3次,浸泡在0.01 mmol/L的乙二胺四乙酸(ethylenediaminetetraacetic acid,EDTA)抗原修復液中,高溫高壓修復3 min,靜置30 min,反復沖洗3次,滴加山羊血清封閉20 min,分別加入一抗ATAD3A抗體(稀釋濃度1∶150)、HIF-1抗體(稀釋濃度1∶50),4 ℃在冰箱孵育過夜,PBS沖洗3次,二抗孵育完成后沖洗3次,鹽酸乙醇分化,其余免疫組化步驟按試劑盒說明書進行,觀察顯色情況,滴加蘇木素復染1 min,沖洗、脫水,中性樹脂封片,由2名病理醫師在光學顯微鏡下觀察,雙盲法判定結果。依據染色強度和陽性細胞所占比例進行結果判定:無著色計0分,淡黃色染色計1分,棕黃色染色計2分,棕褐色染色計3分;無陽性細胞計0分,陽性細胞所占比例<25%計1分,陽性細胞所占比例25%~75%計2分,陽性細胞所占比例>75%計3分;將染色強度評分和陽性細胞所占比例評分相加,>2分判定為陽性,≤2分判定為陰性。
1.3 統計學方法
采用SPSS 22.0軟件對所有數據進行統計分析,計數資料以例數和率(%)表示,組間比較采用χ2檢驗;計量資料以均數±標準差(±s)表示,組間比較采用t檢驗;相關分析采用Pearson相關性分析;以P<0.05為差異有統計學意義。
2 結果
2.1 ATAD3A、HIF-1表達情況的比較
結直腸癌組織中ATAD3A、HIF-1陽性表達率均明顯高于良性病變組織,差異均有統計學意義(P<0.01)。(表1)

表1 結直腸癌組織和良性病變組織中ATAD3A、HIF-1陽性表達情況的比較[n(%)]
2.2 不同臨床特征結直腸癌患者結直腸癌組織中ATAD3A、HIF-1表達情況的比較
不同性別、BMI、臨床分期、浸潤深度、神經侵犯情況、脈管受累情況結直腸癌患者結直腸癌組織中ATAD3A、HIF-1陽性表達率比較,差異均無統計學意義(P>0.05);腫瘤直徑≥5 cm、有淋巴結轉移、分化程度為中低分化結直腸癌患者結直腸癌組織中ATAD3A、HIF-1的陽性表達率分別高于腫瘤直徑<5 cm、無淋巴結轉移、分化程度為高分化患者,差異均有統計學意義(P<0.05)。(表2)
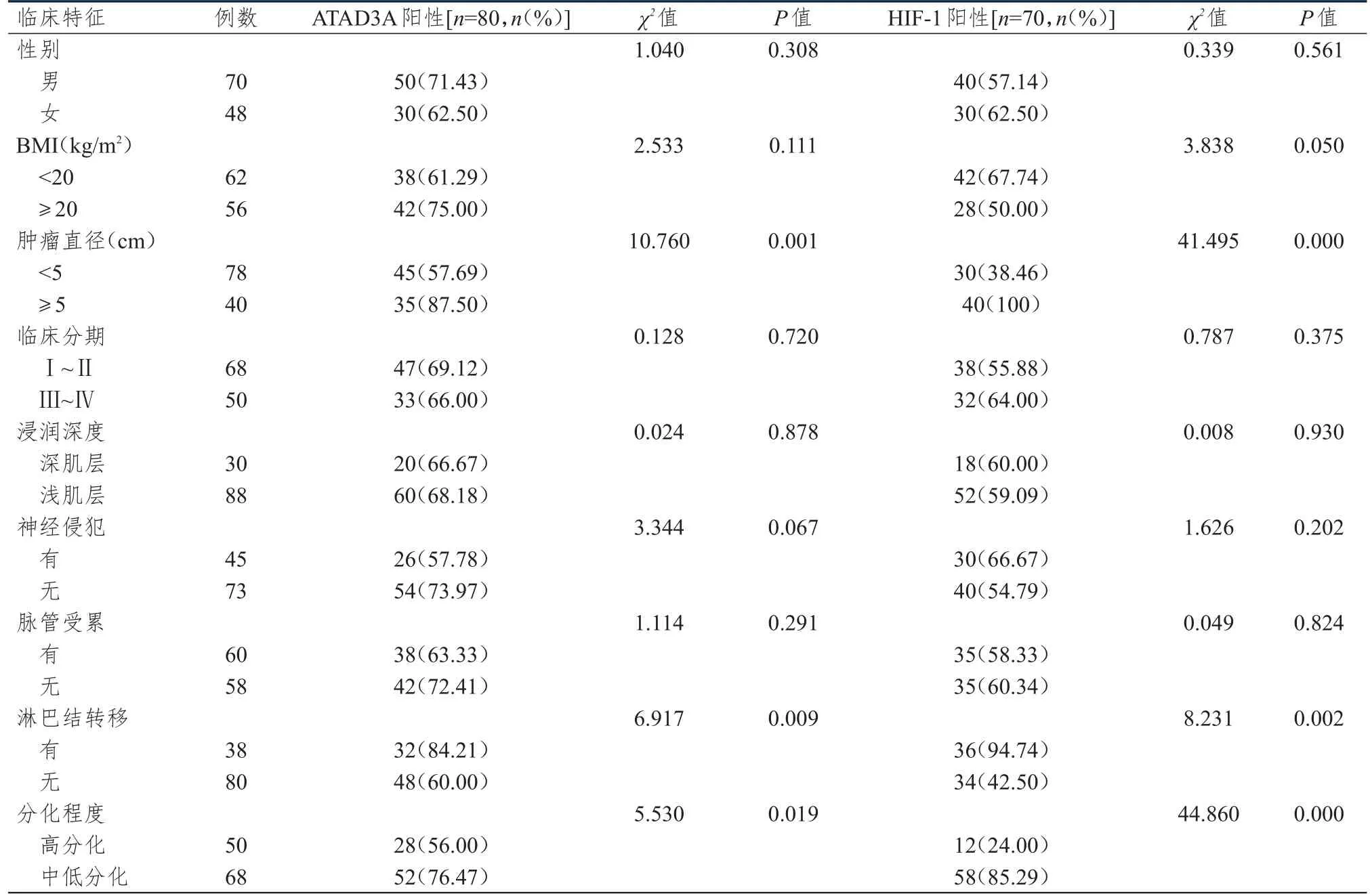
表2 不同臨床特征結直腸癌患者結直腸癌組織中ATAD3A、HIF-1表達情況的比較(n=118)
2.3 ATAD3A、HIF-1表達的相關性分析
Pearson相關性分析結果顯示,ATAD3A的表達與HIF-1的表達呈正相關(r=0.412,P<0.05)。
3 討論
結直腸癌的病因尚不明確,可能與高脂肪飲食、肥胖率增加、結腸腺瘤有一定關系,機體免疫力低下和局部慢性炎癥可能是腫瘤發生發展的重要原因[7]。隨著臨床對結直腸癌研究的不斷深入,有研究認為,結直腸癌發生發展過程中可能存在一系列抑癌基因突變、原癌基因活化等分子事件,且伴有惡性腫瘤生物學行為及組織形態學改變,最終導致結直腸癌[8]。目前,臨床結直腸癌的靶向藥物只有少數幾種生物制劑,但受個體差異影響,部分患者無法從中獲益,因此,有必要開展結直腸癌方面的研究,發現更多有意義的潛在治療靶點。
線粒體是人體細胞中能量來源的細胞器,主要通過氧化應激信號通路、生物學代謝重編程等參與惡性腫瘤細胞的生長和轉移過程[9]。ATAD3A可參與細胞內基因組轉錄、蛋白水解等多個生物過程。既往有研究證實,ATAD3A是維持線粒體正常功能的因子,其表達缺失會損害線粒體功能,進而抑制細胞生長[10]。缺氧是腫瘤微環境的基本特征,由于惡性腫瘤細胞生長速度較快,供血不足容易使瘤體處于低氧狀態[11]。越來越多的研究證實,腫瘤細胞生長速度增快導致的局部缺氧在腫瘤環境中較常見[12-13]。
本研究結果顯示,結直腸癌組織中ATAD3A、HIF-1陽性表達率均明顯高于良性病變組織,差異均有統計學意義(P<0.01);腫瘤直徑≥5 cm、有淋巴結轉移、分化程度為中低分化結直腸癌患者結直腸癌組織中ATAD3A、HIF-1的陽性表達率分別高于腫瘤直徑<5 cm、無淋巴結轉移、分化程度為高分化的患者,差異均有統計學意義(P<0.05);進一步Pearson相關分析顯示,ATAD3A的表達與HIF-1的表達呈正相關。表明ATAD3A、HIF-1均與結直腸癌的發生發展密切相關,提示ATAD3A、HIF-1的陽性表達與淋巴結轉移等生物學行為密切相關,與相關研究報道的結果一致[14-15]。
有研究證實,ATAD3A會破壞非小細胞肺癌線粒體的正常網狀形態,抑制腫瘤細胞的增殖生長[16]。結直腸癌細胞中也有相同現象,ATAD3A過表達后,結直腸癌細胞增殖能力顯著增強,抑制ATAD3A的表達細胞增殖能力顯著減弱。腫瘤的快速生長需要大量能量供應,ATAD3A在線粒體氧化磷酸化中發揮了重要作用,能夠明顯促使腫瘤細胞生長[17]。結直腸癌早期,細胞微環境處于非缺氧狀態,隨著腫瘤組織的不斷生長,腫瘤細胞中缺氧誘導因子基因活化增強。HIF-1蛋白可促使腫瘤細胞形成,并促進腫瘤細胞的淋巴結轉移,但其促進腫瘤發生發展的具體分子機制尚需繼續深入研究證實[18-19]。由此可見,ATAD3A、HIF-1可作為結直腸癌惡性程度的重要監測指標,可為尋找結直腸癌的有效治療靶點提供有力證據。隨著HIF-1對ATAD3A調控作用的深入研究,有望為結直腸癌的治療開辟新途徑。但本研究未進行大樣本研究,且研究的時間間隔較短,故需要后續進行多中心、大樣本及較長的時間跨度或多時間段的進一步深入研究。
綜上所述,ATAD3A、HIF-1在結直腸癌組織中高表達,腫瘤直徑≥5 cm、有淋巴結轉移、分化程度為中低分化結直腸癌患者結直腸癌組織中ATAD3A、HIF-1的陽性表達率較高,可作為結直腸癌患者潛在的治療靶點。

