半胱氨酸和甘氨酸豐富蛋白1對膀胱癌細胞增殖、細胞周期及β-catenin/c-Myc通路的影響
張鏡偉,馬勝利,謝程國
廣州市第一人民醫院南沙醫院泌尿外科,廣州 511458
膀胱癌的發病率、病死率均較高,是最常見的泌尿系統惡性腫瘤之一[1-2]。研究顯示,早期診斷、個體化治療和隨訪可以明顯延長患者的生存期[3]。盡管臨床上在診斷和治療方法中做了很大的努力,但膀胱癌患者的復發率依舊很高,晚期患者的臨床預后也很差[4]。因此,尋找膀胱癌患者早期診斷和臨床治療的特異性分子標志物具有重要意義。半胱氨酸和甘氨酸豐富蛋白1(cysteine and glycine rich protein 1,CSRP1)屬于LIM結構域超家族,LIM結構域可以在許多不同的蛋白質中找到,其在細胞結構、細胞黏附、細胞運動以及信號轉導中發揮重要作用[5-6]。CSRP1主要表達于細胞質,具有促進細胞增殖的功能;同時,該蛋白還是非常重要的腫瘤分子標志物[7-9]。現已證實,CSRP1在多種腫瘤中均出現了表達失衡,例如結直腸癌、前列腺癌等[10-14]。隨著研究的深入,CSRP1有可能成為新型分子標志物,對腫瘤的發生、發展有較大的提示意義。但是,目前CSRP1在膀胱癌中的研究尚未見文獻報道,故本研究探討CSRP1對膀胱癌細胞增殖、細胞周期及β-catenin/c-Myc通路的影響,現報道如下。
1 資料與方法
1.1 一般資料
選取2014年1月至2017年1月在廣州市第一人民醫院南沙醫院就診的膀胱癌患者。納入標準:①經病理學檢查確診為膀胱癌;②術前未行放化療等抗腫瘤治療;③臨床資料完整。排除標準:合并其他惡性腫瘤。根據納入、排除標準,共納入30例膀胱癌患者,收集30例患者的膀胱癌組織以及相應的癌旁組織。本研究經醫院倫理委員會批準通過,所有患者均知情同意并簽署知情同意書。
1.2 主要材料與試劑
RPMI1640培養基、DMEM培養基及胎牛血清均購自美國Gibco公司,熒光定量聚合酶鏈反應(polymerase chain reaction,PCR)反轉錄和擴增試劑盒均購自Takara公司,MTS細胞增殖定量檢測試劑盒購自美國Promega公司,電化學發光(electrochemiluminescence,ECL)熒光底物試劑盒購自美國Pierce公司,Lipofectamine LTX購自Invitrogen公司。c-Myc、CSRP1、β-catenin、GAPDH抗體均購自美國Abcam公司。倒置熒光顯微鏡購自OLYMPUS公司,電熱恒溫水槽購自上海精宏實驗設備有限公司,生物安全柜(超凈工作臺)、細胞培養箱均購自Thermo Scientific公司,全自動細胞計數分析儀購自Nexcelom Bioscience公司,立式全自動滅菌器購自Cirrus公司,普通PCR儀購自BioRAD公司,熒光定量PCR儀購自杭州博日科技有限公司。
1.3 研究方法
1.3.1 細胞培養 人正常尿路上皮細胞系SVHUC和膀胱癌細胞系5637、T24均購自中科院上海細胞所。人正常尿路上皮細胞系SVHUC在無角質細胞血清培養基(keratinocyte serum free medium,K-SFM)+1%青霉素和鏈霉素中培養;5637細胞和T24細胞在RPMI1640完全培養基(10%胎牛血清+1%雙抗)中培養。所有細胞在37℃標準細胞培養條件下(5%CO2,95%濕度)生長。
1.3.2 免疫組化 對臨床膀胱癌樣本石蠟包埋的組織切片進行免疫組化分析,按照免疫組化步驟檢測膀胱癌組織及癌旁組織中CSRP1的表達情況,結果用免疫活性評分(immunoreactivity score,IRS)表示,即陽性細胞百分比評分乘以染色強度評分。陽性細胞百分比評分方法:陽性細胞百分比0~5%為0分,6%~25%為1分,26%~50%為2分,51%~75%為3分,>75%為4分;染色強度評分方法:未染色為0分,淡黃色為1分,深黃色或者棕黃色為2分,棕褐色為3分。根據IRS評分可將CSRP1表達分成4個等級:陰性(0~3分),弱陽性(4~6分),陽性(7~9分),強陽性(10~12分)。
1.3.3 實時熒光定量PCR 取對數生長期細胞,采用Trizol/氯仿/異丙醇法提取細胞總RNA,通過核酸蛋白定量儀測定所提取RNA的濃度及純度;然后參照Takara公司的PrimeScriptRTReagent Kit試劑盒說明書,將總RNA(1 μg)逆轉錄成cDNA;參照Takara公司的PrimeScript?RT Master Mix試劑盒說明書,以cDNA為模版進行PCR擴增。42℃預變性,60 min;70 ℃,15 min。PCR 反 應條件:94 ℃,45 s;55 ℃,50 s;72 ℃,75 s;共40個循環。所需引物序列詳見表1。采用公式2-ΔΔCt對數據進行處理分析,得到各個基因的相對表達量。

表1 引物序列
1.3.4 蛋白質印跡(Western blot)法 收集對數生長期的SVHUC、5637及T24細胞,用預冷磷酸鹽緩沖液(phosphate buffered solution,PBS)洗滌細胞3次,然后加入1×Cell Lysis Buffer裂解細胞,經超聲、離心后去掉其他細胞成分,使用微量核酸蛋白定量儀測定各蛋白樣品的濃度及純度;加入5×十二烷基硫酸鈉(sodium dodecylsulfate,SDS)加樣緩沖液在沸水中煮沸10 min以使蛋白充分變性;配置10%的SDS聚丙烯酰胺凝膠進行電泳分離,然后轉膜,封閉,并在4℃與一抗孵育過夜;二抗室溫孵育2 h,采用化學發光法檢測CSRP1蛋白表達情況,并進行灰度值分析。
1.3.5 細胞轉染CSRP1-siRNA序列為5'-CTGTTGTGGGAATGAAGAGAGTTTG-3',陰性對照序列為 5'-GCUUCGCGCCGUAGUCUATT-3',由上海吉瑪公司合成。取對數生長期的T24細胞,接種于6孔板中。利用轉染試劑LipofectamineTM2000,將scramble-siRNA(10 μg)和CSRP1-siRNA(10 μg)分別轉染至T24細胞中。轉染6~8 h后將無抗生素的RPMI1640培養基換成加入抗生素的RPMI1640培養基,繼續培養48 h(用于檢測mRNA的表達)或72 h(用于檢測相關蛋白的表達)。
1.3.6 MTS細胞增殖實驗 通過細胞轉染,將T24細胞分成3組:空白對照組、scramble-siRNA組(si-NC組)和實驗組(si-CSRP1組)。然后將100 μl完全培養基中的2000個3組細胞接種到96孔板中,在37℃、5%CO2條件下培養1~5天,然后每個時間點在培養基中加入10 μl MTS,37℃孵育4 h后,490 nm波長下測定每孔光密度(optical density,OD),根據結果繪制細胞生長表。
1.3.7 流式細胞術檢測細胞周期 利用流式細胞儀檢測細胞周期,取對數生長期的si-NC組和si-CSRP1組T24細胞,用D-Hanks清洗3遍后加入不含胎牛血清的培養基靜置過夜,然后用預冷PBS清洗3次,使用預冷75%乙醇固定細胞,放置于4℃冰箱內過夜;上機前離心去除乙醇,PBS洗滌3次后,加入100 μl RNase A溶液37℃水浴中放置30 min;然后加 400 μl的碘化丙啶(propidium iodide,PI)4℃避光染色1 h;流式細胞儀根據測定的DNA含量確定細胞周期分布。
1.4 統計學分析
采用SPSS 18.0軟件對數據進行統計分析,計量資料以均數±標準差(±s)表示,多組間比較采用方差分析,兩組間比較采用兩獨立樣本t檢驗,組內比較采用配對t檢驗,以P<0.05為差異有統計學意義。
2 結果
2.1 CSRP1在膀胱癌組織中的表達水平及臨床意義
采用免疫組化檢測膀胱組織標本中CSRP1的表達水平,CSRP1在腫瘤組織中的表達水平為(8.20±2.58),明顯高于癌旁組織中的(3.93±1.98),差異有統計學意義(t=16.837,P<0.01)(圖1)。按照IRS評分將膀胱癌患者分成CSRP1高表達組(IRS評分≥8分)和CSRP1低表達組(IRS評分<8分),生存曲線分析顯示CSRP1高表達組患者的總生存率低于CSRP1低表達組患者(χ2=5.532,P=0.019)(圖2)。不同腫瘤大小、腫瘤分級膀胱癌患者的CSRP1表達情況比較,差異均有統計學意義(P<0.05);不同年齡、性別膀胱癌患者的CSRP1表達情況比較,差異均無統計學意義(P>0.05)(表 1)。

表1 不同臨床特征膀胱癌患者CSRP1表達情況的比較

圖1 免疫組化檢測膀胱癌組織及癌旁組織中CSRP1蛋白表達情況(免疫組化染色,×400)

圖2 CSRP1高表達組(n=19)與CSRP1低表達組(n=11)膀胱癌患者的生存曲線
2.2 CSRP1在膀胱癌細胞中的表達水平
在細胞水平,分別采用實時熒光定量PCR和Western blot法檢測細胞中CSRP1mRNA和蛋白水平。結果顯示,CSRP1在人正常尿路上皮細胞SVHUC和膀胱癌細胞T24、5637中的mRNA表達水平分別為(1.025±0.014)、(6.537±0.009)、(8.487±0.043),差異有統計學意義(F=20 762.951,P<0.01),提示膀胱癌細胞中CSRP1mRNA水平高于人正常尿路上皮細胞;膀胱癌細胞T24、5637中CSRP1蛋白表達水平均高于人正常尿路上皮細胞SVHUC(圖3)。
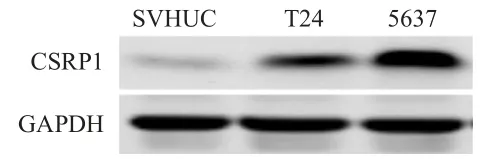
圖3 Western blot法檢測膀胱癌細胞T24、5637和人正常尿路上皮細胞SVHUC中CSRP1蛋白表達情況
2.3 沉默CSRP1表達對膀胱癌細胞增殖和細胞周期的影響
轉染CSRP1siRNA序列至T24細胞中沉默CSRP1表達,CSRP1蛋白表達降低(圖4A)。相比si-NC組細胞,si-CSRP1組細胞G1期細胞百分比從57.60%提高到71.59%,而S期細胞百分比則由30.15%降低到19.22%(圖4B)。與空白對照組和si-NC組相比,不同時間點si-CSRP1組細胞OD值均降低,差異均有統計學意義(P<0.05)(表2)。
表2 不同時間點3組CSRP1細胞OD值的比較(±s)

表2 不同時間點3組CSRP1細胞OD值的比較(±s)
注:*與si-CSRP1組比較,P<0.05
空白對照組si-NC組si-CSRP1組F值P值0.362±0.002*0.334±0.001*0.308±0.012 55.207 0.000 0.513±0.003*0.525±0.003*0.363±0.003 2687.939 0.000 0.652±0.025*0.668±0.010*0.460±0.017 119.39 0.000 0.912±0.016*0.971±0.018*0.626±0.021 296.729 0.000組別24 h 48 h 72 h 96 h
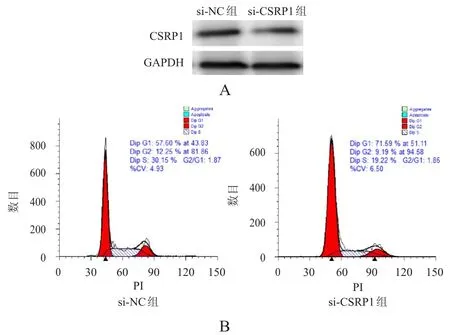
圖4 沉默CSRP1表達對CSRP1蛋白表達和細胞周期的影響
2.4 沉默CSRP1表達對β-catenin/c-Myc信號通路的影響
si-CSRP1組細胞中β-catenin、c-MycmRNA和蛋白表達水平均明顯低于si-NC組細胞,差異均有統計學意義(P<0.01)。(表3、圖5)

圖5 Western blot法檢測si-NC組和si-CSRP1組細胞中β-catenin、c-Myc蛋白表達情況
表3 si-NC組和si-CSRP1組細胞中β-catenin、c-Myc mRNA表達水平的比較(±s)
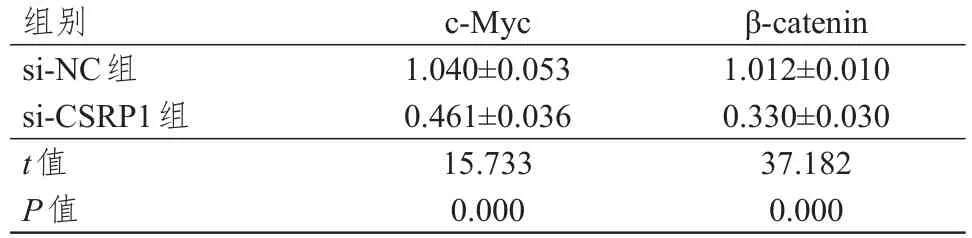
表3 si-NC組和si-CSRP1組細胞中β-catenin、c-Myc mRNA表達水平的比較(±s)
組別si-NC組si-CSRP1組t值P值c-Myc 1.040±0.053 0.461±0.036 15.733 0.000 β-catenin 1.012±0.010 0.330±0.030 37.182 0.000
3 討論
本研究探討了CSRP1在膀胱癌組織中的表達情況及臨床意義,發現CSRP1在膀胱癌組織中的表達高于癌旁組織,且CSRP1高表達與膀胱癌患者預后不良有關。與正常尿路上皮細胞相比,膀胱癌細胞中CSRP1表達上調。為了確定CSRP1在膀胱癌中的作用,本研究轉染靶向CSRP1基因的siRNA沉默其表達,發現沉默CSRP1后抑制了膀胱癌細胞的增殖能力,誘導細胞出現G1/S期阻滯。這些結果提示CSRP1與膀胱癌的發生發展有關,可能是防治膀胱癌的新靶點。
機制研究顯示,沉默CSRP1可以明顯抑制β-catenin/c-Myc信號通路。據報道,WNT/β-catenin信號通路在膀胱癌細胞的自我更新和增殖中發揮重要作用[15]。β-catenin蛋白N-末端的缺失可以避免其被糖原合酶激酶-3β(glycogen synthase kinase-3β)結合和降解,將N-末端缺失的β-catenin蛋白導入膀胱癌細胞中可以促進其增殖和克隆形成[16]。本研究中應用siRNA沉默T24中CSRP1基因后,β-catenin蛋白表達水平下降,說明CSRP1可能通過β-catenin促進膀胱癌細胞增殖。同時檢測了β-catenin下游蛋白c-Myc的表達水平,與β-catenin結果一致,沉默CSRP1基因后,c-Myc蛋白表達水平也出現了下降。原癌基因c-Myc在許多腫瘤中過表達,包括膀胱癌。c-Myc在膀胱癌細胞增殖和分化中發揮重要作用,被報道參與調控膀胱癌細胞的增殖[17]。c-Myc還可以調節其下游細胞周期相關蛋白cyclin D1(調節G1/S檢測點最關鍵的蛋白)和cyclin E2(G1末期細胞從G1期向S期轉換過程中的限速調節因子)的表達,從而促進與S期相關的靶分子的表達、DNA復制的完成,促進細胞從G1期至S期進展[18-20]。本研究發現,CSRP1沉默可以下調c-Myc表達水平,誘導膀胱癌細胞周期G1/S期阻滯,抑制膀胱癌細胞的生長,說明CSRP1可能通過β-catenin/c-Myc通路介導細胞周期蛋白上調來促進膀胱癌細胞的增殖。
綜上所述,CSRP1在膀胱癌組織及細胞中呈高表達,沉默CSRP1可能通過抑制β-catenin/c-Myc通路下調c-Myc的表達,從而誘導細胞周期G1/S期阻滯并抑制膀胱癌細胞增殖。因此,CSRP1可能在膀胱癌發生、發展過程中發揮重要作用。但是,本研究中后期僅采用了一個膀胱癌細胞系,也缺乏體內動物實驗,CSRP1影響細胞周期蛋白的潛在機制也有待進一步深入研究。

