2021年國際癌癥報告聯盟甲狀腺癌規范化報告數據集解讀
劉志艷,王馨培
腫瘤的傳統治療方法包括手術、放療和化療。新興的個體化診療是通過對腫瘤患者攜帶的個體信息進行檢測,制定針對腫瘤患者的預防和治療策略,使腫瘤患者獲得最佳的治療效果。腫瘤的個體化診療模式已成為惡性腫瘤等重大疾病臨床治療的發展方向。甲狀腺癌的治療在近20年取得了重大進展。隨著時代的發展,傳統的甲狀腺癌治療方法,如甲狀腺全切除或次全切除術以及術后放射性碘(radioactive iodine,RAI)治療等,已越來越難以滿足患者的治療需求[1-2]。以臨床和細胞病理學及組織病理學參數為依據對甲狀腺癌患者進行預后分層的個體化診療模式,更有助于為患者選擇個體化的治療方案。降低患者的復發和死亡風險[3-5]。
國際癌癥報告聯盟(International Collaboration on Cancer Reporting,ICCR)是一家成立于2010年的非營利性組織,致力于推進基于循證研究的國際公認標準化病理報告[3,6-7]。ICCR甲狀腺規范化報告旨在收錄病理報告的所有元素,界定甲狀腺報告的核心元素和非核心元素,輔助臨床醫師進行危險分層,以采用最佳的個體化治療[3,6-7]。甲狀腺癌手術標本風險分層的關鍵元素包括:是否存在血管侵犯(blood vessel invasion,BVI)、甲狀腺外侵犯(extrathyroidal extension,ETE)和區域性淋巴結轉移及其程度。
1 ICCR甲狀腺規范化報告的適用范圍
ICCR甲狀腺規范化報告適用于原發性甲狀腺癌的切除標本,不適用于具有乳頭狀核特征的非浸潤性甲狀腺濾泡性腫瘤(noninvasive follicular thyroid neoplasm with papillary-like nuclear features,NIFTP)、惡性潛能未定的腫瘤、卵巢甲狀腺癌、甲狀舌管囊腫、肉瘤、淋巴瘤和甲狀腺轉移癌。
2 ICCR甲狀腺規范化報告的核心元素與非核心元素
ICCR甲狀腺規范化報告包括19個核心元素和8個非核心元素(表1)。核心元素的定義是對腫瘤的臨床治療、分期或預后至關重要的元素,不僅需要Ⅲ-2級或更高的證據支持,還需要被認為對所描述的疾病至關重要,并且在病理報告中必不可少。非核心元素可能不適用于規范化報告的所有使用者,并且(或)可能無法滿足上述標準。

表1 國際癌癥報告聯盟(International Collaboration on Cancer Reporting,ICCR)甲狀腺規范化報告的核心元素與非核心元素
2.1 手術方式、手術結果和送檢標本
外科醫師在手術報告單中記錄所行術式、術中是否可見ETE以及腫瘤是否完整切除[6,8]。病理科醫師應在病理報告中指出是否缺少術中ETE或者腫瘤切緣有否腫瘤的數據。
2.2 腫瘤部位、病灶和腫瘤大小
腫瘤是單灶還是多灶是核心問題,如為多灶時,應注明數量。如果有5個以上的腫瘤灶,則僅需簡單說明而無需統計腫瘤的確切數目。整個規范化報告只應用于優勢腫瘤。優勢腫瘤是臨床相關性最大的腫瘤,即侵襲性強和(或)T分期較高的腫瘤。優勢腫瘤多是(但不總是)其中最大的腫瘤。例如,一個較小的侵犯鄰近肌肉組織的甲狀腺乳頭狀癌(papillary thyroid carcinoma,PTC)與一個孤立的較大的無預后不良組織學特征的PTC相比,應將具有ETE的腫瘤定義為優勢腫瘤。如果在同一標本中出現不同種類的腫瘤,規范化報告應完整收錄所有種類的腫瘤。例如,腺葉切除術后標本中同時包含髓樣癌和PTC,則應為每一類腫瘤建立一個規范化報告;但是,如果2個孤立的PTC分屬不同的亞型,則僅注釋優勢腫瘤。對無關治療方案的非優勢腫瘤,病理科醫師可自行決定是否報告其基本的病理學特征。
需要基于影像學,宏觀和微觀地綜合分析優勢腫瘤的大小。腫瘤的最大尺寸是核心元素,可以影響預后,并且是TNM分期的組成部分[9]。
2.3 組織學類型
參考2017年世界衛生組織(World Health Organization,WHO)甲狀腺腫瘤分類標準。
2.3.1 PTC
PTC最常見,并且存在許多亞型,目前只報告部分具有臨床意義的亞型。
2.3.1.1 經典型、高細胞型和微小乳頭狀癌
經典型是PTC的普通亞型。高細胞型比經典型PTC更具侵略性,具有較高的BRAF突變率,并且RAI治療的療效較差(圖1A)。微小乳頭狀癌的體積小(直徑≤1 cm),并且為惰性,常于偶然中發現,預后極好。有研究表明93%的微小乳頭狀癌患者無病生存,亦無遠處轉移。
2.3.1.2 濾泡型及其相關病變
濾泡型PTC(follicular variant PTC,FVPTC)可以細分為2個亞型:完全包裹或邊界清楚的包裹型,以及完全或部分缺乏包膜的浸潤型[10]。FVPTC與經典型PTC的生物學行為相似。包裹型FVPTC的生物學行為更為惰性[11]。非浸潤性包裹型FVPTC現被重新命名為NIFTP[12],2017年WHO將其歸類為甲狀腺交界性腫瘤,具有極低度惡性潛能,臨床處理以單純手術切除為主[13-15]。然而,由于NIFTP細胞核特征判讀一致性存在差異[16-18],因此2018年NIKIFOROV等[19]進一步指出,診斷NIFTP需除外BRAFV600E突變或其他高風險突變(TERT啟動子、TP53)[19]。NIFTP診斷在亞洲的影響可能不大,因為亞洲的NIFTP僅占所有PTC的1.6%,而其他地區可達13.3%。中國大陸2家醫院的研究結果顯示,NIFTP的比例僅為0.3%,因此這一概念對中國FVPTC診斷的總體影響不大[20]。
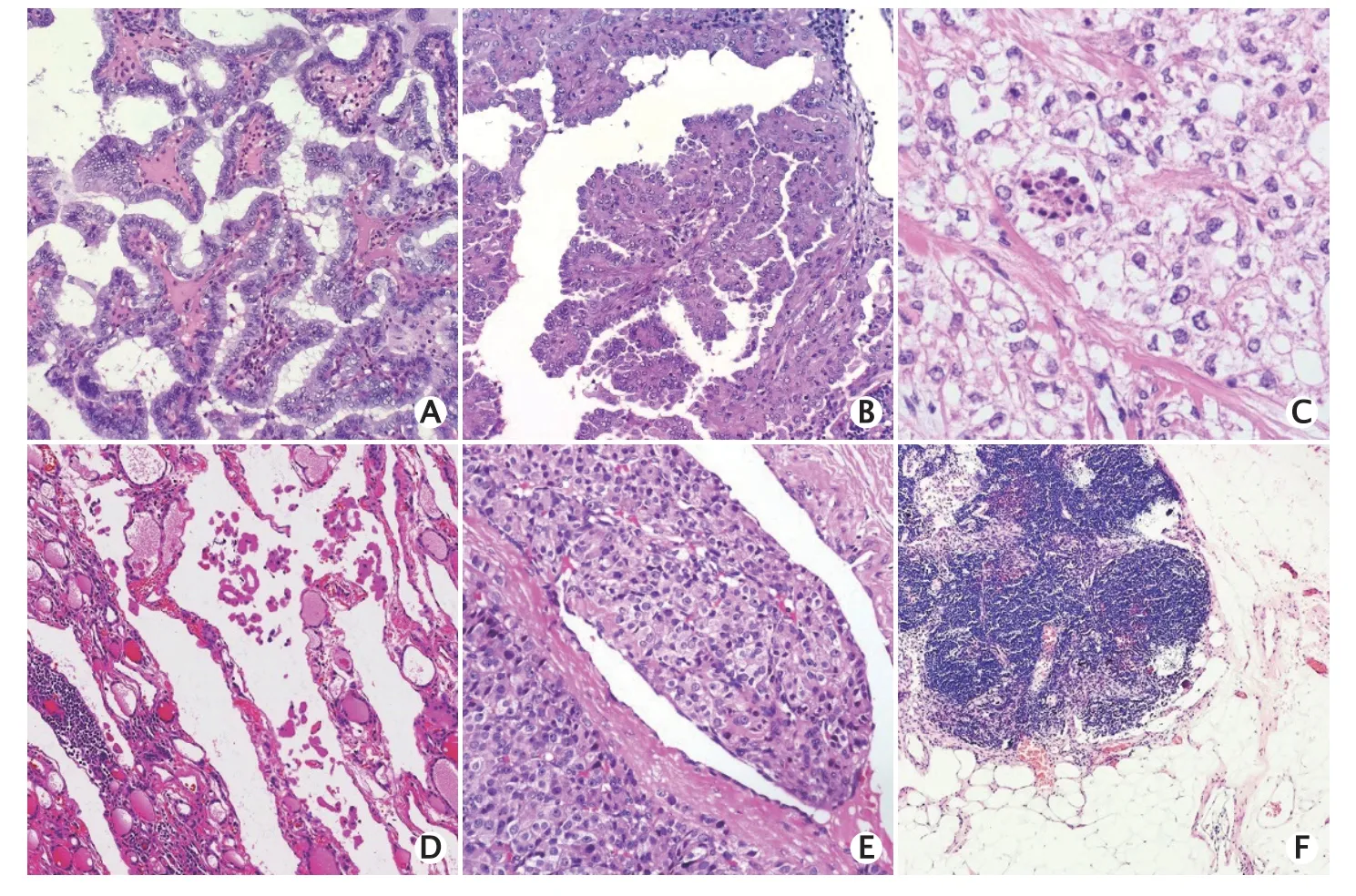
Fig.1 Pathological characteristics of different thyroid cancers.A: Papillary thyroid cancer,tall cell variant (hematoxylin eosin staining,×100);B: Papillary thyroid cancer,hobnail variant (hematoxylin eosin staining,×100);C: Papillary thyroid cancer,solid and clear cell variant,focus of necrosis could be observed(hematoxylin eosin staining,×200);D: Lymph vessel involvement of Hürthle cell cancer (hematoxylin eosin staining,×100);E: Encapsulated angioinvasive (oncocytic) cell cancer with blood vessel invasion(hematoxylin eosin staining,×100);F: The presence of psammoma bodies alone (without associated viable tumor cells) in a node is micrometastases (hematoxylin eosin staining,×100).圖1 不同甲狀腺癌的病理特征
2.3.1.3 篩狀桑葚型、彌漫硬化型和鞋釘型
篩狀桑葚型具有特異性的生物學特征,多伴有APC或β-catenin突變,并且與家族性腺瘤性息肉病相關,在某些情況下比結腸息肉或其他結腸外表現出現得更早,因此識別該亞型對于提示結直腸癌具有重要意義[21]。
彌散硬化型具有較高的侵襲性以及淋巴結轉移率和局部復發率,該型發生腺外侵犯、頸部淋巴結轉移和遠處轉移的概率高。對于彌散硬化型,需要開展更為積極的外科治療,包括更廣泛的淋巴結清掃[22];但是,其致死率與經典型PTC相似,10年疾病相關生存率高達93%。
鞋釘型較為罕見(僅占所有PTC的不足2%)(圖1B),為侵襲型,其特征是在腫瘤中至少出現30%的鞋釘樣細胞,易見壞死、核分裂象、血管淋巴管浸潤和ETE,常見復發以及淋巴結或遠處器官的轉移。RAI攝取較少,病死率較高。
其他可能具有預后和治療價值的亞型很少見,并且未經充分驗證,包括嗜酸細胞型和實性型。
2.3.2 濾泡性甲狀腺癌(follicular thyroid carcinoma,FTC)和Hürthle(嗜酸)細胞癌(Hürthle cell cancer,HCC)
FTC與濾泡腺瘤的主要區別在于是否具有包膜和(或)血管浸潤。2017年WHO分類根據包膜和(或)血管浸潤分成3型。(1)微小浸潤型:僅包膜浸潤;(2)包裹性血管浸潤型:所有具有血管浸潤者;(3)彌漫浸潤型:甲狀腺和(或)甲狀腺外組織的廣泛浸潤,伴有明顯的血管浸潤。僅有包膜浸潤而無血管浸潤的FTC患者的預后較好。即便僅有1~2條BVI的FTC,亦可發生遠處轉移;血管受累越多,預后越差。最常見的遠處轉移部位為骨、肺、腦和肝臟。TERT啟動子突變是腫瘤復發和死亡的獨立危險因素。大多數的FTC為分化型甲狀腺癌,RAI治療效果好,生存期較長。
根據最新的WHO分類標準,HCC定義為嗜酸細胞占75%以上、缺乏PTC核特征且存在包膜和(或)血管浸潤的腫瘤。HCC的生物學行為更具侵略性、具有不同的分子特征以及更低的RAI攝取率。HCC的治療方案較PTC和FTC的局限。微小浸潤性HCC患者的總生存率約為85%,彌漫浸潤型約為10%,伴有低分化組織學特征的患者的預后更差。
2.3.3 低分化甲狀腺癌(poor differentiated thyroid cancer,PDTC)
PDTC的預后介于分化型和間變性甲狀腺癌(anaplastic thyroid cancer,ATC)之間,為實性、梁性和島嶼狀生長模式的腫瘤;缺乏PTC細胞核特征;并且符合以下3條中的至少1條(10個高倍鏡視野≥3個核分裂象、腫瘤性壞死、扭曲核)。識別這一侵襲性亞型對于治療和隨訪均十分重要[3]。PDTC患者的5年生存率為60%~70%,復發多發生于發病前3年,平均疾病特異性生存時間為診斷后5年,對RAI治療的反應差。
2.3.4 ATC
ATC由高度惡性形態組成,通常為致死性腫瘤。應在報告中注明有無分化好的成分,如PTC或HCC。腫瘤間變性成分的比例和大小對預后有所影響,但并非獨立的預后因素[23]。殘留病灶仍是預測總生存率的唯一的獨立預后因素[23]。ATC患者的預后差,死亡率>90%。原發腫瘤伴廣泛浸潤是預后差的預測因素。老年患者、急性癥狀和白細胞增多均與生存率低相關。
2.4 核分裂象和壞死
ICCR專家組認為甲狀腺癌病理報告中應包括核分裂象和壞死[24]。絕大多數甲狀腺癌的核分裂象非常低。在核分裂象升高(≥3個核分裂象/2 mm2)的情況下需要進行計數;反之,可僅表示為<3個核分裂象/2 mm2。應于連續高倍視野下的熱點區域進行核分裂象計數。
應在每一份甲狀腺癌規范化報告中指出有無腫瘤壞死(圖1C)。必須與梗死樣壞死、細針穿刺活檢相關的反應性改變或腫瘤內的缺血性改變進行區分。
2.5 腫瘤包膜或界限以及包膜浸潤
在甲狀腺癌中,纖維包膜或界限清晰至關重要。即使在高級別腫瘤如低分化癌中,包膜的存在仍提示預后較好[10,25]。
目前對于包膜浸潤的病理定義仍存在爭論,病理報告中無需報告包膜浸潤的病灶數量。ICCR專家組認可CHAN提出的包膜和血管浸潤診斷標準[13]。包膜浸潤要求包膜全層穿透[26],但其判讀一致性欠佳[27]。
2.6 淋巴和血管浸潤
應區分淋巴管和血管浸潤。FTC和HCC多侵襲薄壁小血管,而PTC(浸潤性包裹性FVPTC除外)通常侵襲淋巴管。彌漫性硬化型PTC較易發現淋巴管浸潤。HCC相較于FTC,除了可以發生BVI外,還多見淋巴管內癌栓(圖1D)。BVI也可發生于PTC中,所侵犯脈管因其管徑較大且管壁存在平滑肌而易被識別為血管。然而,在某些情況下,無法明確所浸潤薄壁脈管類型時,可使用“無法分類的小脈管”予以描述。
BVI是重要的診斷和預后元素,必須明確診斷(圖1E)。BVI在包裹性腫瘤中侵及的血管應包含包膜或包膜外的血管;而在僅有部分包膜或無包膜的浸潤性腫瘤中,BVI可存在于腫瘤結節內。ICCR專家組認可CHAN提出的診斷BVI的標準[13],BVI需被覆血管內皮或伴有纖維素性壞死;如腫瘤具有包膜,則瘤內血管不應被診斷為BVI。
包裹型FTC或HCC中BVI病灶數量與預后相關[28]。ICCR指出,對于有包膜的病變,必須區分血管浸潤是局灶性(1~3個病灶)還是廣泛性(≥4個病灶)。尚無證據表明,BVI病灶數量與非包裹型PTC的預后相關,因此無需計數非包裹型PTC的BVI病灶數量。
完全包裹型PTC中的BVI病灶數量是核心元素。
2.7 ETE
ETE被定義為腫瘤浸潤范圍超出甲狀腺包膜至甲狀腺周圍組織,在甲狀腺癌中較為常見,在PTC中高達23.5%。ETE是與復發和死亡風險相關的不良預后因素。顯微鏡下可見ETE的相關復發風險為3%~9%[29];肉眼可見ETE的復發風險為23%~40%[30-31]。顯微鏡下可見ETE對于病變持續存在、無病生存和疾病特異性生存期來說,并非獨立的預后因素,觀察者之間的一致性較差[31-33]。ICCR強調病理報告應當做到如下2點:(1)評價ETE狀態;(2)與外科醫師溝通腫瘤分期,明確術中是否存在肉眼可見的ETE。
2.8 手術切緣狀態
甲狀腺癌手術切緣狀態是必不可少的元素,可以分為3類:R0切除(鏡下切緣陰性);R1切除(肉眼切除完整、鏡下切緣陽性);R2切除(切緣陽性或切除不完全)[6]。術中肉眼可見切緣狀態應由手術醫師告知病理科醫師。鏡下切緣陽性的定義是染色組織邊界和(或)甲狀腺外表面可見腫瘤細胞[34-36]。甲狀腺癌鏡檢切緣陽性并非復發和無疾病生存的獨立預測因素,尤其是在對腫瘤分期和ETE進行調整之后[34-36]。美國甲狀腺協會指南僅將不完全切除(R2)作為高風險病變的指標之一[3]。雖切緣狀態被視為核心元素,但現有數據提示陽性切緣所在位置(尤其是在后表面)可能并不影響預后,因此被視為非核心元素[34,37]。
2.9 淋巴結狀態
病理報告及分期中應包括淋巴結轉移的詳細特征(如數量、大小和淋巴結外浸潤),應測量淋巴結最大轉移灶的最大尺寸[33]。2019年,美國國家綜合癌癥網指南不再主張對于較小的N1a期(受累淋巴結數目<5個,最大轉移灶直徑<2 mm)行完全甲狀腺切除術和術后RAI治療。同樣,低風險類別包括體積較小的轉移性淋巴結,其定義為臨床N0期或≤5個病理性N1微轉移(最大轉移灶直徑<0.2 cm)[3]。對于高危人群,美國甲狀腺協會認為受累淋巴結數目≥5個為中風險,而受累淋巴結直徑≥3 cm為高風險。ICCR和美國病理學會以及最新的美國癌癥聯合委員會分期將淋巴結中僅存在砂粒體定義為微轉移(圖1F)[6]。
淋巴結外浸潤并不罕見,在PTC中高達12%,在淋巴結轉移性PTC中高達33%[33]。與ETE相似,甲狀腺癌的淋巴結外浸潤缺乏組織學標準共識,觀察者之間的一致性較差[38]。然而,多數研究的結果表明,淋巴結外浸潤與疾病持續和(或)復發相關[33,39]。因此,在分化型甲狀腺癌病理報告中記錄淋巴結外浸潤十分重要。
2.10 伴隨疾病和病理分期
伴隨疾病包括伴有慢性淋巴細胞性甲狀腺炎、濾泡性腺瘤、HCC、NIFTP和結節性增生等,有助于解釋臨床、影像學和細胞學檢查結果,應予以報告。
病理分期適用于所有的腫瘤類型,包括ATC,迄今為止已被自動分成4期[6,8]。
3 結論
ICCR甲狀腺規范化報告為甲狀腺癌患者提供了翔實的病理學檢查,為全球病理科醫師建立起更為合理的指導患者預后的病理報告模板,從而有助于防止致死性惡性腫瘤患者的治療不足,為惰性腫瘤患者免去不必要的治療。

