葡萄糖激酶激活劑治療2型糖尿病有效性和安全性的Meta分析 Δ
李 杰,陳曉菲,徐子寒,劉曉燕,張月嬋,韓 怡,張 衛 ,蔣志濤(張家港市中醫醫院藥學部,江蘇 張家港 215600)
2型糖尿病(diabetes mellitus type 2,T2DM)是一種因胰島素相對缺乏或胰島素抵抗,以血糖升高為特征的慢性代謝疾病。為了控制血糖、延緩并發癥的發生,T2DM患者往往需要在生活方式干預的基礎上終身服用降糖藥物。多國指南均建議將二甲雙胍作為治療T2DM的一線藥物[1—3],若血糖控制仍不佳,可以在此基礎上聯合應用包括二肽基肽酶4抑制劑(dipeptidyl peptidases-4 inhibitor,DPP-4i)、鈉-葡萄糖共轉運蛋白2抑制劑(sodium-glucose cotransporter 2 inhibitor,SGLT2i)等在內的其他作用機制的降糖藥物。盡管有多種降糖機制的藥物已被納入T2DM的標準治療路徑,但只有52.5%的患者血糖控制是達標的[4]。因此,為了避免現有降糖藥物治療效果隨時間推移而減弱或消失,仍然需要全新作用機制的降糖藥物作為治療補充。
葡萄糖激酶(glucokinase,GK)是人體內存在的一種葡萄糖代謝限速酶,主要分布在肝臟和胰腺,在肝臟調節葡萄糖的利用和糖原的合成,在胰島B細胞調控胰島素的分泌速率[5]。研究發現T2DM患者存在GK功能和表達受損的情況[6],而模擬激活GK可使肝臟葡萄糖代謝紊亂的狀態得到改善[7]。葡萄糖激酶激活劑(glucokinase activators,GKAs)借鑒了這種思路,通過增強GK活性,刺激胰島素分泌及促進肝臟對葡萄糖的利用而發揮降糖作用。然而隨著對GKAs的深入了解,部分GKAs存在的療效及安全性問題逐漸暴露出來,多款進入到臨床試驗階段的GKAs最終被放棄。總體而言,GKAs是一類極具前景的降糖新藥,考慮到至今仍未有具體品種上市,故通過分析上市前的臨床試驗來評價GKAs的療效和安全性尤為重要。基于此,本文檢索相關隨機對照試驗(randomized controlled trial,RCT)進行Meta分析,為GKAs的研發與臨床應用提供循證依據。
1 資料與方法
1.1 檢索策略
計算機檢索PubMed、Cochrane Library、Web of Science、Embase、中國知網,檢索時限均為建庫至2022年3月。采取主題詞和自由詞結合的方式,中文檢索詞為“葡萄糖激酶激活劑”“2型糖尿病”;英文檢索詞為“glucokinase activators”“GKAs”“diabetes type 2”“diabetes mellitus type 2”“type 2 diabetes”。
1.2 納入與排除標準
本研究的納入標準如下:(1)研究對象為≥18歲的T2DM患者;(2)研究設計為RCT;(3)試驗組患者口服GKAs,對照組患者口服安慰劑或其他降糖藥;(4)公開發表的英文和中文研究。本研究的排除標準如下:(1)合并妊娠、心血管疾病、嚴重肝腎功能損傷等其他并發癥的T2DM患者;(2)未報告結局指標的研究;(3)無法獲取全文的研究;(4)試驗方案存在缺陷、質量較低的研究。
1.3 文獻篩選與資料提取
由2名獨立研究者檢索文獻并進行篩選,排除不相關文獻,剩余文獻閱讀全文并進一步排除不符合納入標準的文獻。篩選完成后由2名研究者獨立提取資料,提取資料包括:(1)納入研究的基本信息——包括第一作者、發表時間、納入樣本量、納入患者的基線特征等;(2)試驗組和對照組的干預措施;(3)療效結局指標——糖化血紅蛋白(glycosylated hemoglobin,HbA1c)降低幅度、空腹血糖(fasting blood glucose,FBG)降低幅度、餐后2 h血糖(2 h-PFG)降低幅度;(4)安全性結局指標——低血糖發生率。2名研究者交叉核對結果,如出現意見不統一,與第3位研究者商議后裁定。
1.4 質量評價
采用Cochrane手冊推薦的RCT偏倚風險評價工具進行質量評價。評價內容包括:是否隨機分配、是否分配隱藏、是否采用盲法、結果數據是否完整、有無選擇性報告研究結果、其他偏倚。對每項內容作出“低風險”“高風險”“不確定”的判斷。
1.5 統計學方法
采用RevMan 5.4軟件進行Meta分析。采用I2檢驗進行異質性分析,對異質性小的研究(P>0.1,I2≤50%)采用固定效應模型進行Meta分析;異質性較大的研究(P≤0.1,I2>50%)先通過亞組分析探究異質性來源,若異質性對結果無實質性影響,則采用隨機效應模型進行Meta分析。連續型變量采用均數差(mean difference,MD),二分類變量采用比值比(risk ratio,RR)表示合并效應量;區間估計采用95%置信區間(confidence interval,CI)。檢驗水準α=0.05。
2 結果
2.1 文獻篩選結果
根據檢索策略共獲得文獻205篇,包括12篇中文文獻、193篇英文文獻;剔除重復文獻后剩余121篇;閱讀題名和摘要后剩余29篇;閱讀全文排除不符合上述納入標準的文獻20篇,最終納入文獻9篇[8—16],合計2 150例患者。
2.2 納入研究的基本特征
納入的9項研究均為RCT,3項在中國進行[10,15—16],1項在日本進行[9],其余在美國和歐洲進行[8,11—14]。樣本量最高為587人,最低為24人,療程1~24周不等。共納入7種GKAs,對照組均設有安慰劑,其他文獻特征見表1。
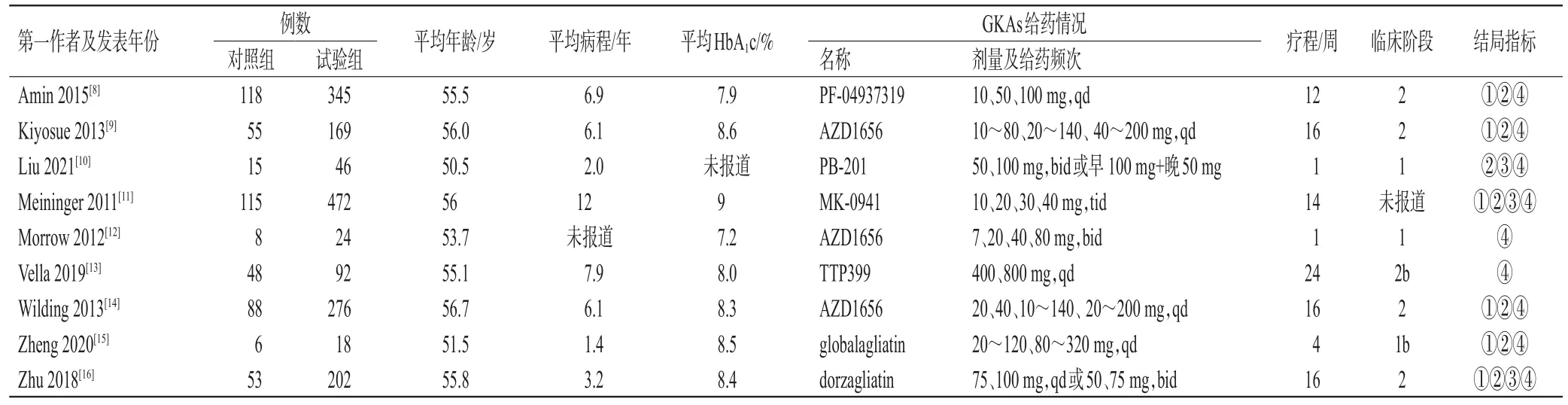
表1 納入文獻的基本特征
2.3 納入研究的質量評價結果
偏倚風險質量評估結果如圖1、圖2所示。9項研究的隨機化方法及分配隱藏描述較為清楚,2項研究為單盲[12,15],其他均為雙盲,數據資料均較為完整,無選擇性報告結果,其他偏倚來源未知。
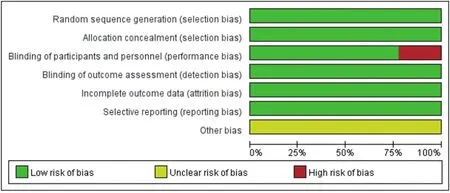
圖1 偏倚風險條圖

圖2 偏倚風險總圖
2.4 Meta分析結果
2.4.1 HbA1c降低幅度 6項RCT報道了HbA1c結局指標[8—9,11,14—16],各研究間異質性顯著(I2=63%,P=0.000 2)。根據原研究中GKAs設計的劑量,分為低、中、高3個劑量組(只有2個劑量組的分為低、高劑量組;4個劑量組的舍棄中間劑量中的較低一組,余下3組分為低、中、高劑量組進行亞組分析),采用隨機效應模型的Meta分析結果見圖3。結果顯示,與對照組相比,總體上試驗組患者HbA1c水平降低更顯著,差異有統計學意義[MD=-0.40,95%CI(-0.53,-0.26),P<0.000 01]。亞組分析中,低劑量組HbA1c的降低幅度與對照組相近,差異無統計學意義[MD=-0.18,95%CI=(-0.37,0.02),P=0.08];中劑量及高劑量組HbA1c的降低幅度均大于對照組,差異均有統計學意義[MD=-0.37,95%CI=(-0.50,-0.24),P<0.000 01;MD=-0.62,95%CI(-0.79,-0.44),P<0.000 01]。對此Meta分析進行敏感性分析,將納入的6項RCT逐一剔除后,雖然MD值及95%CI有細微變化,但結果沒有產生翻轉,對結論影響不大,提示本Meta分析結果較為可靠。
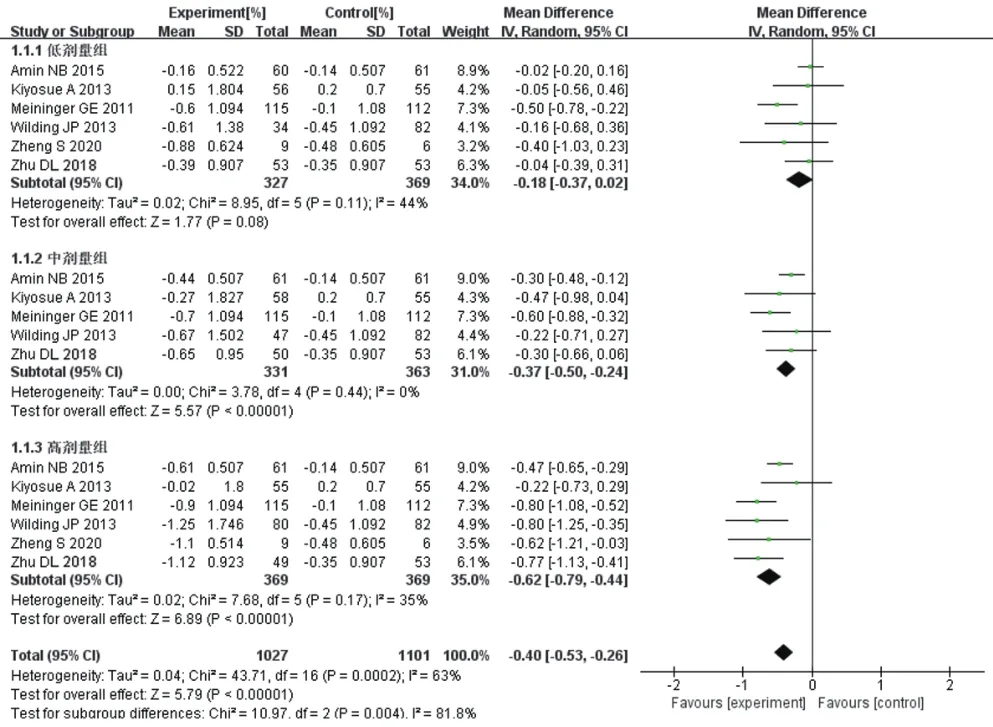
圖3 兩組患者HbA1c降低幅度比較的Meta分析森林圖
2.4.2 FBG降低幅度 7項RCT報道了FBG數據[8—11,14—16],各研究間異質性較顯著(I2=71%,P<0.000 01),采用隨機效應模型進行Meta分析的結果見圖4。結果顯示,與對照組相比,試驗組藥物FBG的降低幅度更大,差異有統計學意義[MD=-0.53,95%CI(-0.85,-0.20),P=0.001]。亞組分析中,低、中劑量組FBG的降低幅度與對照組相近,差異無統計學意義[MD=-0.27,95%CI(-0.72,0.17),P=0.23;MD=-0.20,95%CI(-0.80,0.39),P=0.50];高劑量組FBG的降低幅度大于對照組,差異有統計學意義[MD=-1.02,95%CI(-1.55,-0.48),P=0.000 2]。
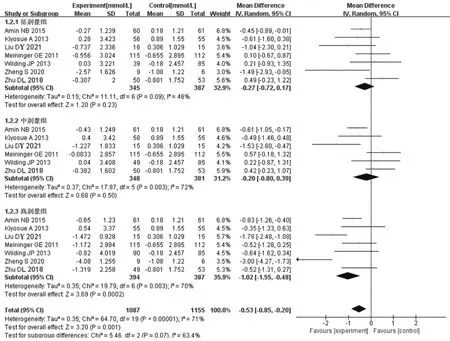
圖4 兩組患者FBG降低幅度比較的Meta分析森林圖
2.4.3 2 h-PFG降低幅度 3項RCT報道了2 h-PFG數據[10—11,16],各研究間無明顯異質性(I2=0,P=0.68),采用固定效應模型進行Meta分析的結果見圖5。結果顯示,與對照組相比,試驗組2 h-PFG的降低幅度更大,差異有統計學意義[MD=-2.28,95%CI(-2.68,-1.88),P<0.000 01]。亞組分析中,低、中、高3個劑量組2 h-PFG的降低幅度均大于對照組,差異均有統計學意義[MD=-2.02,95%CI(-2.72,-1.31),P<0.000 01;MD=-2.38,95%CI(-3.00,-1.76),P<0.000 01;MD=-2.43,95%CI(-3.20,-1.67),P<0.000 01]。
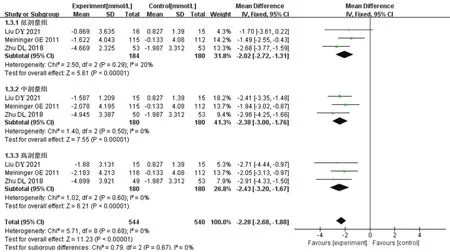
圖5 兩組患者2 h-PFG降低幅度比較的Meta分析森林圖
2.4.4 低血糖發生率 9項RCT報道了低血糖發生率[8—16],各研究間無明顯異質性(I2=0,P=0.71)。按照GKAs激活的臟器不同,分為胰腺肝臟雙激活劑和肝臟選擇性激活劑2組進行亞組分析,采用固定效應模型的Meta分析結果見圖6。總體而言,試驗組的低血糖發生率高于對照組,差異有統計學意義[RR=1.55,95%CI(1.20,2.01),P=0.000 8]。亞組分析中,胰腺肝臟雙激活劑組[RR=1.44,95%CI(1.11,1.89),P=0.007]和肝臟選擇性激活劑組[RR=2.26,95%CI(1.02,5.03),P=0.05]的低血糖發生率也要高于對照組,差異有統計學意義。
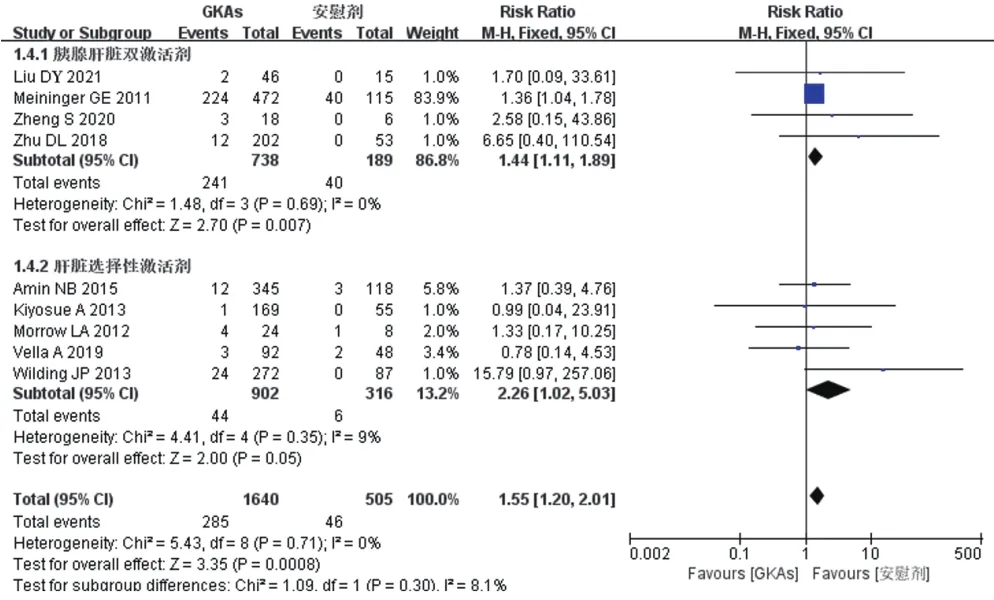
圖6 兩組低血糖發生率比較的Meta分析森林圖
2.5 發表偏倚分析
以低血糖發生率為指標繪制倒漏斗圖進行發表偏倚分析,結果各研究散落分布、對稱性較好,表明納入文獻的發表偏倚風險較低,結果見圖7。由于其他指標納入的研究少于9篇,所以沒有對其他指標的發表偏倚進行評價。
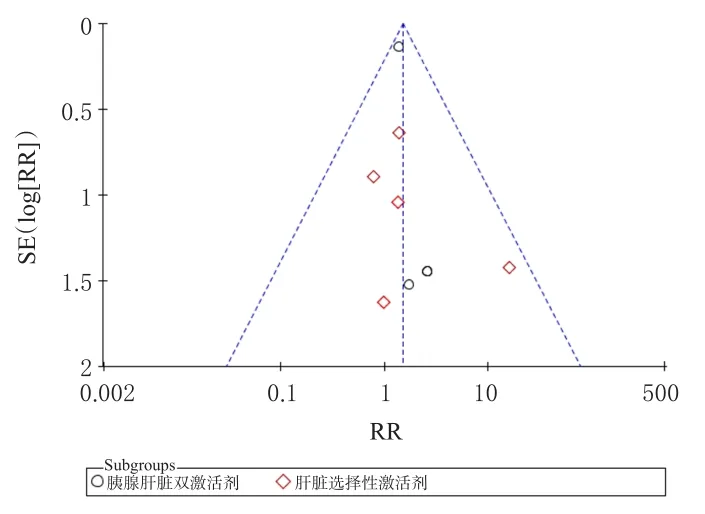
圖7 低血糖發生率的發表偏倚分析漏斗圖
3 討論
GKAs是近些年降糖藥研究領域的一大熱點,作為全新作用機制的藥物,其有潛力成為繼SGLT2i和胰高糖素樣肽1受體激動劑(glucagon-like peptide-1 receptor agonists,GLP-1RA)之后用于T2DM治療的一類新藥。目前我國在此領域的研發進度位于領先地位,國內公司研發的多格列艾汀(dorzagliatin)正處于國家藥品監督管理局審核階段,有望成為在中國首先上市的全球首創糖尿病新藥[17]。本次Meta分析結果表明,GKAs用于T2DM的治療,能顯著降低患者的HbA1c、FBG和2 h-PFG水平,但其導致的低血糖不容忽視。
自2003年第1個GKAs(RO0281675)問世以來[5],各藥企申請的GKAs化合物專利已超過70個[18],但實際進入臨床試驗階段的卻只有寥寥數個。主要原因在于老一代GKAs的療效和安全性問題都較為突出,其中低血糖、脂肪肝、血脂異常和長期療效下降的風險最為顯著[19]。而通過對老一代GKAs進行化學結構修飾后,新一代GKAs在臨床試驗中表現出了優秀的降糖能力和良好的安全性。療效方面,本次Meta分析的亞組分析結果顯示,低劑量GKAs并未發現能顯著降低患者HbA1c和FBG水平,中劑量也未能大幅度降低患者的FBG值,說明GKAs改善血糖相關指標的能力與其劑量呈正相關。此外,GKAs低、中、高3個劑量均能顯著降低2 h-PFG值,并未發現不同劑量組之間存在效果差異,從側面反映GKAs降低2 h-PFG的能力更強。造成這一結果的原因可能是[5,20]:雖然GK分布于胰腺和肝臟,但其99%分布于肝臟,在肝臟的表達更強。肝臟GK作為催化肝糖原合成的關鍵酶,被激活后使肝糖原存量提高,加上胰腺GK激活后可抑制胰高血糖素分泌,從而通過多重作用機制抑制糖尿病所致的餐后血糖升高。
安全性方面,本研究納入的7種GKAs總體低血糖發生率要比對照組高,亞組分析結果顯示肝臟選擇性GKAs和胰腺肝臟雙激活GKAs的低血糖發生率均比對照組高。胰腺肝臟雙激活GKAs可激活胰腺、肝臟等多臟器GK,而肝臟選擇性GKAs通過在藥物結構中引入羧基以避免藥物進入胰腺,僅激活肝臟GK,不觸發葡萄糖刺激的促胰島素釋放,避免因胰島素水平上升而上調肝臟的GK表達,理論上能降低低血糖發生率[21]。但本次Meta分析結果并未發現肝臟選擇性GKAs在低血糖發生率方面具有優勢。GKAs相關動力學研究表明,當GKAs與底物親和力α值(底物濃度的變化倍數)控制在0.04~0.1之間,穩定酶最大結合速率β值(最高酶催化速率的變化倍數)在0.8~1.8之間時,低血糖發生率較低[22]。最新的一項Ⅲ期臨床試驗顯示,胰腺肝臟雙激活dorzagliatin單藥長期治療并未增加低血糖發生率,展現出良好的安全性[23]。Meta分析與臨床試驗結果表明,GKAs的安全性是由多種因素決定的,如藥物選擇作用的靶器官、藥物分子空間結構等。
本研究尚存在一定局限性:(1)本研究的搜索語言僅限于英語和中文,納入的人種以歐美和亞洲人群為主,但不同民族的基礎代謝能力有所不同,可能對結果產生影響。(2)有2項研究采用的是單盲,這可能造成實施偏倚。(3)每項研究的GKAs種類、劑量及治療隨訪時間存在差異,合并結果對結論可靠性存在干擾。(4)納入的8篇研究為Ⅰ期或Ⅱ期臨床試驗,所涉及的GKAs實際療效和安全性有待Ⅲ期臨床及上市后表現驗證。(5)Meta分析合并的結果并不能完全代表單個GKAs,比如胰腺肝臟雙激活dorzagliatin在Ⅲ期臨床試驗中的低血糖發生率就極低[23]。
綜上所述,目前的臨床證據表明GKAs擁有優秀的血糖調控能力,后期的臨床開發需要改善其安全性問題。創新藥的研發是一個對GKAs療效及安全性持續認識和改進的過程,隨著研究的不斷深入,以dorzagliatin為代表的GKAs即將為T2DM的治療帶來新的選擇。

