大車前苷通過調控miR-711/S100A16信號通路表達抑制膀胱癌細胞的增殖和遷移
黃 耿,桂定文,付金倫,林 玲,萬京樺,袁 琛(鄂東醫療集團黃石市中心醫院泌尿外科,黃石 45000;腎臟疾病發生與干預湖北省重點實驗室;武漢科技大學職業危害識別與控制湖北省重點實驗室;通訊作者,E-mail:drhsszxyyhg@6.com)
膀胱癌來源于膀胱上皮,是我國最常見的泌尿系統惡性腫瘤[1]。盡管膀胱癌的治療策略近些年有了較大的發展,由于膀胱癌細胞增殖和遷移能力強,患者術后易復發、生存期較短,總體治療效果并不令人滿意[2]。針對膀胱癌增殖和遷移機制的研究顯得尤為迫切。已有研究表明,中藥提取物在細胞氧化應激、糖代謝、線粒體功能等方面發揮重要作用,能夠有效抑制腫瘤細胞增殖和遷移[3-5]。近年來,中藥提取物在多種腫瘤發生、發展中的作用被廣泛關注。大車前苷是車前草的活性成分,是一種苯丙烷類糖苷[6]。研究表明,大車前苷能夠明顯抑制多種腫瘤如黑色素瘤、宮頸癌、肝癌等細胞的增殖和轉移[7-9]。大車前苷在膀胱癌細胞中發揮的作用和分子機制并不清楚。本研究采用大車前苷處理膀胱癌MGH-U3細胞,觀察大車前苷對膀胱癌細胞增殖和遷移的影響,通過生物信息學技術和雙熒光素酶報告基因在分子水平研究大車前苷影響膀胱癌細胞惡性生物學行為的機制。
1 材料和方法
1.1 細胞和試劑
膀胱癌MGH-U3細胞購自美國ATCC細胞庫。大車前苷購自成都普瑞法科技開發有限公司(分析純、批號PRF20081722)。雙熒光素酶報告基因檢測試劑盒購自美國Promega公司。miR-711模擬序列、無意義模擬序列(NC)、野生型熒光S100A16報告載體(pcDNA-WT-S100A16)、突變型熒光S100A16報告載體(pcDNA-Mut-S100A16)購自武漢普美克生物有限公司。CCK-8試劑盒購自江蘇碧云天生物科技公司。qRT-PCR試劑盒購自美國Millipore公司。RPMI-1640培養基、胎牛血清購自美國Gibco公司。一抗S100A16、β-actin、p-AKT、p-ERK、c-Myc、CIP2A抗體均購自美國Abcam公司。
1.2 CCK-8法檢測MGH-U3細胞活力
將生長狀態良好的MGH-U3細胞接種于96孔板,取對數生長期的MGH-U3細胞,分別加入0,5,10,20,40,80 μg/ml的大車前苷,24 h后每孔加入30 μl的CCK-8試劑,在培養箱中孵育3.5 h,通過全自動酶標儀分析每孔MGH-U3細胞在450 nm波長處的光密度(OD)值。
1.3 細胞培養和處理
使用含10%胎牛血清的RPMI-1640培養基培養膀胱癌MGH-U3細胞,于37 ℃、5%CO2培養箱中培養。取對數生長期的MGH-U3細胞,細胞融合度達65%時,分別加入0,40 μg/ml的大車前苷,分別命名為對照組和大車前苷組。
1.4 細胞劃痕實驗檢測MGH-U3細胞遷移能力
將對照組和大車前苷組細胞懸液加入24孔板,經過48 h的孵育,用移液槍槍頭在24孔板孔底劃痕,用顯微鏡拍照并測量劃痕寬度B1。經過24 h的孵育,用顯微鏡拍照并測量劃痕寬度B2。對照組和大車前苷組MGH-U3細胞劃痕愈合率=(B1-B2)/B1×100%。
1.5 qRT-PCR檢測miR-711和S100A16 mRNA表達
用Trizol試劑從MGH-U3細胞提取RNA,逆轉錄反應合成cDNA,采用qRT-PCR試劑盒對miR-711和S100A16 mRNA相對表達量進行檢測。qRT-PCR引物如下:①miR-711上游引物:5′-TGCGCGGGACCCTGGGAGAGAT-3′,下游引物:5′-CCAGTGCAGGGTCCGAGGTATT-3′;②β-actin上游引物:5′-CACGATGGAGGGGCCGGACTCATC-3′,下游引物:5′-TAAAGACCTCTATGCCAACACAGT-3′;③S100A16上游引物:5′-ATGTCAGACTGCTACACGGAG-3′,下游引物:5′-GTTCTTGACCAGGCTGTACTTAG-3′;④U6上游引物:5′-CGCTTCGGCAGCACATATAC-3′,下游引物:5′-AAATATGGAACGCTTCACGA-3′。以U6作為miR-711的內參,β-actin作為S100A16 mRNA的內參。
1.6 生物信息學技術預測和雙熒光素酶報告基因實驗驗證miR-711的靶基因
通過miRGator數據庫預測miR-711潛在互補結合的基因是S100A16。當MGH-U3細胞生長狀態良好時,分別將pcDNA-WT-S100A16+miR-711、pcDNA-WT-S100A16+NC、pcDNA-Mut-S100A16+NC、pcDNA-Mut-S100A16+miR-711轉染MGH-U3細胞。當轉染48 h后,通過雙熒光素酶報告基因試劑盒檢測4組MGH-U3細胞的螢火蟲熒光素酶活性和海腎熒光素酶活性,兩者比值即為相對熒光素酶活性。
1.7 Western blot檢測S100A16和AKT-ERK信號通路蛋白表達水平
磷酸鹽緩沖液清洗對照組和大車前苷組MGH-U3細胞,分別加入60 μl含蛋白酶抑制劑的細胞裂解液,4 ℃裂解1 h,離心收集細胞裂解物。煮沸變性后,經8%十二烷基苯磺酸鈉-聚丙烯酰胺凝膠電泳分離,恒流轉膜至硝酸纖維素膜。采用40 g/L脫脂牛奶在常溫下封閉2 h,分別加一抗S100A16(1 ∶5 000稀釋)、β-actin(1 ∶5 000稀釋)、p-AKT(1 ∶2 000稀釋)、p-ERK(1 ∶1 000稀釋)、c-Myc(1 ∶3 000稀釋)、CIP2A(1 ∶3 000稀釋),4 ℃反應過夜。次日回收一抗,加入相應的二抗山羊抗兔,常溫下反應3 h。浸潤增強化學發光液,在Bio-Rad凝膠成像系統中顯影。
1.8 統計學方法
采用SPSS 14.0統計軟件分析數據,每組實驗均重復4次,計量資料均采用均數±標準差表示,多組數據間的比較采用單因素方差分析,兩組間數據的比較采用t檢驗,以P<0.05為差異有統計學意義。
2 結果
2.1 不同濃度大車前苷對MGH-U3細胞活力的影響
CCK-8結果顯示,分別采用0,5,10,20,40,80 μg/ml大車前苷處理膀胱癌MGH-U3細胞后,與0 μg/ml比較,隨著大車前苷處理濃度的升高,MGH-U3細胞活力顯著降低(F=29.16,P<0.05,見圖1),40 μg/ml大車前苷處理的抑制效果最明顯,選擇40 μg/ml大車前苷用于后續研究。
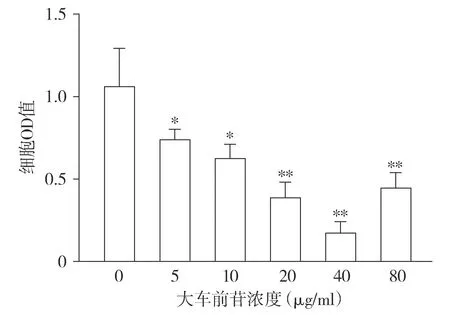
與0 μg/ml相比,*P<0.05,**P<0.01圖1 不同濃度大車前苷對MGH-U3細胞活力的影響Figure 1 Effect of different concentrations of plantamajoside on the viability of MGH-U3 cells
2.2 大車前苷對MGH-U3細胞遷移能力的影響
細胞劃痕實驗顯示,與對照組相比,大車前苷組MGH-U3細胞劃痕愈合率顯著降低(t=7.10,P<0.05,見圖2),提示大車前苷可抑制MGH-U3細胞的遷移。
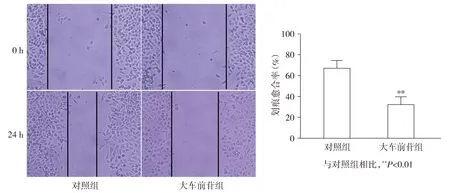
圖2 大車前苷對MGH-U3細胞遷移能力的影響Figure 2 Effect of plantamajoside on the migration ability of MGH-U3 cells
2.3 大車前苷對MGH-U3細胞miR-711表達的影響
qRT-PCR顯示,對照組和大車前苷組MGH-U3細胞中miR-711的表達分別為1.02±0.28和7.02±0.35,與對照組比較,大車前苷組MGH-U3細胞中miR-711表達顯著升高(t=27.03,P<0.01)。
2.4 生物信息學數據庫預測miR-711的靶基因
通過miRGator數據庫預測miR-711互補結合的靶基因是S100A16,miR-711與S100A16 mRNA序列498-523位點配對結合(見圖3)。

圖3 miR-711與S100A16 mRNA配對結合的位點Figure 3 Paired binding sites of miR-711 and S100A16 mRNA
2.5 雙熒光素酶報告基因實驗驗證miR-711與S100A16 mRNA的結合
雙熒光素酶報告基因實驗顯示,pcDNA-WT-S100A16+NC組和pcDNA-WT-S100A16+miR-711組相對熒光素酶活性分別為0.97±0.26和0.41±0.15(t=3.79,P<0.01),pcDNA-Mut-S100A16+NC組和pcDNA-Mut-S100A16+miR-711組相對熒光素酶活性分別為1.02±0.17和0.94±0.25(t=0.51,P>0.05,見圖4),證實miR-711能夠配對結合S100A16 mRNA。
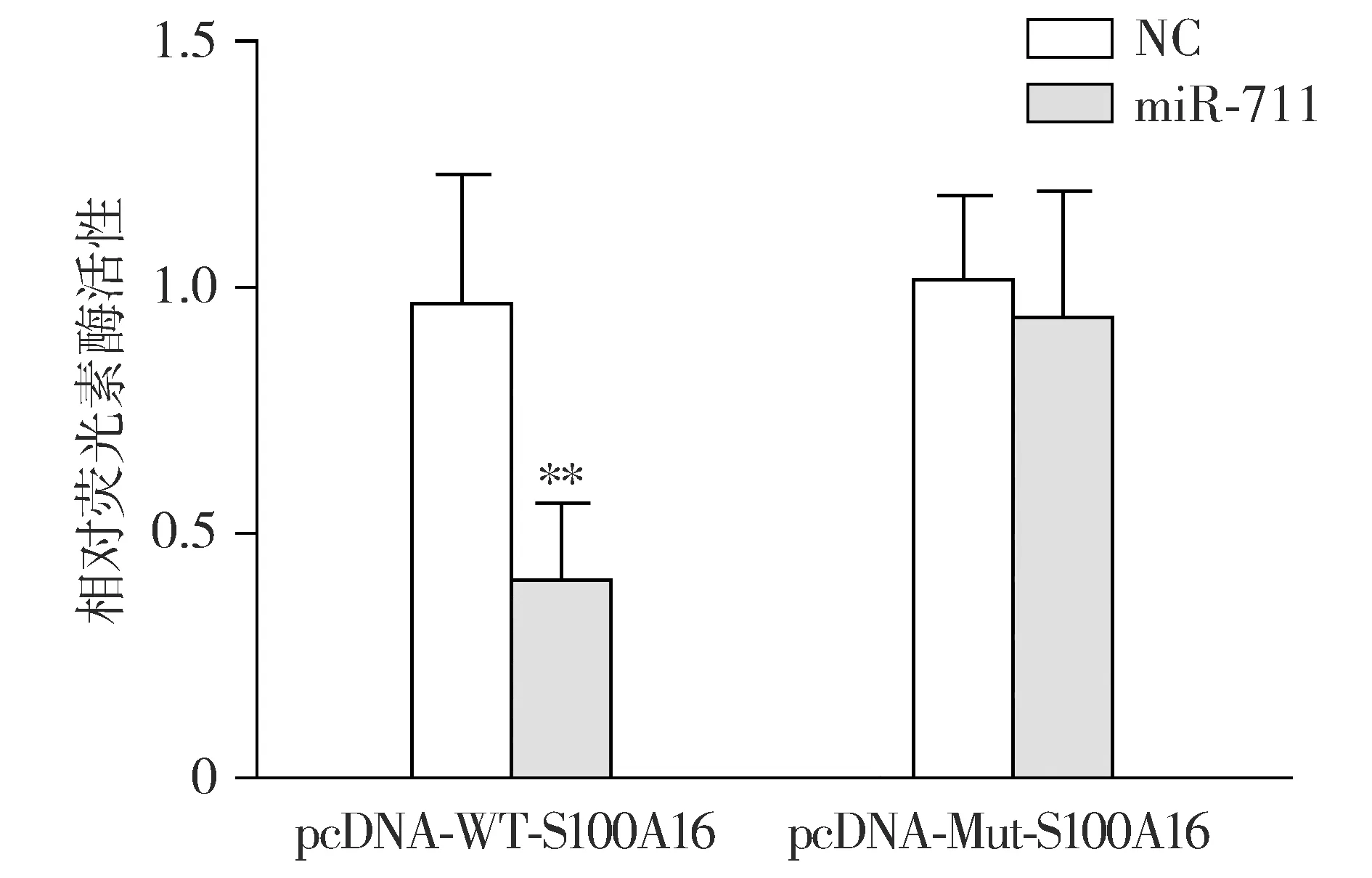
與pcDNA-WT-S100A16+NC組相比,**P<0.01圖4 雙熒光素酶報告基因實驗驗證miR-711與S100A16 mRNA的結合Figure 4 Verification of binding of miR-711 to S100A16 mRNA by dual-luciferase reporter gene assay
2.6 大車前苷對miR-711和S100A16 mRNA表達的影響
qRT-PCR結果顯示,對照組和大車前苷組MGH-U3細胞中miR-711的表達分別為1.02±0.28和7.02±0.35,大車前苷組MGH-U3細胞中miR-711表達顯著增多(t=27.03,P<0.01);對照組和大車前苷組MGH-U3細胞中S100A16 mRNA表達分別為5.85±1.09和1.04±0.18(t=8.68,P<0.01)。提示大車前苷增加miR-711表達后,S100A16 mRNA表達被抑制。
2.7 大車前苷對S100A16和AKT-ERK信號通路蛋白表達的影響
Western blot結果顯示,大車前苷處理MGH-U3細胞后,S100A16蛋白表達顯著降低,AKT-ERK信號通路蛋白如p-AKT、p-ERK、c-Myc、CIP2A表達顯著降低(見圖5)。
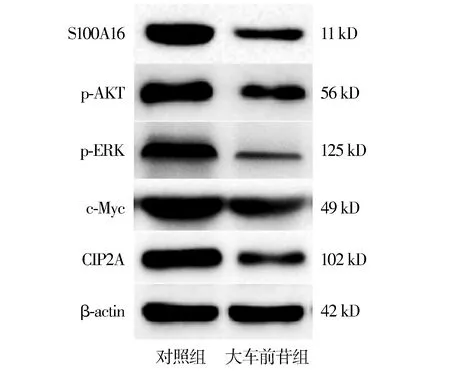
圖5 大車前苷對MGH-U3細胞S100A16蛋白和AKT-ERK信號通路蛋白表達的影響Figure 5 Effect of plantamajoside on the expression of S100A16 protein and AKT-ERK signaling pathway proteins in MGH-U3 cells
3 討論
大量文獻報道,中藥提取物蝙蝠葛堿、重樓皂苷、槲皮素、和厚樸酚通過抑制多種信號通路的激活,干擾膀胱癌細胞的增殖與轉移[10,11]。尋找有效安全的抗癌中藥提取物是膀胱癌研究者關注的熱點。大車前苷具有廣泛的生物學活性[12]。Xiao等[13]研究發現,大車前苷能夠抑制高糖誘導的大鼠腎小球系膜細胞的氧化應激、炎癥和細胞外基質積累。Wang等[14]研究發現,大車前苷通過抑制肝星狀細胞活化和增殖在肝臟中表現出抗纖維化作用。本研究結果顯示,不同濃度的大車前苷處理后膀胱癌MGH-U3細胞的活力明顯降低,細胞遷移距離明顯降低,表明大車前苷能夠抑制膀胱癌細胞的增殖和遷移。
微小RNA(miRNA)在中藥提取物的抗癌作用方面起到關鍵作用[15,16]。如芒柄花素通過調控miR-21的表達,抑制膀胱癌細胞的生長和侵襲[17]。miR-711在胃癌、前列腺癌中異常低表達,抑制腫瘤細胞的化療抵抗、轉移,在體內和體外抑制腫瘤細胞的增殖,其低表達往往預示腫瘤患者的預后不良[18]。本研究通過miRGator數據庫預測,miR-711可能互補結合的靶基因是S100鈣調蛋白A16(S100 calcium binding protein A16,S100A16)。雙熒光素酶報告基因實驗證實miR-711可與S100A16 mRNA互補結合,S100A16是miR-711的靶基因。S100A16基因在多種腫瘤如胰腺癌、胃癌、非小細胞肺癌中高表達,與腫瘤的耐藥性相關,可顯著促進腫瘤細胞的遷移和生長,S100A16低表達患者具有更好的預后[19,20]。本研究顯示,MGH-U3細胞中miR-711表達升高后,S100A16基因表達顯著減少,進一步證明S100A16是miR-711的靶基因。研究指出,S100A16蛋白主要通過激活AKT-ERK信號通路,促進p-AKT、p-ERK、c-Myc、CIP2A蛋白的表達,從而加速腫瘤的轉移和生長,對腫瘤的發生和發展起到促進作用[21]。本研究顯示,大車前苷處理MGH-U3細胞后,AKT-ERK信號通路蛋白如p-AKT、p-ERK、c-Myc、CIP2A表達顯著降低,表明AKT-ERK信號通路轉導被抑制,以上結果提示大車前苷通過調節miR-711/S100A16表達發揮作用。
綜上可見,本研究證實了大車前苷在膀胱癌MGH-U3細胞增殖和遷移中的抑制作用,其作用機制與miR-711/S100A16信號通路密切相關。大車前苷可能成為膀胱癌臨床治療的中藥提取物。

