晝夜紊亂對(duì)正常及2型糖尿病小鼠體質(zhì)量、血糖和肝臟生物節(jié)律基因表達(dá)的影響
劉夢(mèng)迪,劉繼文,王 黎,,盧婉賢(新疆醫(yī)科大學(xué)公共衛(wèi)生學(xué)院勞動(dòng)衛(wèi)生與環(huán)境衛(wèi)生學(xué)教研室,烏魯木齊 830054;新疆醫(yī)科大學(xué)第一附屬醫(yī)院臨床醫(yī)學(xué)研究院;通訊作者,E-mail:47433@qq.com)
T2DM是以胰島素抵抗伴隨胰島素進(jìn)行性分泌不足、持續(xù)性高血糖、高胰島素血癥為特征的慢性進(jìn)展性代謝性疾病,臨床典型癥狀為多尿、多飲、消瘦或體質(zhì)量減輕。全球糖尿病患者約5.3億,我國(guó)糖尿病患者居全球首位約1.41億[1,2]。糖尿病醫(yī)療費(fèi)用可占多達(dá)20%的國(guó)家衛(wèi)生保健預(yù)算,將造成嚴(yán)重的經(jīng)濟(jì)問(wèn)題和社會(huì)負(fù)擔(dān)。并且隨著人口的老齡化和社會(huì)的發(fā)展,糖尿病的患病率正急速上升。
倒班作為一種與T2DM相關(guān)的環(huán)境危險(xiǎn)因素變得越來(lái)越普遍,據(jù)統(tǒng)計(jì),倒班工作者估計(jì)占整個(gè)勞動(dòng)人口的20%[3],且全球倒班工作者人數(shù)呈上升趨勢(shì)。倒班工作可增加糖耐量異常的風(fēng)險(xiǎn),有研究表明倒班的時(shí)間和倒班的方式均可增加石油工人罹患T2DM的風(fēng)險(xiǎn)[4]。節(jié)律性睡眠障礙患者的睡眠不足可導(dǎo)致其糖耐量降低和高血糖。一項(xiàng)15年隊(duì)列研究表明,從事倒班工作的護(hù)士患糖尿病的風(fēng)險(xiǎn)可大大增加[5]。倒班工作人群作息時(shí)間不規(guī)律,可引起內(nèi)源性晝夜節(jié)律紊亂[6]。作為維持胰島素敏感性和葡萄糖穩(wěn)態(tài)的關(guān)鍵器官,肝臟是晝夜節(jié)律維持糖代謝的重要器官,有其自身的震蕩規(guī)律,能響應(yīng)視交叉上核(suprachiasmatic nucleus,SCN)的調(diào)節(jié),與其他外周器官共同維持穩(wěn)定的晝夜節(jié)律。人白蛋白啟動(dòng)子D位點(diǎn)結(jié)合蛋白(D-box binding protein,DBP)在肝臟晝夜節(jié)律的表達(dá)和調(diào)控葡萄糖代謝中起重要作用,參與多種時(shí)鐘輸出的調(diào)節(jié),包括運(yùn)動(dòng)活動(dòng)、睡眠分布和肝臟基因表達(dá)[7]。隱花色素基因1(cryptochrome1,CRY1)基因可以通過(guò)編碼糖皮質(zhì)激素受體和調(diào)節(jié)胰高血糖素的腺苷酸環(huán)化酶信號(hào)傳導(dǎo),進(jìn)而調(diào)節(jié)糖代謝[8,9]。鐘控基因晝夜節(jié)律蛋白2(period circadian protein2,PER2)和Cry1是一對(duì)負(fù)調(diào)控的生物鐘基因,在維持晝夜節(jié)律中不可缺少。研究表明Dbp可通過(guò)D反應(yīng)元件(D-box)調(diào)節(jié)包括Per2在內(nèi)的基因的表達(dá)[10]。但晝夜紊亂如何影響T2DM小鼠肝臟Dbp、Per2、Cry1等生物鐘基因表達(dá)水平未見(jiàn)報(bào)道。本研究以正常C57BL/6J和T2DM小鼠為研究對(duì)象,初步揭示晝夜紊亂對(duì)正常及T2DM小鼠體質(zhì)量、血糖以及對(duì)肝臟生物節(jié)律相關(guān)基因Dbp、Cry1、Per2表達(dá)的影響。
1 材料與方法
1.1 實(shí)驗(yàn)動(dòng)物
50只8周齡雄性C57BL/6J小鼠,體質(zhì)量(21±2)g,購(gòu)于新疆醫(yī)科大學(xué)實(shí)驗(yàn)動(dòng)物中心(SCXK(新)2018-0003)。飼養(yǎng)于新疆醫(yī)科大學(xué)實(shí)驗(yàn)動(dòng)物中心SPF級(jí)環(huán)境。恒溫(24±2)℃、恒濕(40%~70%)、光暗循環(huán)(12 h亮/12 h暗),自由飲食與飲水。本實(shí)驗(yàn)方案由新疆醫(yī)科大學(xué)第一附屬醫(yī)院倫理委員會(huì)審核批準(zhǔn)(K202101-19)。
1.2 造模及分組
1.2.1 分組 將50只雄性C57BL/6J小鼠隨機(jī)分為4組:正常對(duì)照組(control組)、2型糖尿病+晝夜正常組(T2DM)組、正常+晝夜節(jié)律紊亂組(shift組)、2型糖尿病+晝夜節(jié)律紊亂組(T2DM+shift組),每組各取12只。
1.2.2 構(gòu)建T2DM小鼠模型 實(shí)驗(yàn)小鼠使用高脂飼料(45%脂肪,MD12032,江蘇美迪森生物醫(yī)藥有限公司)喂養(yǎng)4周,禁食不禁水12 h后腹腔內(nèi)注射低劑量STZ(S0130,Sigma,美國(guó))誘導(dǎo)T2DM,注射1周后開始監(jiān)測(cè)小鼠空腹血糖,當(dāng)空腹血糖水平>11.1 mmol/L(200 mg/dl)被認(rèn)定為2型糖尿病造模成功,并被選作進(jìn)一步研究。剔除死亡和血糖下降的小鼠后,隨機(jī)將其分為T2DM組和T2DM+shift組,繼續(xù)喂養(yǎng)高脂飼料。對(duì)照組的小鼠則喂養(yǎng)普通飼料(MD17121,江蘇美迪森生物醫(yī)藥有限公司),腹腔內(nèi)注射相同劑量的檸檬酸-檸檬酸鈉緩沖液后,隨機(jī)將其分為control組和shift組。
1.2.3 構(gòu)建晝夜節(jié)律紊亂小鼠模型 T2DM+shift組和shift組小鼠連續(xù)暴露于重復(fù)光相移4~6周,在每周前3 d保持光周期提前8 h狀態(tài),在后4 d恢復(fù)正常的光照周期[11,12]。T2DM組和control組采用正常光照周期。
1.3 指標(biāo)檢測(cè)
1.3.1 小鼠體質(zhì)量及血糖測(cè)量 在4個(gè)時(shí)間點(diǎn)收集小鼠體質(zhì)量和血糖值數(shù)據(jù):基線、第2周、第3周、第4周。第4周與基線體質(zhì)量的差值即為該小鼠的體質(zhì)量增加量。取小鼠肝臟組織至-80 ℃冰箱保存,待后續(xù)研究,最后對(duì)小鼠實(shí)行安樂(lè)死。
1.3.2 葡萄糖耐量實(shí)驗(yàn)(oral glucose tolerance test, OGTT) 四組小鼠禁食但不禁水12 h,按照2 g/kg葡萄糖溶液劑量進(jìn)行腹腔注射,在注射后0,30,60,90,120 min通過(guò)剪尾采集血樣,使用血糖試紙和手持式血糖儀(140104,三諾生物傳感有限公司)測(cè)定小鼠血糖值,繪制相應(yīng)曲線圖并按公式計(jì)算曲線下面積(area under curve, AUC)。
1.3.3 胰島素耐量實(shí)驗(yàn)(insulin tolerance test, ITT) 四組小鼠禁食但不禁水6 h,按照0.5 IU/kg的胰島素溶液劑量進(jìn)行腹腔注射,在注射后0,30 min通過(guò)剪尾采集血樣,使用血糖試紙和手持式血糖儀測(cè)定小鼠血糖,繪制相應(yīng)曲線圖并按公式計(jì)算AUC。
1.4 qRT-PCR檢測(cè)Dbp、Cry1、Per2的表達(dá)


表1 qRT-PCR檢測(cè)Dbp、Cry1、Per2表達(dá)的引物序列Table 1 Primer sequences of Dbp, Cry1, Per2 for qRT PCR
1.5 統(tǒng)計(jì)學(xué)處理
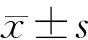
2 結(jié)果
2.1 小鼠體質(zhì)量及血糖的變化
各組小鼠第4周與第1周體質(zhì)量增加量不同(F=49.81,P<0.001)。與control組相比,T2DM組、shift組和T2DM+shift組小鼠體質(zhì)量增加量較少,差異有統(tǒng)計(jì)學(xué)意義(P<0.05);與T2DM組相比,T2DM+shift組小鼠體質(zhì)量增加量較多,差異有統(tǒng)計(jì)學(xué)意義(P<0.05,見(jiàn)表2)。
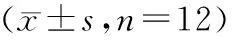
表2 四組小鼠4周體質(zhì)量增加量比較Table 2 Comparison of weight gain of mice in 4 weeks between
2.2 小鼠造模成功后晝夜節(jié)律紊亂干預(yù)4周血糖值變化比較
血糖值數(shù)據(jù)符合球?qū)ΨQ性,Mauchly檢驗(yàn)P>0.05,重復(fù)測(cè)量方差分析結(jié)果顯示各組血糖值之間存在差異(F=699.59,P<0.05);組內(nèi)4個(gè)時(shí)間點(diǎn)血糖值差異無(wú)統(tǒng)計(jì)學(xué)意義(F=1.34,P>0.05);血糖值和時(shí)間無(wú)交互作用(F=1.39,P>0.05)。T2DM組和T2DM+shift組在第1~4周的血糖均高于control組(P<0.05)。與control組相比,shift組在第1和2周的血糖有升高趨勢(shì),但差異無(wú)統(tǒng)計(jì)學(xué)意義(P>0.05),在第3和4周的血糖較高,差異有統(tǒng)計(jì)學(xué)意義(P<0.05)。與T2DM組相比,T2DM+shift組第1~4周血糖值均較低,差異有統(tǒng)計(jì)學(xué)意義(P<0.05,見(jiàn)表3)。
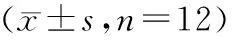
表3 四組小鼠血糖變化值比較Table 3 Comparison of blood glucose changes in four
2.3 各組小鼠OGTT和ITT實(shí)驗(yàn)結(jié)果
各組小鼠第4周分別進(jìn)行OGTT和ITT實(shí)驗(yàn)。各組小鼠OGTT和ITT實(shí)驗(yàn)AUC不同,差異有統(tǒng)計(jì)學(xué)意義(P<0.05)。與control相比,T2DM組OGTT和ITT實(shí)驗(yàn)血糖AUC升高(P<0.05),shift組OGTT和ITT實(shí)驗(yàn)血糖AUC差異無(wú)統(tǒng)計(jì)學(xué)意義(P>0.05);與T2DM組相比,T2DM+shift組OGTT和ITT實(shí)驗(yàn)血糖AUC升高,差異有統(tǒng)計(jì)學(xué)意義(P<0.05,見(jiàn)表4)。
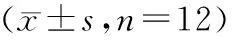
表4 四組小鼠OGTT試驗(yàn)和ITT試驗(yàn)血糖曲線下面積比較Table 4 Comparison of area under blood glucose curve in OGTT test and ITT test between four groups
2.4 肝臟生物節(jié)律相關(guān)基因Cry1、Per2以及Dbp表達(dá)
各組小鼠Cry1(F=1.26,P>0.05)、Per2(F=16.99,P<0.05)、Dbp(F=3.58,P<0.05)的PCR實(shí)驗(yàn)結(jié)果不同,其中Per2、Dbp各組基因表達(dá)差異有統(tǒng)計(jì)學(xué)意義。與control組相比,T2DM組和shift組Cry1基因表達(dá)差異無(wú)統(tǒng)計(jì)學(xué)意義(P>0.05);與T2DM組相比,T2DM+shift組Cry1基因表達(dá)差異無(wú)統(tǒng)計(jì)學(xué)意義(P>0.05)。與control組相比,T2DM組和shift組Per2基因表達(dá)差異無(wú)統(tǒng)計(jì)學(xué)意義(P>0.05);與T2DM組相比,T2DM+shift組Per2基因表達(dá)上調(diào)(P<0.05)。與control組相比,T2DM組Dbp基因表達(dá)差異無(wú)統(tǒng)計(jì)學(xué)意義(P>0.05),shift組Dbp基因表達(dá)上調(diào)(P<0.05);與T2DM組相比,T2DM+shift組Dbp基因表達(dá)差異無(wú)統(tǒng)計(jì)學(xué)意義(P>0.05,見(jiàn)圖1)。
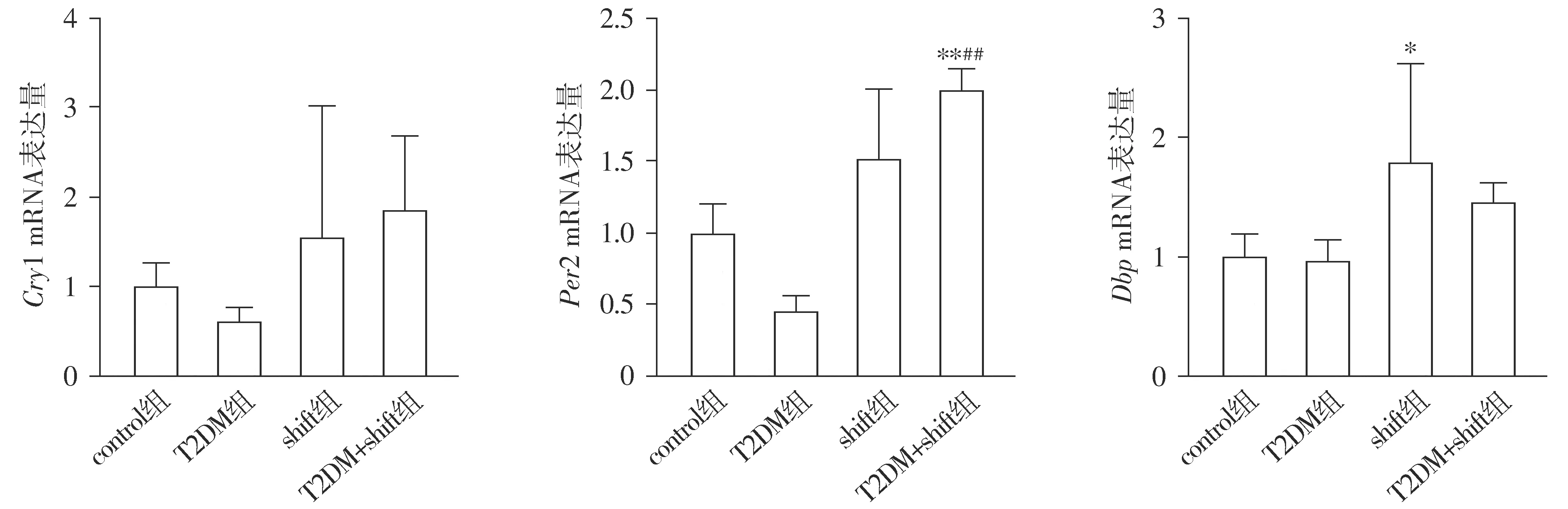
與control組比較,*P<0.05,**P<0.01;與T2DM組比較,##P<0.01圖1 qRT-PCR檢測(cè)四組小鼠Cry1、Per2、Dbp mRNA表達(dá)量結(jié)果Figure 1 The mRNA expression of Cry1, Per2, Dbp in four groups by qRT PCR
3 討論
隨著人口的老齡化和社會(huì)的發(fā)展,糖尿病的患病率正急速上升。倒班作為一種與T2DM相關(guān)的環(huán)境危險(xiǎn)因素變得越來(lái)越普遍,時(shí)鐘基因通過(guò)其周期性表達(dá)誘導(dǎo)晝夜節(jié)律并調(diào)節(jié)多種生理功能。由分子生物鐘系統(tǒng)形成的核心環(huán)路和輔助環(huán)路來(lái)調(diào)節(jié)哺乳動(dòng)物的晝夜節(jié)律[13,14]。光照是重要的授時(shí)因素,晝夜改變可以降低人類胰島素敏感性和葡萄糖代謝,使肥胖和糖尿病風(fēng)險(xiǎn)增加[15]。本研究以正常C57BL/6J和T2DM小鼠為研究對(duì)象,初步揭示晝夜紊亂對(duì)正常及T2DM小鼠體質(zhì)量、血糖以及肝臟生物節(jié)律相關(guān)基因Dbp、Cry1、Per2表達(dá)的影響。本研究以期為進(jìn)一步研究晝夜節(jié)律紊亂影響葡萄糖穩(wěn)態(tài)及T2DM的分子機(jī)制提供依據(jù),為倒班工作人群糖代謝異常和T2DM提供潛在的防控措施。
本研究發(fā)現(xiàn)T2DM組、shift組和T2DM+shift組小鼠體質(zhì)量增加量均較control組小鼠少。T2DM組小鼠可能因?yàn)轶w內(nèi)胰島素的減少[16],故而不能有效利用食物中糖類產(chǎn)生的能量,從而加快蛋白質(zhì)和脂肪的分解利用,最終降低體質(zhì)量。研究表明[17]小鼠晝夜節(jié)律紊亂能促進(jìn)體質(zhì)量增加和肝脂質(zhì)蓄積。與之前研究[17]不同,本研究比較干預(yù)前后體質(zhì)量增加量的變化,發(fā)現(xiàn)shift組體質(zhì)量增加量較control組少。與T2DM組相比,T2DM+shift組小鼠體質(zhì)量降低較少,可能是晝夜紊亂可能使糖尿病小鼠瘦素分泌減少[18],繼而激發(fā)覓食行為從而增加體質(zhì)量,影響胰高血糖素的分泌,從而使體質(zhì)量消耗減少[19]。
一項(xiàng)對(duì)1 415名倒班工作者的現(xiàn)況調(diào)查發(fā)現(xiàn),該人群血糖異常的發(fā)生率為21.2%,糖尿病的患病率為8.3%[20]。研究表明當(dāng)作息改變、睡眠紊亂、飲食時(shí)間不規(guī)律等外源因素引起生物體晝夜節(jié)律紊亂時(shí),可明顯增加糖尿病的發(fā)病風(fēng)險(xiǎn)[15]。4 d的模擬夜班工作足以降低健康成年人胰島素敏感性,增加T2DM的風(fēng)險(xiǎn)[21]。研究表明與內(nèi)源性時(shí)鐘異相進(jìn)食會(huì)導(dǎo)致中央和外周時(shí)鐘系統(tǒng)的節(jié)律之間以及不同組織時(shí)鐘(如肝臟)的節(jié)律之間失去同步[22]。在最健康的情況下,這些器官的功能節(jié)律是同步的。本研究發(fā)現(xiàn)與control組相比,晝夜紊亂會(huì)使小鼠血糖增加。與T2DM組相比,T2DM+shift組血糖值僅有降低趨勢(shì),可能是由于不同的代謝活躍器官之間的失步從而導(dǎo)致葡萄糖穩(wěn)態(tài)的改變[21]。
光照、晝夜節(jié)律基因等因素引起的晝夜節(jié)律失調(diào)會(huì)導(dǎo)致糖耐量降低,胰島素敏感性下降,從而降低糖原合成、加強(qiáng)糖異生、胰島素抵抗、葡萄糖穩(wěn)態(tài)失衡,最終使血糖升高[23,24]。有研究在光照時(shí)間變化模擬的倒班小鼠中發(fā)現(xiàn)倒班會(huì)使雌性小鼠在光照時(shí)間的胰島素敏感性發(fā)生變化[12],雖然每日葡萄糖耐量的平均水平?jīng)]有降低,但是葡萄糖耐量的階段提前了2.27 h,振幅降低了20.4%。OGTT期間血糖峰值延遲預(yù)示著β細(xì)胞功能下降和調(diào)節(jié)葡萄糖代謝的能力變差。本研究通過(guò)葡萄糖耐量試驗(yàn)和胰島素耐量實(shí)驗(yàn)發(fā)現(xiàn)與control組相比,shift組AUC面積增加;與T2DM組相比,T2DM+shift組AUC面積增加;表明晝夜紊亂會(huì)使β細(xì)胞功能下降和調(diào)節(jié)葡萄糖代謝的能力變差、胰島素分泌受損、糖耐量受損。這與先前的研究結(jié)果一致[25]。
研究發(fā)現(xiàn)[8],Per2缺陷小鼠和Cry1缺陷小鼠會(huì)出現(xiàn)葡萄糖不耐受,Cry1表達(dá)過(guò)多可通過(guò)抑制胰高血糖素的腺苷酸環(huán)化酶信號(hào)的傳導(dǎo)來(lái)抑制肝臟糖異生并使胰島素敏感性增加,Cry1與小分子物質(zhì)KL001的結(jié)合可以防止泛素化降解從而使生物鐘周期變長(zhǎng),并同時(shí)抑制胰高血糖素誘導(dǎo)的糖異生作用[26]。肝臟產(chǎn)生正常晝夜節(jié)律的關(guān)鍵是細(xì)胞色素Cyp2a4(Cytochrome P450 2A4, CYP2A4)和Cyp2a5(Cytochrome P450 2A45,CYP2A5)基因,Dbp與Cyp2a4/5啟動(dòng)子有高度親和力的結(jié)合位點(diǎn),可通過(guò)Cyp2a4/5調(diào)控小鼠肝臟中肝臟晝夜節(jié)律的表達(dá)并對(duì)Cyp2a4/5的轉(zhuǎn)錄具有抑制作用。Dbp基因敲除會(huì)導(dǎo)致小鼠肝臟正常的晝夜節(jié)律發(fā)生改變[27]。本研究發(fā)現(xiàn)與control組相比,T2DM組小鼠肝臟中的生物鐘基因Dbp、Per2和Cry1的mRNA水平下調(diào),而shift組和T2DM+shift組小鼠肝臟Dbp、Per2、Cry1基因表達(dá)升高;與T2DM組相比,T2DM+shift組小鼠肝臟Dbp、Per2、Cry1基因的表達(dá)升高。晝夜紊亂會(huì)上調(diào)生物鐘基因Dbp、Per2、Cry1的mRNA表達(dá)水平,從而調(diào)控血糖及胰島素分泌。
綜上所述,晝夜紊亂會(huì)使正常小鼠體質(zhì)量增加量減少、血糖升高,糖耐量和胰島素分泌受損,肝臟生物節(jié)律基因Dbp、Per2、Cry1表達(dá)下調(diào);使T2DM小鼠體質(zhì)量增長(zhǎng),血糖水平降低,肝臟生物節(jié)律基因Dbp、Per2、Cry1基因表達(dá)升高。在本實(shí)驗(yàn)中未能進(jìn)一步闡明晝夜紊亂如何通過(guò)具體的分子機(jī)制影響糖代謝及促進(jìn)T2DM的發(fā)生發(fā)展,在后續(xù)試驗(yàn)中將進(jìn)一步完善不足之處。

