H2O2直接氧化甲苯合成鄰/對甲酚
俞新南 ,朱小剛 ,劉 芳 ,張 躍 ,嚴生虎 ,劉建武
1.南通醋酸化工股份有限公司,江蘇 南通 226017;2.常州大學藥學院,江蘇 常州 213164;3.石油和化工行業連續流技術工程實驗室,江蘇 常州 213164
鄰/對甲酚是重要的精細化學品,在醫藥、農藥和香料等領域應用十分廣泛[1]。傳統的甲酚生產方法主要有甲苯磺化堿熔法[2]、苯酚烷基化法[3]、異丙基甲苯氧化法[4]、甲苯氯化水解法[5]和甲基苯胺法[6]等,其中甲苯磺化堿熔法是最早用于生產甲酚的方法,技術成熟,工藝簡單,但因使用大量強酸強堿,設備腐蝕和環境污染嚴重,目前已被逐步淘汰。苯酚烷基化法、異丙基甲苯氧化法和甲苯氯化水解法已在國外規模化生產,這3種方法普遍存在工藝過程復雜、污染嚴重、高溫高壓以及對設備腐蝕嚴重等缺點,因此有待開發新的生產工藝。
近年來,利用甲苯和H2O2直接羥基化合成甲酚的研究較多[7-8]。由于芳香族化合物苯環上的C—H鍵能高,不易直接活化且在苯環上直接引入羥基很困難,同時芳環羥基化和甲苯側鏈氧化存在競爭反應,氧化歷程和產物分布難以精確控制,因此,高活性/高選擇性催化劑是羥基化反應進行的關鍵。這類催化劑主要有FeO[9-10]、Al2O3-Fe2O3復合金屬氧化物[11-12]、硅鉬釩和硅鎢釩雜多酸鹽[13-14]和鈦硅分子篩(Ts-1)[15-16]等,最終甲苯轉化率約11.7%、苯甲醛選擇性約52.2%、甲酚選擇性約38.8%,同時還有苯甲醇和其他副產物生成。由此可見,這些催化劑普遍存在原料轉化率低、產品選擇性低、催化劑制備復雜和反應時間長等問題。過氧化氫法是以甲苯和H2O2為原料,在催化劑作用下直接氧化生成鄰/對甲酚,不需要經過磺化、水解、酸化和分離等步驟,因為該工藝不使用強酸強堿,不會產生大量較難處理的廢水,且其反應步驟少、綠色無污染、原子利用率高,因而成為甲酚合成研究的主要方向。
筆者在現有制備方法基礎上,以過渡金屬鹽及其氧化物為催化劑,甲苯經H2O2液相氧化直接生成鄰/對甲酚,該制備方法具有原子經濟性高、工藝簡潔和環境友好等特點,為工業上制備酚類化合物提供新的路徑。
1 實驗
1.1 試劑和儀器
甲苯,分析純,國藥集團化學試劑有限公司;H2O2溶液,工業級,中鹽常州化工有限公司;硫酸氧釩、偏釩酸銨,分析純,上海達瑞精細化學品有限公司;醋酸鈷、醋酸銅、乙腈、丙酮,分析純,上海凌峰試劑有限公司;冰醋酸,化學純,上海申博化工有限公司;叔丁醇,分析純,上海展云化工有限公司;環氧酸鈷、FeSO4、草酸亞鐵、Fe2O3、FeO、CuCl,分析純,北京百靈威科技有限公司。
Agilent7890B 型氣相色譜儀,安捷倫科技有限公司;DF101S 型集熱式恒溫磁力攪拌器,鞏義市予華儀器有限責任公司;RE-3000A 型旋轉蒸發儀器,上海亞榮生化儀器廠;DLSB-500 型低溫冷卻循環泵,南京科爾儀器設備有限公司。
1.2 實驗過程
在配有水冷凝裝置、溫度計和磁力攪拌加熱裝置的四口燒瓶中,加入一定量甲苯、催化劑和溶劑,加熱攪拌,開啟冷凝水。升溫到一定溫度后,量取適量H2O2溶液倒入恒壓滴液漏斗中,控制滴加速度,反應結束后,料液用二氯甲烷多次萃取,保留有機相,進行氣相色譜定量分析。
1.3 反應機制
甲苯羥基化反應可以發生在芳環上,也可以在側鏈上進行,芳環上親電取代反應產物為鄰/間/對甲酚,側鏈上自由基反應產物為苯甲醇和苯甲醛[17-20],其反應機制見圖1。
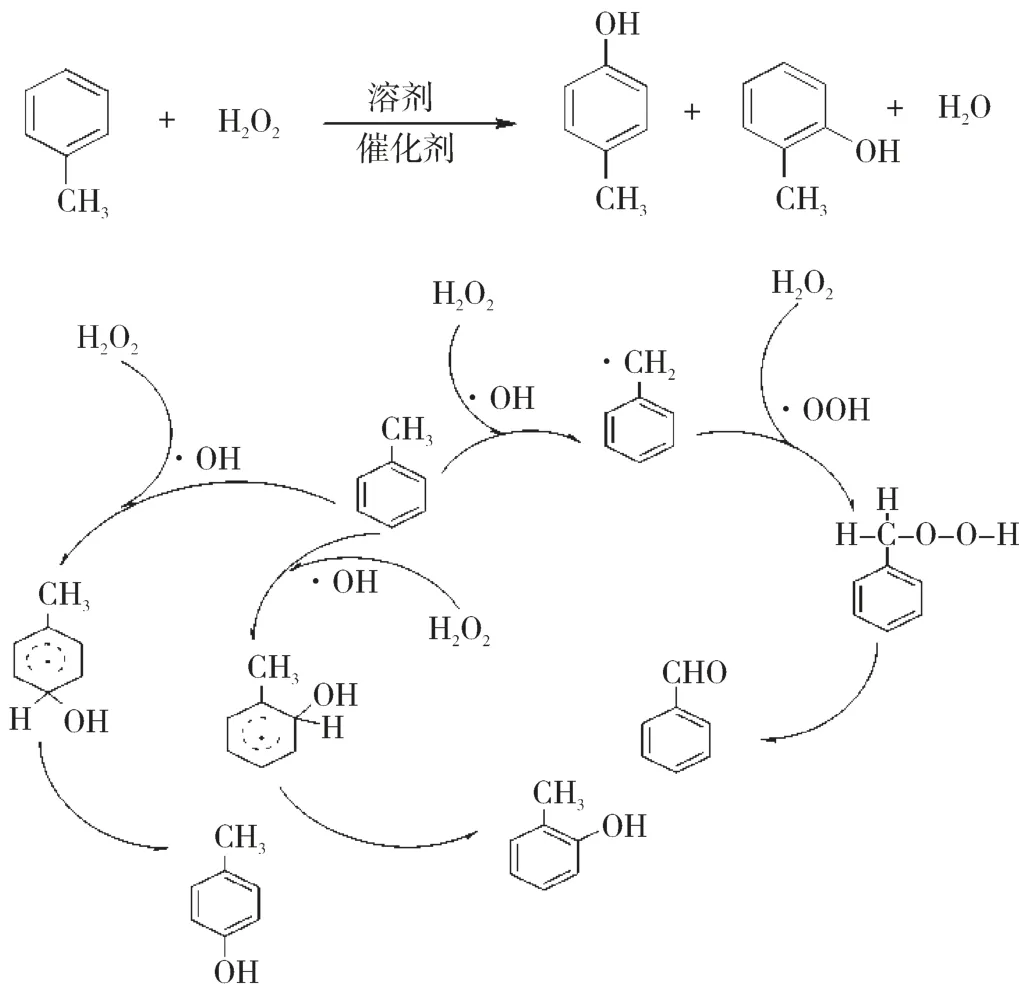
圖1 甲苯直接氧化反應機制
氧化過程中過渡金屬離子促使H2O2均裂產生·OH,而過渡金屬離子在H2O2的作用下被氧化為高價態離子,·OH 進攻甲苯形成酚羥基離子,與體系中的高價態過渡金屬離子作用,通過釋放一個電子,發生親電取代形成甲酚。甲苯在過渡金屬離子作用下生成芐基自由基,·OH進攻芐基生成不穩定中間態,脫去一分子水,形成副產物苯甲醇和苯甲醛,進一步深度氧化成苯甲酸。
1.4 分析方法
采用Agilent7890B 型氣相色譜儀進行定量檢測,色譜柱為HP-5(30 m×300 μm×0.25 μm),進樣口溫度240 ℃,檢測器溫度250 ℃,程序升溫(初溫100 ℃,以25 ℃/min升溫至250 ℃),進樣量1 μL。采用面積歸一化法計算分析結果。
1.5 轉化率與選擇性計算
甲苯轉化率與鄰甲酚、對甲酚和苯甲醛的選擇性計算見式(1)~(4)。

式中:X(甲苯)為甲苯轉化率,S(鄰甲酚)為鄰甲酚選擇性,S(對甲酚)為對甲酚選擇性,S(苯甲醛)為苯甲醛選擇性,n0為加入的甲苯物質的量,n1為所消耗的甲苯物質的量,n2為鄰甲酚物質的量,n3為對甲酚物質的量,n4為苯甲醛物質的量。
2 結果與討論
2.1 結構表征
甲苯羥基化反應親電取代反應產物為鄰/對甲酚,自由基反應產物為苯甲醛。甲苯直接氧化過程產物中鄰甲酚、對甲酚和苯甲醛樣品的質譜圖和1H NMR譜圖如圖2和3所示。
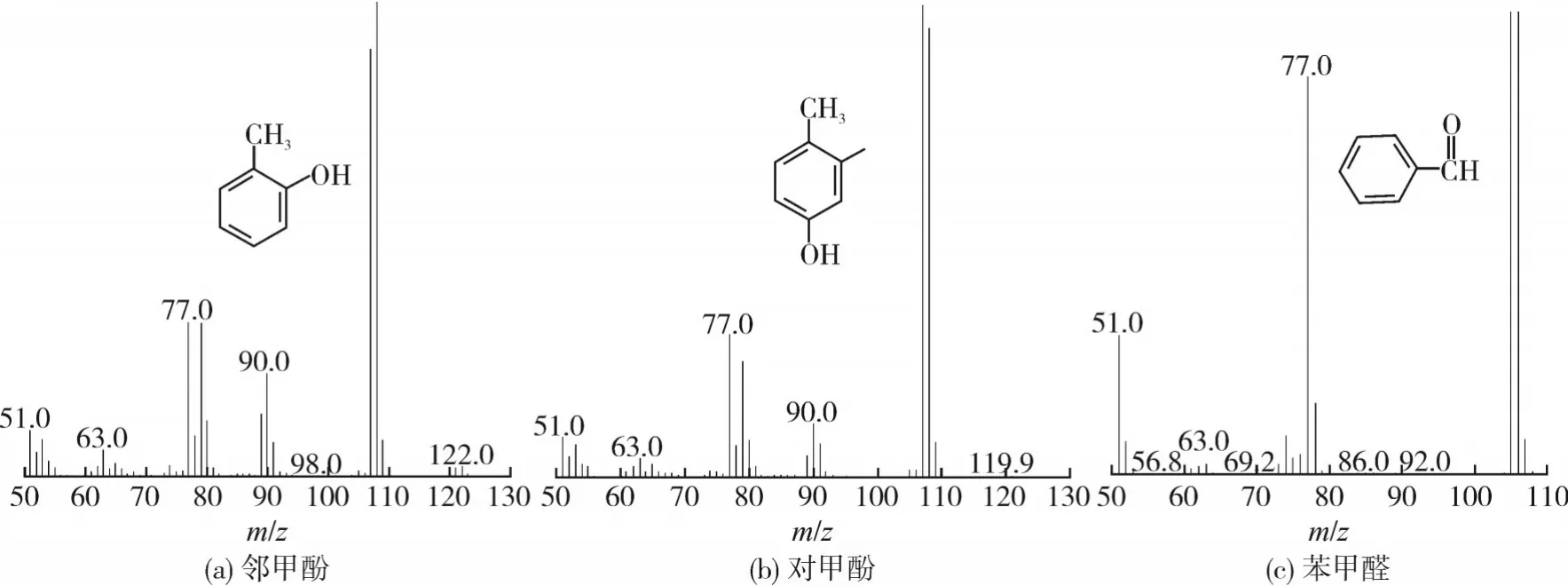
圖2 氧化產物的質譜圖
2.2 催化劑種類對氧化反應的影響
在n(H2O2)∶n(甲苯)=5∶1、m(催化劑):m(甲苯)=0.10∶1、乙腈為溶劑、反應溫度80 ℃、反應1.0 h 的條件下,考察不同催化劑對氧化反應的影響,結果如表1所示。
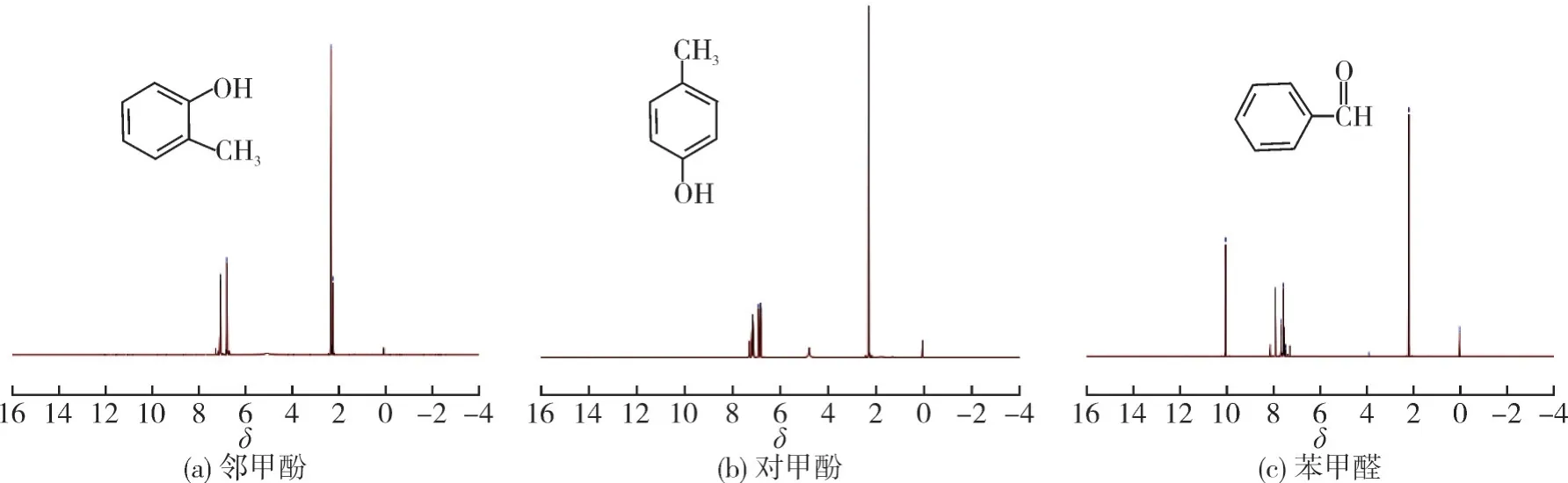
圖3 氧化產物的1 H NMR譜圖
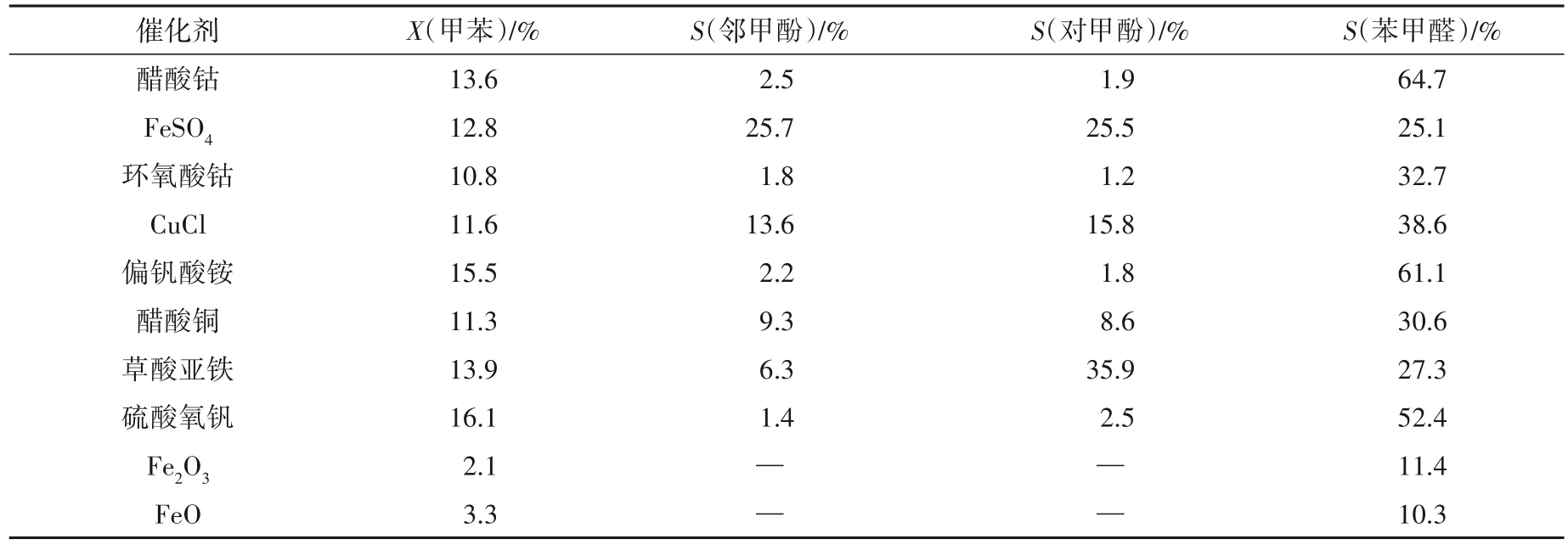
表1 不同催化劑對氧化反應的影響
由表 1 可知:以 Fe2O3和 FeO 為催化劑時,由于催化劑在溶劑乙腈和原料甲苯中溶解度較小,導致甲苯轉化率較低;以Co、V 和Cu 等金屬鹽為催化劑時,甲酚的選擇性小于苯甲醛的選擇性;以含Fe 硫酸鹽為催化劑時,H2O2溶液容易和Fe2+形成Feton 氧化體系,提高催化氧化能力,苯甲醛的選擇性小于甲酚的選擇性。實驗表明,過渡金屬鹽對氧化反應有一定的催化活性,芳環上側鏈容易發生自由基反應,大部分氧化產物為苯甲醛,當FeSO4為催化劑時,芳香環側鏈容易發生親電取代反應,甲酚的區域選擇性較高,酚/醛比高,此時甲苯轉化率為12.8%,鄰甲酚選擇性為25.7%,對甲酚選擇性為25.5%。
2.3 催化劑用量對氧化反應的影響
在n(H2O2)∶n(甲苯)=5∶1、FeSO4為催化劑、乙腈為溶劑、反應溫度80 ℃、反應1.0 h的條件下,考察催化劑用量對氧化反應的影響,結果如圖4所示。
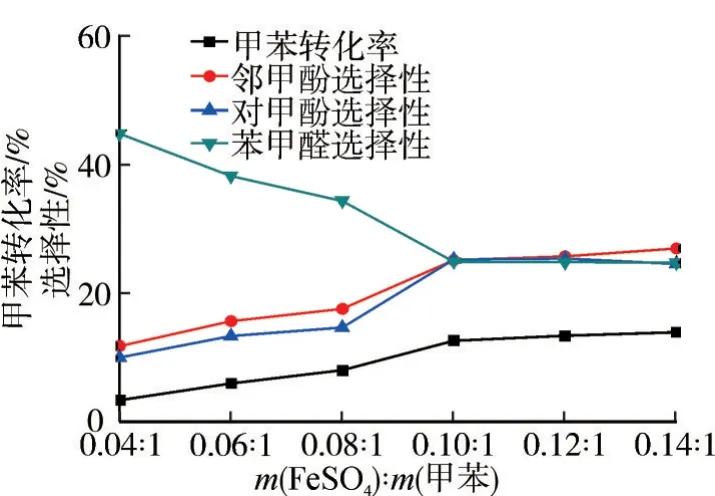
圖4 催化劑用量對氧化反應的影響
由圖4 可知:催化劑是H2O2直接氧化甲苯制備鄰/對甲酚的關鍵因素。從反應機制可知,由于過渡金屬離子促使H2O2釋放出·OH,進攻甲苯形成甲基環己二烯自由基,此中間體非常不穩定,在催化劑作用下生成目標產物。催化劑濃度越高,H2O2釋放的?OH越多,甲苯轉化率就越高;但是過渡金屬離子用量過高,會加快H2O2分解速率,導致氧化劑有效含量減少,不利于反應的進行。實驗表明,當m(FeSO4)∶m(甲苯)=0.10∶1時,反應效果較好,甲酚的選擇性小于苯甲醛的選擇性,此時甲苯的轉化率為12.6%,鄰甲酚選擇性為25.1%,對甲酚選擇性為25.2%。
2.4 溶劑對氧化反應的影響
在n(H2O2)∶n(甲苯)=5∶1、m(FeSO4)∶m(甲苯)=0.10∶1.0、反應溫度80 ℃、反應1.0 h 的條件下,考察不同溶劑對氧化反應的影響,結果如圖5所示。
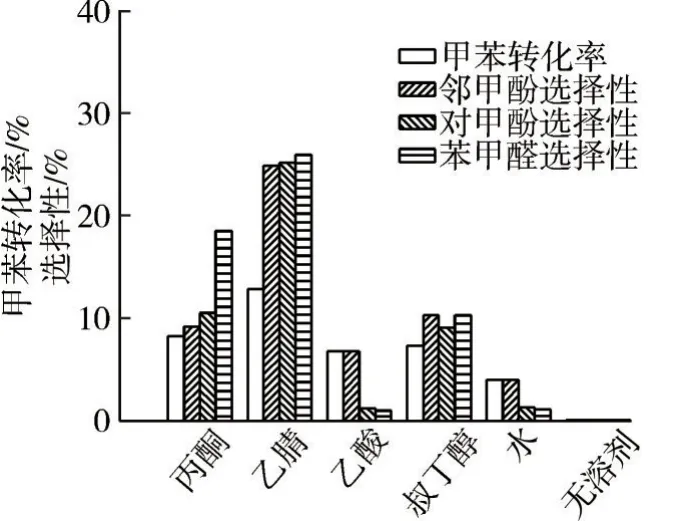
圖5 不同溶劑對氧化反應的影響
由圖5 可知:溶劑的極性對鄰/對甲酚和苯甲醛選擇性影響較大。以叔丁醇為溶劑時,苯甲醛的選擇性小于鄰甲酚的選擇性,甲苯轉化率低,這是由于叔丁醇-水-甲苯三者沸點相近,形成三元共沸,難以分離;以水為溶劑時,甲苯與水容易形成油水兩相,存在傳質障礙,原料和溶劑難以充分混合,催化劑分散性較差,致使甲苯轉化率較低;以丙酮為溶劑時,鄰/對甲酚的選擇性均小于苯甲醛的選擇性;以乙酸為溶劑時,對甲酚的選擇性和苯甲醛的選擇性均較低;但以乙腈為溶劑時,鄰/對甲酚的選擇性較其他溶劑的選擇性大,乙腈為非質子極性溶劑,對水相和有機相均有較好的溶解性,反應效率高。當芳環上側鏈發生自由基反應,溶劑乙腈能傳遞自由基,副反應概率增大,苯甲醛含量也增加顯著。以乙腈為溶劑時,甲苯轉化率為12.8%,鄰甲酚選擇性為24.8%,對甲酚選擇性為25.1%。
2.5 反應溫度對氧化反應的影響
在n(H2O2)∶n(甲苯)=5∶1、m(FeSO4)∶m(甲苯)=0.10∶1、乙腈為溶劑、反應1.0 h 的條件下,考察反應溫度對氧化反應的影響,結果如圖6 和7所示。
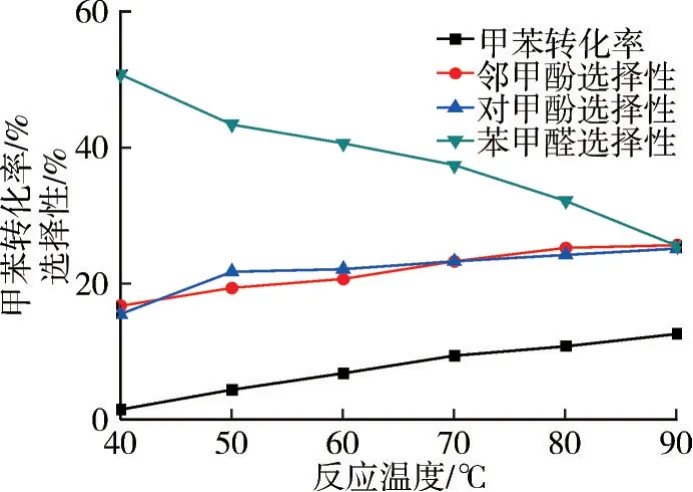
圖6 反應溫度對氧化反應的影響
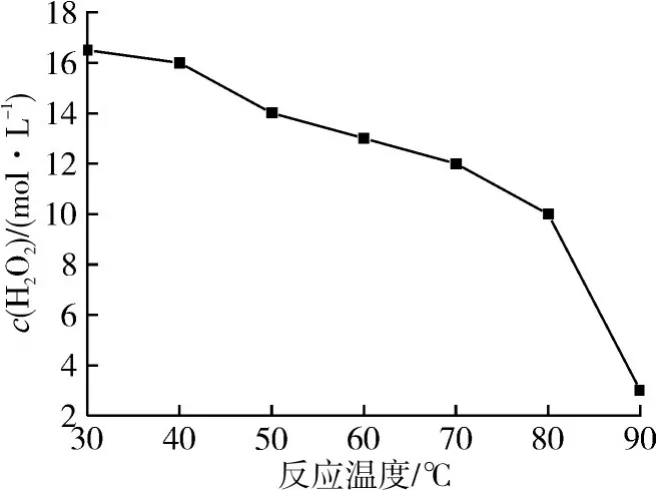
圖7 H2O2濃度隨溫度的變化
反應溫度是影響氧化反應的重要因素之一,溫度升高10 ℃,反應速率加快2~4 倍,即反應溫度越高,反應速率越快,轉化率越高。由圖6 和7 可知:當溫度較低時,甲苯轉化率低;當溫度較高時,反應物得到活化,強化了傳質,甲苯的轉化率明顯提高,鄰/對甲酚的選擇性也有一定的提高,苯甲醛選擇性反而降低;繼續升高溫度,體系中H2O2分解嚴重,氧化劑有效濃度大幅度衰減,氧化反應速率減慢,甲苯的轉化率和甲酚選擇性變化不明顯。實驗結果表明,當溫度為80 ℃時,反應效果較好,此時甲苯轉化率為12.6%,鄰甲酚選擇性為25.6%,對甲酚選擇性為25.1%。
2.6 氧化劑用量對氧化反應的影響
在m(FeSO4)∶m(甲苯)=0.10∶1、乙腈為溶劑、反應溫度80 ℃、反應1.0 h 的條件下,考察氧化劑用量對氧化反應的影響,結果如圖8所示。
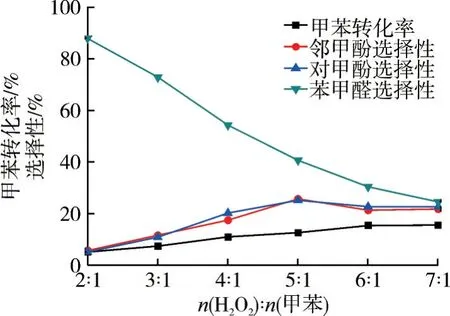
圖8 氧化劑用量對氧化反應的影響
H2O2直接氧化甲苯制備鄰/對甲酚反應,理論上來說,是一個原子利用率100%的反應,即甲苯和H2O2的摩爾比為1∶1,但是H2O2極易分解,實驗中H2O2常常需要過量。由圖8 可知:增加氧化劑用量,甲苯轉化率和鄰/對甲酚選擇性有所提高,隨著反應的進行,生成的苯甲醛、鄰/對甲酚活性高于甲苯,再增加氧化劑用量,會促進副反應的產生。實驗發現,苯環由于本身活化難度大,甲苯的氧化速率相對較慢,芳環上甲基先活化,生成苯甲醛以及鄰/對甲酚。實驗結果表明,n(H2O2)∶n(甲苯)=5∶1時,效果最佳,此時甲苯轉化率為12.6%、鄰甲酚選擇性為25.6%,對甲酚選擇性為25.1%。
2.7 H2O2質量分數對氧化反應的影響
在n(H2O2)∶n(甲苯)=5∶1、m(FeSO4)∶m(甲苯)=0.10∶1、乙腈為溶劑、反應溫度80 ℃、反應1.0 h 的條件下,考察H2O2質量分數對氧化反應的影響,結果如圖9所示。
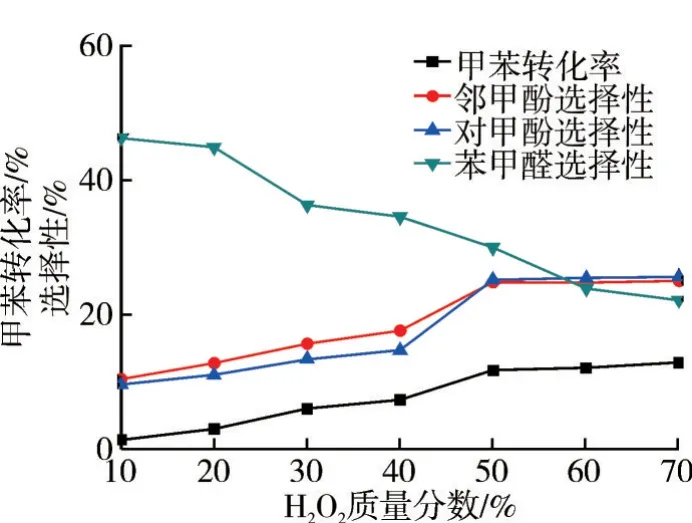
圖9 H2O2質量分數對氧化反應的影響
由圖9 可知:H2O2質量分數越大,甲苯的轉化率越高,鄰/對甲酚選擇性有明顯的提高。若使用低濃度H2O2,那么反應體系中含水量較大,由于甲苯與水不互溶,原料和氧化劑未能充分混合,傳質效果較差,導致甲苯轉化率低。實驗結果表明,高濃度氧化劑有利于氧化反應,但高濃度H2O2存在安全隱患,從安全性和氧化產物分布來看,實驗過程中需將H2O2配制成質量分數為50%的溶液,再進行氧化甲苯實驗。
2.8 反應時間對氧化反應的影響
在n(H2O2)∶n(甲苯)=5∶1、m(FeSO4)∶m(甲苯)=0.10∶1、乙腈為溶劑、反應溫度80 ℃的條件下,考察反應時間對氧化反應的影響,結果如圖10和11所示。
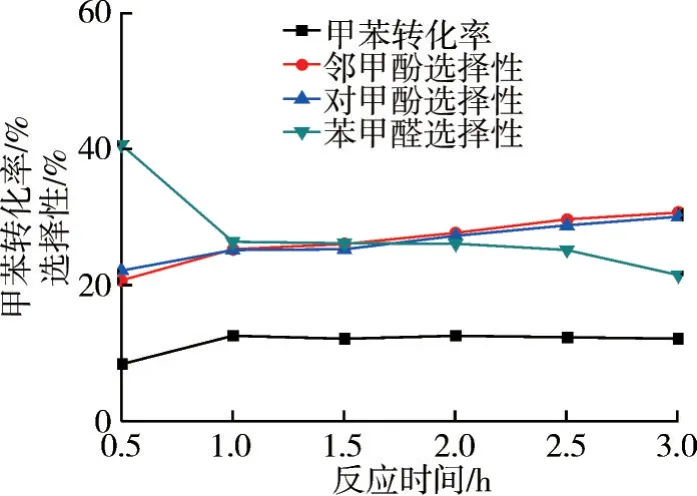
圖10 反應時間對氧化反應的影響
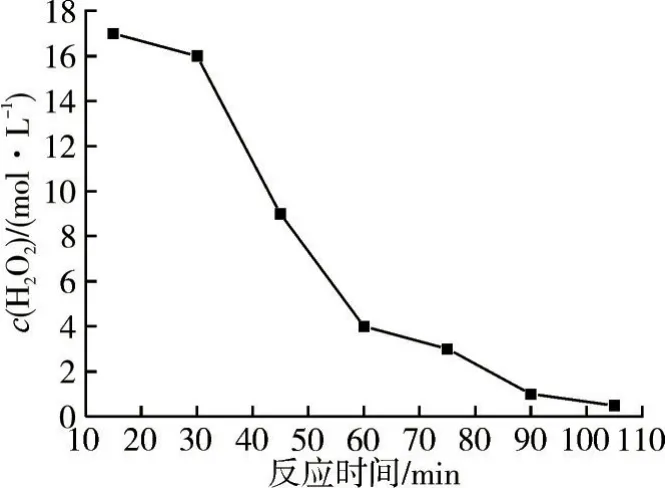
圖11 H2O2濃度隨時間的變化
由圖10 和11 可知:反應初期,反應時間對鄰/對甲酚選擇性的影響較大,H2O2滴加緩慢,會降低體系的溫度,且甲苯還處于活化階段;反應中后期,由于H2O2發生自身分解,此時反應體系中H2O2濃度快速減少,H2O2也因參與反應和分解幾乎消耗完全。因此,隨著反應時間的延長,甲苯轉化率以及甲酚收率趨于穩定。實驗結果表明,當反應時間為1.0 h 時,反應效果較好,此時甲苯轉化率為12.5%,鄰甲酚選擇性為25.2%,對甲酚選擇性為25.1%。
2.9 實驗重復性
在FeSO4為催化劑、乙腈為溶劑、H2O2質量分數50%,n(H2O2)∶n(甲苯)=5∶1、m(催化劑)∶m(甲苯)=0.10∶1、反應溫度80 ℃、反應1.0 h 的最優條件下,進行了5 次重復實驗,測得甲苯轉化率均約為12.6%、鄰甲酚選擇性均約為25.6%、對甲酚選擇性均約為25.1%。
重復實驗結果表明,在乙腈溶劑下,FeSO4過濾金屬鹽催化劑與H2O2形成的氧化體系,對甲苯羥甲基化反應中鄰/對甲酚選擇性起到很好的調控作用,有效地控制了酚/醛比,催化性能穩定。
3 結論
1)過渡金屬鹽及其氧化物與H2O2形成的Fe?ton氧化體系,對H2O2直接氧化甲苯羥甲基化反應中氧化產物的分布和區域選擇起到關鍵作用。
2)對H2O2液相氧化甲苯羥基化制備鄰/對甲酚提供了新的思路,但甲苯羥基化制備鄰/對甲酚產物中,側鏈氧化產物居多,鄰/對甲酚較少,且甲苯轉化率較低,苯環羥基化產物鄰/對甲酚選擇性不高,需進一步提高催化反應活性,增加甲苯轉化率,提高H2O2的利用率,優化反應分離耦合工藝。
3)以 FeSO4為催化劑、乙腈為溶劑,在H2O2與甲苯的物質的量之比為5、催化劑與甲苯質量比為0.10、反應溫度80 ℃、反應時間1.0 h條件下,甲苯轉化率達12.6%,鄰甲酚選擇性為25.6%,對甲酚選擇性為25.1%。

