雞巴氏桿菌病的診斷與防治
周時均,鄧珊珊,梅 偉,劉 芳
(清鎮市養殖業發展服務中心,貴州貴陽 551400)
巴氏桿菌屬于巴氏桿菌科、巴氏桿菌屬,是一種革蘭氏陰性球桿菌,有莢膜,不形成芽孢、無鞭毛,可引起包括雞、火雞、鴨、鵝等在內的禽類的一種出血性、敗血性傳染病,稱為禽巴氏桿菌病,又稱禽霍亂[1]。該菌是重要的畜禽病原菌,宿主范圍廣泛,致病性強,病型多樣[2]。禽類感染該菌具有較高的死亡率,并導致禽類生產性能低下,嚴重威脅養殖業的健康發展。
巴氏桿菌的血清型主要以莢膜抗原和脂多糖抗原來進行區分,根據莢膜抗原可分為A、B、D、E 和F 5 個血清型。常用的分型方法有血清學分型方法和分子分型方法。血清學方法是在傳統免疫學實驗技術的基礎上建立的,其缺點是操作過程復雜,耗時比較長,工作量大,對抗血清的特異性要求較高,不適合于臨床上進行大規模的流行病學調查。分子分型方法包括莢膜多重PCR 方法、脂多糖多重PCR 方法、多位點序列分型、全基因組測序和脈沖凝膠電泳。分子分型方法具有快速、簡單、靈敏等特點,其缺點是儀器設備比較昂貴,檢測費用相對較貴,技術難度大,在基層推廣難度比較大。在實際的檢測和分型過程中常常將傳統的血清學分型方法和分子分型方法相結合,兩種方法相互補充。
貴州省清鎮市某發病肉雞養殖戶肉雞存欄5000只,60 日齡時開始發病死亡,病雞臨床癥狀表現為精神萎靡,采食量下降、消瘦,兩翅下垂,呼吸不暢,鼻腔有黏液等。剖檢病雞可見肝臟有灰白色壞死點,腎臟腫大,肌胃出血,腺胃乳頭出血,十二指腸彌漫性出血等病變。初步懷疑為禽霍亂,為進一步確診該肉雞養殖場肉雞異常死亡的病因,采用肝臟組織觸片鏡檢、細菌分離培養、生化試驗、PCR 檢測、藥敏試驗等實驗室診斷方法,為后期防控提供參考。
1 材料和方法
1.1 病料
選擇患病雞3 只,無菌采集心臟、肝臟、脾臟、腎臟、腦組織病料。
1.2 主要試劑和培養基
2×TaqPCR MasterMix、DNA Marker DL2000、細菌基因組提取試劑盒,購自天根生化科技有限公司;禽流感病毒通用型實時熒光定量PCR 檢測試劑盒、新城疫病毒通用型實時熒光定量PCR 檢測試劑盒,購自北京森康生物技術開發有限公司;試驗所用的抗菌藥敏紙片,購自杭州微生物試劑有限公司,試驗所用的鮮血瓊脂平板由實驗室自行制備。
1.3 細菌分離培養
采集病死雞肝臟組織進行觸片,火焰固定后瑞氏染色,光學顯微鏡下油鏡觀察細菌形態。
分別無菌接種3 只受檢雞的脾臟、肝臟組織于新鮮血瓊脂平板,置于37℃恒溫培養24h 后觀察菌落生長情況。菌落純化后進行革蘭氏染色,光學顯微鏡下油鏡觀察細菌形態。
1.4 細菌鑒定
1.4.1 細菌生化試驗
按照巴氏桿菌生化鑒定圖譜選擇微量生化鑒定管,取分離菌純培養物,接種于微量生化鑒定管,37℃恒溫培養24~48h,觀察并參照對照手冊判定反應結果。
1.4.2 細菌PCR 檢測
挑取適量的細菌純培養物,參照細菌基因組提取試劑盒說明書提取細菌總DNA。根據針對多殺性巴氏桿菌KMT 基因,應用引物KMT1/KMT2 進行PCR鑒定,引物序列為:上游引物KMT1:5′-ATCCGCTATTTACCCAGTGG-3′;下游引物KMT2:5′-GCTGTAAACGAACTCGCCAC-3′,預期擴增片段大小為457bp。采用25μL 反應體系進行PCR 擴增,擴增程序為95℃預變性3min,然后進入95℃變性45s、60℃退火45s 和72℃延伸45s 的35 次循環,最后72℃再延伸10min。擴增產物進行電泳檢測,觀察是否有特異性目的條帶。
1.5 細菌藥敏試驗
藥敏試驗采用藥敏紙片瓊脂擴散法,參照美國臨床實驗室標準化協會(Clinical and Laboratory Standards Institute,CLSI)制定的標準進行,藥敏結果判斷標準按NCCLS2010 年標準,作出結果判斷。
1.6 相關病毒核酸檢測
分別取3 只病死雞的心臟、肝臟、脾臟、腎臟、腦組織病料各1g 于滅菌研缽中加入生理鹽水1mL 快速研磨勻漿后轉入1.5mL 無菌離心管中8000r/min 離心2min,分別移取上清液100μL 于另1 支1.5mL 無菌離心管中按照DNA/RNA 提取試劑盒說明書方法提取樣品的總核酸,-20℃保存備用。分別對提取的核酸進行禽流感、新城疫病毒熒光定量PCR 核酸檢測,具體操作步驟按照試劑盒說明書。
2 結果
2.1 細菌分離培養及形態
鮮血瓊脂平板生長出表面光滑濕潤、邊緣整齊、半透明、灰白色呈露滴狀菌落,見圖1。感染動物肝臟組織觸片瑞氏染色可見兩極濃染的短小桿菌,呈藍色,見圖2。挑取單個菌落進行純培養,經革蘭氏染色,鏡檢顯示分離菌為革蘭氏陰性短小桿菌,呈單個存在或成雙排列,見圖3。
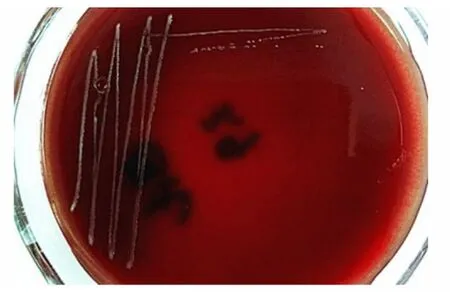
圖1 細菌分離培養
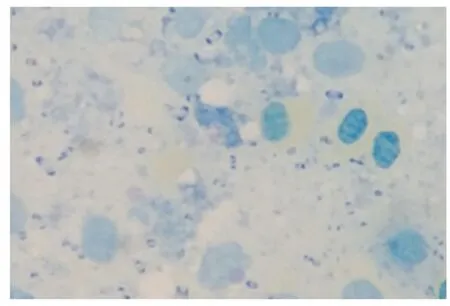
圖2 瑞氏染色結果

圖3 革蘭氏染色結果
2.2 細菌鑒定結果
2.2.1 細菌生化鑒定結果
生化鑒定結果顯示,該分離菌能發酵葡萄糖、蔗糖和甘露醇,不發酵乳糖和麥芽糖,硫化氫、氧化酶和吲哚等試驗均為陽性,苯丙氨酸、硝酸鹽還原、鳥氨酸脫羧酶和賴氨酸試驗等均為陰性,符合巴氏桿菌生化特征。結合細菌形態觀察和生化鑒定結果可初步判定該分離菌為巴氏桿菌。
2.2.2 細菌PCR 檢測結果
取PCR 擴增產物8μL,于1.2%瓊脂糖凝膠上進行電泳,凝膠成像系統觀察,結果顯示巴氏桿菌陽性對照和分離菌樣本在457bp 處均出現特異性條帶,結果見圖4,可得該次分離得到的細菌為雞巴氏桿菌。
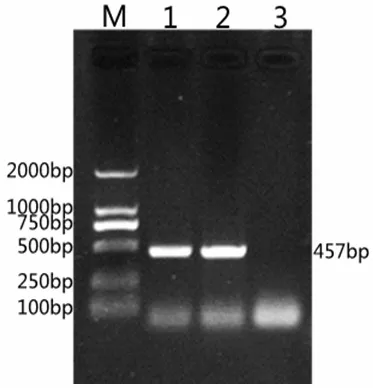
圖4 分離菌PCR 擴增結果
2.3 細菌藥敏試驗
選取分離得到的巴氏桿菌分離株進行藥敏試驗,結果為分離菌對四環素、多西環素、頭孢拉定、諾氟沙星等抗菌藥物呈現良好的敏感性,對氨芐西林、青霉素等藥物耐藥。
2.4 相關病毒檢測結果
分別對提取的核酸進行禽流感、新城疫病毒熒光定量PCR 核酸檢測,檢測均無明顯的擴增曲線且無CT 值,說明各組織樣品不存在禽流感病毒和新城疫病毒感染。
3 診斷結論
采用過肝臟組織觸片鏡檢、細菌分離培養、生化試驗、PCR 檢測、藥敏試驗等實驗室診斷方法,確診該肉雞養殖場雞異常死亡的病因為雞巴氏桿菌感染。藥敏試驗發現,分離菌對四環素、多西環素、頭孢拉定、諾氟沙星等抗菌藥物呈現良好的敏感性。
4 小結
巴氏桿菌實驗室診斷的方法有病原學檢測、血清學方法和現代分子生物學技術。病原學檢測包括傳統的細菌分離培養、生化試驗、瓊脂擴散試驗等。血清學診斷方法主要是ELISA 方法。現代分子生物學技術包括普通PCR 方法、熒光定量PCR 方法、多重PCR方法、環介導等溫擴增技術、基因芯片等。在臨床診斷過程中常將細菌分離培養和PCR 技術相結合,更準確、更快速地進行病例確診。
巴氏桿菌不同血清型之間無交叉免疫保護[3],這給疫苗免疫預防帶來了困難。在臨床上主要采用抗生素藥物進行治療,但是由于大量抗生素藥物的濫用,造成不同程度的耐藥。因此選擇合適的敏感藥物,對治療和預防雞巴氏桿菌病至關重要。巴氏桿菌為條件性致病菌,當動物機體抵抗力下降時常引起發病[4],因此加強飼養管理對預防巴氏桿菌至關重要。
清鎮市屬于亞熱帶季風濕潤性氣候,全年空氣濕度較大,光照條件較差,降雨較多,容易引起細菌滋生。在飼養家禽的過程當中,要科學配比投喂飼料,保證營養攝入。加強環境衛生清潔,及時清掃雞舍環境糞便,保持環境通風、干燥、清潔。注意防止飼料霉變,雞群還要注意保暖,較少應激。提高雞群抵抗力,按照全進全出的養殖模式。制定嚴格的生物安全防護措施,定期開展清洗和消毒,尤其是墻面、地面、進出入車輛以及槽具,應進行徹底的消毒,同時注意交替使用消毒藥物,避免產生耐藥性。定期對常發疾病進行監測,及時預警預報,淘汰隱性感染雞群。在飼料中適量添加預防性藥物,及時殺滅有害病菌。針對病禽要及時做好隔離治療,病死禽及時進行無害化處理。雞群做好高致病性禽流感和新城疫等疫病的免疫工作,加強免疫抗體監測,做好免疫評估。

