MUC19突變對派姆單抗治療老年非小細胞肺癌的臨床療效及對預后的影響
劉華 蔣詳德 張華鵬 程剛 楊培 陳方
(亳州市人民醫院腫瘤科,安徽 亳州 236800)
隨著社會發展及醫療技術手段進步,肺癌檢出率逐年升高,且發病年齡日趨年輕化,而非小細胞肺癌(NSCLC)是最為常見的類型之一,但絕大部分患由于錯過最佳治療時機往往預后不佳,化療及分子靶向治療雖然能延長患者生命,但均存在一定局限性〔1,2〕。目前程序性死亡受體1(PD-1)/程序性死亡配體1(PD-L1)改變了NSCLC患者治療模式,也顯著改善患者預后〔3〕,但研究僅有部分患者對免疫檢查點抑制劑(ICB)產生應答,因此需針對肺癌患者探索評估療效的標志物,從而篩選出對于ICB產生應答的患者提高療效進而改善預后的關鍵〔4〕。腫瘤突變負荷(TMB)作為免疫治療的療效預測標志物是目前研究的前沿,有研究表明TMB表達水平與腫瘤對ICB應答有效率呈正相關關系〔5〕。黏蛋白(MUC)19作為編碼大分子量糖化蛋白,可構成有效的物理屏障以保護上皮細胞,使其不受應激誘導的損傷。MUC19可廣泛在角膜和結膜等處進行高表達,同時在肺、骨髓等組織中也有相應表達〔6〕。相關研究證實干燥綜合征和乳腺癌的發病和MUC19異常表達關系密切,其中乳腺癌患者預后差的指標之一即為MUC19基因突變〔7〕,先前研究也通過全外顯子測序對生物信息學分析及篩選潛在突變,結果發現MUC19突變與NSCLC發生顯著相關〔8〕,但肺癌患者預后與MUC19突變間的關聯性還有待進一步研究。本研究旨在探討MUC19突變對PD-1抑制劑派姆單抗治療NSCLC的臨床療效及對預后的影響。
1 對象和方法
1.1研究對象 選擇2018年3月至2019年12月于亳州市人民醫院住院治療的36例MUC19突變老年NSCLC患者。納入標準:(1)術后病理結果診斷為NSCLC,且證實存在MUC19基因敏感突變;(2)預計生存期≥12個月;(3)免疫治療前可接受放化療治療,包括術后放療或化療,但第1次免疫治療前2 w需停止放化療治療;(4)年齡≥65歲。排除標準:(1)合并其他類型腫瘤;(2)合并嚴重感染和免疫系統疾病;(3)肝、腎及其他嚴重疾病者;(4)既往予以免疫藥物治療。同時選取同期在醫院住院治療的38例MUC19 基因野生型(MUC19基因未突變) NSCLC患者為對照組。采用蝎形探針擴增阻滯突變系統測定癌組織MUC19基因突變情況,檢查結果顯示觀察組均為MUC19基因12染色體上外顯子點突變。本研究經醫院倫理委員會批準通過。兩組一般資料差異無統計學意義(P>0.05),見表1。

表1 兩組基線數據(n)
1.2干預方法 研究對象入院后完善相關檢查,排除禁忌后予以 PD-1抑制劑派姆單抗2 mg/kg靜脈滴注,2 w為1個周期,治療6個周期,共計12 w。
1.3評估指標 6個周期治療結束后按照世界衛生組織(WHO)實體瘤療效標準,分為完全緩解(CR)、不完全緩解(PR)、疾病穩定(SD)和疾病進展(PD)共4個等級。其中CR指腫瘤病灶完全消失,且維持時間>4 w;PR為腫瘤病灶體積縮小>50%,且維持時間>4 w;SD為NSCLC病灶縮小25%~50%;PD為NSCLC病灶增大超過25%或發現轉移。總有效率=CR+PR。所有患者出院后通過門診至少隨訪12個月,比較兩組治療前及治療12個月時血清腫瘤標志物〔癌胚抗原(CEA)、糖類抗原(CA)125與神經元特異性烯醇化酶(NSE)〕水平。觀察并比較兩組腫瘤無進展生存期(PFS)及總生存期(OS)。在治療過程中記錄兩組不良反應,包括惡心嘔吐、過敏反應、皮疹、肝腎功能異常和凝血功能異常。
1.4腫瘤組織CD8+T細胞浸潤 術后腫瘤組織均經4%甲醛固定,用石蠟包埋后連續組織切片(厚4 μm),后續應用 C單克隆抗CD8抗體進行免疫組織化學染色,嚴格按照說明書進行操作。 其中膜染色的淋巴細胞被認為是CD8陽性。 所有免疫組化切片由兩名病理學家獨立評估并記錄CD8+細胞數,其中每個免疫組化切片選擇4~6個視野進行統計。
1.5統計學分析 采用SPSS22.0統計軟件進行t檢驗、χ2檢驗。
2 結 果
2.1兩組治療后療效及生存指標比較 觀察組總有效率(83.33%,CR 10例、PR 20例、SD 2例、PD 4例)明顯高于對照組(57.89%,CR 6例、PR 16例、SD 10例、PD 6例;χ2=5.726,P=0.017);觀察組PFS及OS〔(18.20±1.32)、(30.26±5.62)個月〕明顯長于對照組〔(13.22±1.10)、(22.55±4.89)個月〕,差異有統計學意義(t=5.22、12.22,P=0.015、<0.001)。
2.2兩組治療前后血清CEA、CA125與NSE水平比較 治療前兩組CEA、CA125與NSE水平差異無統計學意義(P>0.05),治療后兩組均明顯降低(P<0.05),且觀察組明顯低于對照組(P<0.001),見表2。
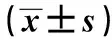
表2 兩組治療前后血清CEA、CA125與NSE水平比較
2.3兩組不良反應發生率比較 觀察組不良反應總發生率(13.89%,過敏反應2例、惡心嘔吐1例、皮疹1例、肝腎功能異常1例)與對照組(15.79%,過敏反應3例、惡心嘔吐2例、肝腎功能異常1例)差異無統計學意義(χ2=0.053,P=0.818)。
2.4兩組腫瘤組織CD8+T細胞浸潤結果 與觀察組〔(26.32±3.10)HPF〕相比,對照組腫瘤組織CD8+T細胞數目〔(42.11±2.68)/HPF〕明顯更多(P<0.05),見圖1。

圖1 兩組腫瘤組織中CD8T細胞浸潤(免疫熒光,×200)
3 討 論
NSCLC的發病率逐年增高,嚴重影響患者的身心健康,且由于NSCLC早期癥狀不典型,超過50%的患者就診時已錯過手術時間窗,因此NSCLC 5年生存率相對較低〔9~12〕。化療在疾病早期能取得一定療效,但長期用藥會產生耐藥,遠期來看并不能顯著延長患者的生存周期〔13,14〕。免疫療法為NSCLC的治療提供了新方式,但研究指出只有部分患者能夠從免疫療法中獲益〔15~17〕。此外,免疫療法合并有一定的免疫毒性,且治療成本較高〔18〕,因此通過特定的生物標志物對患者進行療效評估很有必要。
實際上PD-1是表達在T細胞表面的跨膜蛋白,通過與配體PD-L1結合,發揮負向調控作用。在腫瘤組織的微環境中,腫瘤細胞表面通過表達PD-L1與PD-1結合,可有效抑制TCR傳導信號通路中轉導分子的磷酸化,進而抑制其通路下游信號的激活及炎性細胞的激活和炎性因子的表達,因此用抑制PD-1信號通路可改善機體的免疫反應,增強免疫能力〔19〕。也有研究指出高腫瘤突變負荷且PD-L1陽性的腫瘤組織對免疫治療的應答率明顯高于其他類型腫瘤組織〔20〕,與本研究結果基本一致。雖然目前研究普遍認為腫瘤組織PD-L1的表達是抗PD-1/PD-L1治療前選擇優勢人群比較合理的標志物,但由于腫瘤異質性及標志物表達水平的動態變化等因素導致PD-L1的應用受到限制〔21〕。而MUC19基因突變作為腫瘤突變負荷的一部分,研究指出腫瘤突變負荷越大,機體的免疫原性增強,進而使得腫瘤特異性T 細胞能夠對新抗原進行識別并最終產生免疫應答〔22〕,而腫瘤突變負荷可作為免疫療效預測標志物之一,包括膀胱癌、肝癌及消化道腫瘤等惡性癌癥對PD-1 抑制劑的有效率與腫瘤突變負荷的表達呈明顯正相關〔22~25〕。本研究結果也發現,采用PD-1抑制劑派姆單抗MUC19突變的NSCLC患者不僅總有效率較高,治療結束后腫瘤標志物水平明顯降低,且PFS及OS均明顯長于MUC19 基因野生型患者。說明MUC19 基因突變與其他分子之間存在一定關聯,但其中的機制尚未闡明,需要大樣本量的基因分析進一步研究。但也有研究指出應用免疫治療聯合化療在治療鱗狀和非鱗狀NSCLC患者中發現,其療效與腫瘤突變無明顯相關性〔26,27〕。雖然本研究結果發現不論是MUC19 基因野生型患者還是MUC19突變老年NSCLC患者,兩組隨訪過程中的不良反應發生率無明顯統計學差異,但因免疫治療帶來的免疫相關不良反應及藥物的毒副作用仍有報道〔28,29〕。也有研究指出PD-1/PD-L1 抑制劑甚至會引發免疫相關的肝炎、肺部感染、皮膚過敏反應及內分泌代謝功能障礙等并發癥等〔30,31〕。免疫治療的禁忌證包括合并自身免疫性疾病及高齡體弱者等〔32〕,這是因為PD-1抗體通過發揮免疫調控作用,可有效激活免疫系統發揮抗癌作用,但其本身對腫瘤細胞無明顯殺傷作用〔33~35〕,因此對于MUC19突變NSCLC患者予以免疫治療時,需綜合評估患者基本身體情況及病史,將風險降到最低。本研究也存在一些局限性,樣本量相對較小,且均為老年患者,也需要多中心、大樣本的研究進一步驗證MUC19基因突變對PD-1抑制劑在NSCLC患者治療中的臨床效果。實際上人體對腫瘤疾病的免疫應答十分復雜且機制尚未完全明確〔36,37〕,僅依靠 MUC19基因突變預測PD-1抑制劑對NSCLC患者治療可靠性有待商榷,需要與腫瘤突變負荷聯合共同評估。
綜上,MUC19突變可改善派姆單抗治療老年NSCLC患者的臨床效果,還可延長生存時間。

