基于TLR4/TAK1/NF-κB途徑探討MCAO大鼠缺血局部腦皮質微血管新生的內在機制
張春玲 梁超 王寶愛 徐玉婷
(海口市中醫醫院,海南 海口 570216)
腦血管疾病在中老年人中較常見,且因其高發病率、高致殘率和高死亡率,給人類的健康帶來了嚴重的威脅〔1〕。局灶性腦缺血發生后,其損害程度取決于血管細胞、神經元和膠質細胞之間活躍而復雜的相互作用〔2〕。腦缺血引起的腦微血管內皮細胞(BMECs)損傷是導致血腦屏障破壞的主要原因〔3〕。Toll樣受體(TLRs)廣泛表達于天然免疫細胞,在早期天然免疫中起著重要作用,其中TLR4被激活后可活化核因子(NF)-κB,進而誘導和調控炎癥反應〔4〕。在大腦中動脈栓塞(MCAO)小鼠模型中TLR4表達水平升高,此外,缺乏TLR4的小鼠神經功能缺陷明顯減少〔5〕。轉化生長因子(TGF)-β激活激酶(TAK)1是一種MAP3激酶,位于與腦缺血損傷有關的幾種途徑的上游〔6〕。TAK1可被TGF-β、白細胞介素(IL)-1β、腫瘤壞死因子(TNF)-α等缺血性損傷后分泌的細胞因子激活,而 TAK1的激活反過來又會誘導促炎細胞因子和趨化因子的產生,并激活已知在腦缺血病理中起有害作用的免疫細胞,從而參與腦缺血的發病進程〔7〕。也有研究表明,TLR4與腫瘤壞死因子受體相關因子(TRAF)6結合并促進其活化,活化的TRAF6可與TAK1及其TGF-β活化激酶結合蛋白(TAB)1相互作用促使TAK1活化,TAK1被激活后可解除NF-κB的抑制,而NF-κB被活化后可導致炎癥因子的廣泛表達,從而減輕或加重炎癥反應造成的腦缺血損傷〔8,9〕。但TLR4/TAK1/NF-κB途徑是否與MCAO大鼠缺血局部腦皮質微血管新生相關尚不清楚。本研究旨在基于TLR4/TAK1/NF-κB途徑探討MCAO大鼠缺血局部腦皮質微血管新生的內在機制。
1 材料與方法
1.1實驗動物 40只成年SPF級健康雄性SD大鼠,體重(230±10)g,由珠海百試通生物科技有限公司提供,在溫度20~25℃,濕度40%~60%的條件下分籠飼養。
1.2試劑 siRNA-TLR4 純化腺病毒和陰性對照病毒均購自上海吉凱基因生物技術有限公司;Ki67、血管內皮生長因子(VEGF)、促血管生成素(Ang)-1、Ang-2抗體購自美國Abcam公司;TLR4、TGF、TAK1、NF-κB p65和β-actin鼠單克隆抗體購自美國eBioscience公司。
1.3儀器 熒光顯微鏡(日本NIKON公司,型號 Eclipse 80i);病理切片機(美國賽默飛公司,型號Thermo HM);包埋機(武漢俊杰電子有限公司,型號JB-P5);PCR儀(美國Bio-Rad公司,型號CFX96 Touch)。
1.4動物分組及造模 40只雄性SD大鼠,適應性喂養1 w,按隨機數字表法分為4組,其中10只為假手術(Sham)組,另30只采用線栓法建立MCAO大鼠模型,并將其分為模型(Model)組、陰性病毒(NC)組和siRNA-TLR4轉染(siRNA-TLR4)組,具體造模方法如下:所有大鼠于術前禁食12 h,仰臥位固定,采用3.5%異氟烷進行麻醉,分離并暴露一側頸總動脈、頸外動脈及頸內動脈,結扎頸外動脈,并夾閉右側頸總動脈,在頸總動脈遠端處剪3 mm小口,將0.28 mm的尼龍線從小口處穿入至大腦中動脈,固定線栓,結扎并剪去線栓尾端,縫合切口并消毒。Sham組僅分離血管不插入線栓進行造模。
1.5給藥劑量 造模后1 h,Sham組與Model組均給予尾靜脈注射等量生理鹽水,NC組給予尾靜脈注射陰性對照病毒5×109PFU,siRNA-TLR4組給予尾靜脈注射siRNA-TLR4腺病毒5×109PFU,所有大鼠術后正常喂養48 h后進行后續實驗。
1.6蘇木素-伊紅(HE)染色法觀察缺血局部腦皮質病理變化 各組大鼠于術后48 h,麻醉斷頭處死后,迅速取出腦組織,用冷生理鹽水清洗腦組織并除去腦組織表面殘余的水分,取部分腦組織用4%多聚甲醛溶液固定24 h,脫水并用石蠟包埋,按照步驟處理切片,用HE染色法觀察大鼠缺血局部腦皮質病理變化。
1.7氯化三苯基四氮唑染色(TTC)檢測大鼠腦梗死面積 各組大鼠處死后取腦組織,并制作冠狀腦片,嚴格按照TTC試劑盒說明書進行染色,分析并計算各組大鼠腦梗死面積。
1.8TUNEL染色檢測大鼠缺血局部腦皮質細胞凋亡情況 對各組大鼠的石蠟切片進行脫蠟和水化,用0.01 mol/L檸檬酸緩沖液(pH6.0)處理切片,參照TUNEL試劑盒說明書進行染色,顯微鏡下觀察并計算腦皮質細胞凋亡率。
1.9免疫熒光染色檢測微血管內皮細胞數目 石蠟切片脫蠟脫水,用蒸餾水浸泡2 min,微波爐內對抗原進行熱修復。10%正常山羊血清封閉,室溫孵育30 min,以減少非特異性染色。滴加1∶200濃度的Ki67一抗4℃過夜,滴加異硫氰酸熒光素(FITC)標記山羊抗兔IgG熒光抗體37℃染色30 min。4,6-聯脒-2-苯基吲哚(DAPI)復染細胞核,緩沖甘油封固后鏡檢。其中每一步均需PBS漂洗,5 min/次,共3次。
1.10免疫組化法檢測VEGF、Ang-1和Ang-2表達水平 石蠟切片脫蠟后,置于3% H2O2中室溫孵育10 min,微波爐內對抗原進行熱修復。切片冷卻至室溫后,用磷酸鹽緩沖液(PBS)沖洗5 min×3次。10%正常山羊血清封閉,室溫孵育10 min,滴加1∶100濃度的VEGF、Ang-1和Ang-2一抗4℃過夜,PBS沖洗5 min×3次。滴加適量生物素標記二抗,室溫孵育1 h,PBS沖洗5 min×3次。滴加適量辣根酶標記的鏈霉卵白素工作液,37℃孵育10 min,PBS沖洗5 min×3次。滴加二氨基聯苯胺(DAB)顯色劑顯色15 min,自來水充分沖洗、復染、脫水、透明、封片,熒光顯微鏡下觀察并記錄。
1.11反轉錄-聚合酶鏈式反應(RT-PCR)檢測TLR4、TAK1、NF-κB p65 mRNA表達 取部分腦組織放入去酶EP管中,用超純 RNA 提取試劑盒按產品說明書進行實驗操作,提取組織樣本中總 RNA,按照逆轉錄試劑盒說明書進行逆轉錄反應。反應條件:95℃,45 s,95℃,15 s,60℃,60 s,共進行45個循環。每組進行3次獨立測定,采用 2-ΔΔCt法對數據進行分析。RT-PCR引物序列:β-actin正向:5′-CTTGTGCAGTGCCAGCC-3′,反向:5′-GCCCAATACGGC CAAATCC-3′;TLR4正向:5′-AATCTGGTGGCTGTGGAGAC-3′,反向:5′-GCTTGGGCTTGAATGGAGT-3′;TAK1正向:5′-CAAAGCTAAGTGGAGAGCAAAAGA-3′,反向:5′-GATAACTGCCGAAGCTCTACAATAA-3′;NF-κB p65正向:5′-TGTGATGAAAGACGGCAC-AC-3′,反向:5′-CTTCTTCTTTCGGGTATTGTTTGG-3′。
1.12Western印跡檢測TLR4、TAK1和NF-κB p65蛋白表達 取部分腦組織在研缽中充分研磨,加入裂解液置冰上充分裂解,4℃下離心30 min,吸取上清;采用二喹啉甲酸(BCA)試劑盒測量蛋白質含量,確定每孔上樣蛋白量相等。取少量蛋白質配制成上樣緩沖液,電泳、轉膜、封閉,加入一抗TLR4、TAK1、NF-κB p65和β-actin,4℃過夜;TBST洗滌,加辣根過氧化物酶標記的二抗,室溫輕搖1 h,TBST充分洗滌,用 ECL 化學發光試劑顯色后,化學發光儀成像。
1.13統計學方法 采用SPSS21.0軟件進行方差分析、t檢驗。
2 結 果
2.1各組缺血局部腦皮質病理變化 Sham組細胞質分布均勻,核膜完整,核仁清晰,神經元排列整齊,且形態完整;Model組和NC毒組可觀察到大量不規則的細胞和空泡,細胞核固縮和遷移,胞質和細胞核模糊不清;siRNA-TLR4組缺血半影區細胞形態比模型組和陰性病毒組規則,且腦組織損傷程度降低。見圖1。

圖1 各組缺血局部腦皮質病理變化(HE染色,×400)
2.2各組腦梗死面積比較 與Sham組相比,Model組、NC組和siRNA-TLR4組腦梗死面積明顯增大(P<0.01);與Model組相比,siRNA-TLR4組腦梗死面積明顯減小(P<0.01)。見表1。
2.3各組腦皮質細胞凋亡情況 與Sham組相比,Model組、NC組和siRNA-TLR4組腦皮質細胞凋亡率明顯升高(P<0.05);與Model組相比,siRNA-TLR4組腦皮質細胞凋亡率明顯降低(P<0.05)。見表1、圖2。

圖2 各組腦皮質細胞凋亡情況(TUNEL染色,×400)
2.4各組BMECs增殖數目比較 與Sham組相比,Model組、NC組和siRNA-TLR4組BMECs明顯增加(P<0.05);與Model組比較,siRNA-TLR4組BMECs明顯增加(P<0.05)。見表1、圖3。
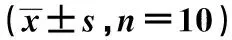
表1 各組腦梗死面積和腦皮質細胞凋亡情況、BMECs增殖和腦組織VEGF、Ang-1和Ang-2表達

圖3 各組腦皮質微血管內皮細胞增殖數目(免疫熒光染色,×200)
2.5各組腦組織VEGF、Ang-1和Ang-2表達比較 與Sham組相比,Model組、NC組和siRNA-TLR4組VEGF、Ang-1和Ang-2表達水平明顯升高(P<0.05);與Model組相比,siRNA-TLR4組VEGF、Ang-1和Ang-2表達水平明顯升高(P<0.05)。見表1。
2.6各組腦組織TLR4、TAK1、NF-κB p65 mRNA表達 與Sham組相比,Model組、NC組和siRNA-TLR4組TLR4、TAK1、NF-κB p65 mRNA及蛋白表達水平明顯升高(P<0.05);與Model組相比,siRNA-TLR4組TLR4、TAK1、NF-κB p65 mRNA及蛋白表達水平明顯降低(P<0.05)。見表2、圖4、表3。
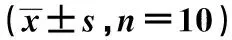
表2 各組腦組織TLR4、TAK1、NF-κB p65 mRNA表達比較

圖4 各組腦組織TLR4、TAK1、NF-κB p65 蛋白表達
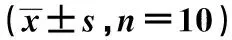
表3 各組腦組織TLR4、TAK1、NF-κB p65蛋白表達比較
3 討 論
腦缺血又稱為缺血性腦卒中,占腦卒中的80%以上,且腦缺血是全球死亡率和發病率的主要原因〔10〕。腦血管阻塞導致腦缺血、缺氧,并對大腦造成一系列的病理損害,且腦缺血生理過程通常被認為是一個多環節、多通道的快速級聯反應〔11〕。腦缺血可引起神經細胞的水腫、變形、凋亡及壞死等,而該病理過程與炎癥反應密切相關,腦組織炎癥因子的產生不僅可引起腦膠質細胞的增生,也可參與缺血局部腦皮質微血管新生,且缺血區微血管新生程度對腦缺血患者的神經功能恢復具有重要作用〔12,13〕。血管新生是指血管內皮細胞發生分裂、分化和增殖形成新的毛細血管網的過程〔14〕。據報道,微血管新生和腦缺血后再灌注血流可通過保護血腦屏障改善腦組織能量代謝障礙,促進腦缺血后神經祖細胞的分化、增殖及神經元再生,從而改善腦缺血患者神經功能、認知功能、語言功能及運動功能等〔15〕。
TLRs介導炎性腦缺血損傷,而TLR4是一種在神經細胞中表達的膜蛋白受體,主要負責炎癥反應〔16〕。多項研究表明,TLR4參與腦缺血損傷的病理過程〔17〕。本研究結果顯示,siRNA-TLR4轉染組缺血半影區細胞形態比模型組和陰性病毒組規則,且腦組織損傷程度降低。此外,沉默TLR4表達后,MCAO大鼠腦梗死面積及腦皮質細胞凋亡率明顯降低。BMECs是腦組織微血管的組成單元,其損傷程度決定了缺血局部腦皮質微血管新生的可能性〔18〕,本研究結果表明,沉默TLR4表達可促使微血管內皮細胞增殖。VEGF和Ang是血管新生的兩種相關因子,VEGF可通過促進血管內皮細胞增殖,加速新生血管的形成〔19〕;Ang具有誘導血管生成的作用,其中Ang-1能促使血管成熟,Ang-2能促使血管出芽及生長,VEGF、Ang-1和Ang-2三者相互協調共同促進血管新生〔20〕。本研究結果表明沉默TLR4表達可通過上調VEGF、Ang-1和Ang-2水平促進微血管新生。腦缺血后抑制TLR4表達,可進一步抑制TAK1和NF-κB活化,從而抑制炎癥反應對腦缺血后的繼發性損傷。
綜上,TLR4/TAK1/NF-κB途徑通過增加缺血局部腦皮質新生血管形成,從而改善腦缺血對腦組織的損傷。

