miR-21-3p靶向RNF-11基因對脊索瘤細胞生物學行為的影響
劉俊 尹銳 李艷兵
(湖北省恩施土家族苗族自治州中心醫院脊柱外科診療中心,湖北 恩施 445000)
脊索瘤是一種罕見的原發性骨腫瘤,起源于胚胎殘余的脊索組織,占所有骨惡性腫瘤的1%~4%〔1〕。盡管脊索瘤被認為是較低級別的惡性腫瘤,但其復發率很高,并且可轉移到附近的組織〔2〕。目前治療脊索瘤最有效的方法是外科手術切除,然而,由于其解剖學位置,通常不可能進行完整的整塊切除,且患者在手術后很容易復發〔3〕。因此,迫切需要探索脊索瘤患者的新型治療靶標。微小RNA(miRNA)是一類高度保守的小型非編碼RNA,其長度為17~25個核苷酸,可通過部分互補結合靶基因的3′非翻譯區(3′UTR)抑制其翻譯或促進靶基因的降解。miRNA的表達失調在各種癌癥(包括脊索瘤)中作為癌基因或抑癌基因參與腫瘤的發生和發展〔4,5〕。miRNA作為一種新的、非侵入性的生物標志物,可以在腫瘤的診斷及治療方面提供重要指導。目前研究顯示,miR-21-3p在卵巢癌、喉癌,乳腺癌等多種腫瘤患者中的表達異常升高,促進癌癥的進展〔6~8〕。Chen等〔9〕通過微陣列分析脊索瘤中差異表達的miRNA,結果發現miR-21-3p在脊索瘤中呈上調表達,然而miR-21-3p在脊索瘤中的作用及機制尚不清楚。本實驗探究miR-21-3p對脊索瘤細胞增殖、凋亡、侵襲和遷移等生物學行為的影響及可能的機制,以期為脊索瘤的診治提供新的生物標志物。
1 材料與方法
1.1標本 脊索瘤和配對癌旁正常組織標本采集于恩施土家族苗族自治州中心醫院,標本從經手術切除脊索瘤的患者中獲得,脊索瘤標本均經病理科審核確認。入組患者在手術切除腫瘤病灶之前均未接受任何化學療法或放射療法。在參加本研究之前,每位患者都簽署了書面知情同意書。本研究得到恩施土家族苗族自治州中心醫院倫理委員會的批準。
1.2主要試劑 脊索瘤細胞系U-CH1從美國菌種保藏中心獲得;IMDM-RPMI培養基、青霉素-鏈霉素雙抗從美國Gibco公司獲得;胰蛋白酶、胎牛血清(FBS)、Lipofectamine 2000轉染試劑從美國Invitrogen公司獲得;MTT試劑、二甲基亞砜(DMSO)從美國Sigma公司獲得;miR-21-3p mimics、mimics NC、miR-21-3p inhibitors、inhibitors NC均從廣州市銳博生物科技有限公司獲得;Transwell細胞培養小室、基質膠從美國Corning公司獲得;Trizol試劑、逆轉錄試劑盒、SYBR Green PCR Master Mix檢測試劑盒從日本TaKaRa公司獲得;RIPA裂解液、BCA蛋白濃度檢測試劑盒、電化學發光(ECL)檢測試劑盒、結晶紫染色液從碧云天生物技術研究所獲得;雙熒光素酶報告基因檢測試劑盒從美國Promega公司獲得;RNF-11、上皮型鈣黏蛋白(E-cadherin)、神經型鈣黏蛋白(N-cadherin)、波形蛋白(Vimentin)抗體從美國Abcam公司獲得;辣根過氧化物酶標記的IgG從北京中杉金橋生物技術有限公司獲得;膜聯蛋白(Annexin)Ⅴ-異硫氰酸熒光素(FITC)/碘化丙啶(PI)細胞凋亡檢測試劑盒從美國BD公司獲得;RNF-11野生型(RNF-11-Wt)和RNF-11突變型(RNF-11-Mut)熒光素酶重組載體質粒上海生工生物工程有限公司獲得。
1.3脊索瘤U-CH1細胞的培養和傳代 脊索瘤U-CH1細胞復蘇后接種到含10% FBS、1%青霉素-鏈霉素雙抗、IMDM-RPMI培養基的培養瓶中,放置在恒溫培養箱中進行培養,培養條件設置為:37℃、5%CO2、100%飽和濕度。在顯微鏡下觀察U-CH1細胞生長情況,待懸浮細胞充滿整個視野時,使用0.25%胰蛋白酶消化細胞,收集細胞1 000 r/min離心5 min,棄上清培養液,使用磷酸鹽緩沖液(PBS)洗滌1次,分裝后加入新鮮含10% FBS、1%青霉素-鏈霉素雙抗的IMDM-RPMI培養液繼續傳代培養。
1.4細胞轉染和分組 處于對數生長期的U-CH1細胞以胰蛋白酶消化,收集細胞制成濃度為5×106/ml的細胞懸液,將細胞懸液種植到6孔板中,每孔接種200 μl,放置到細胞培養箱培養過夜,待細胞生長至60%匯合時,參照轉染試劑Lipofectamine 2000使用說明書將miR-21-3p mimics或mimics NC轉染至U-CH1細胞,按照轉染說明在轉染6 h后將原培養液更換成含血清的培養液,放置在細胞培養箱繼續培養48 h,收集細胞進行后續實驗檢測。其中轉染miR-21-3p mimics的U-CH1細胞命名為anti-miR-21-3p組,轉染mimics NC的U-CH1細胞命名為anti-NC組,未行轉染的U-CH1細胞命名為Blank組。
1.5qRT-PCR實驗 將待測組織標本研磨成粉末,收集待測U-CH1細胞,分別向組織和細胞中加入Trizol試劑,抽提總RNA,使用微量核酸檢測儀測定RNA的純度和濃度,選擇合格的RNA進行逆轉錄,具體步驟參照逆轉錄試劑盒使用說明書進行操作。合成的cDNA檢測其濃度,調整cDNA的濃度并將其作為模板,使用SYBR Green PCR Master Mix檢測試劑盒進行擴增,miR-21-3p的相對表達量以U6為內參,RNF-11、E-cadherin、N-cadherin和Vimentin的相對表達量以GAPDH為內參。反應結束后以2-ΔΔCt法計算基因相對表達量。引物:RNF-11正義鏈:5′-ACATCTCCCTGCTTCACGAG-3′,反義鏈:5′-GGGTGGTAGACTGGAACTGG-3′;E-cadherin正義鏈:5′-TCCATTTCTTGGTCTACGCC-3′,反義鏈:5′-CACCTTCAGCCATCCTGTTT-3′;N-cadherin正義鏈:5′-GTGCCATTAGCCAAGGGAATTCAGC-3′,反義鏈:5′-GCGTTCCTGTTCCACTCATAGGAGG-3′;Vimentin正義鏈:5′-GGCTCGTCACCTTCGTGAAT-3′,反義鏈:5′-TCAATGTCAAGGGCCATCTTAA-3′;U6正義鏈:5′-CTCGCTTCGGCAGCACA-3′,反義鏈:5′-AACGCTTCACGAATTTGCGT-3′;GAPDH正義鏈:5′-ACCCACTCCTCCACCTTTGA-3′,反義鏈:5′-CTGTTGCTGTAGCCAAATTCGT-3′。
1.6MTT實驗 用胰蛋白酶消化處于對數生長期的脊索瘤U-CH1細胞,將細胞接種到96孔板中,待細胞貼壁后按照上述1.4的方法轉染和分組,轉染48 h后分別向各孔細胞中添加濃度為5 mg/ml的MTT溶液20 μl,放置在細胞培養箱中孵育4 h,取出細胞培養板,棄去上清液,再向細胞中加入150 μl DMSO,于震蕩儀上振蕩10 min,待結晶沉淀完全溶解后,在全自動酶聯免疫檢測儀上分析各孔細胞的光密度(OD)值,以不加細胞只加培養液的對照孔進行調零。
1.7克隆形成實驗 3組脊索瘤U-CH1細胞轉染48 h后,收集細胞以新鮮培養液重懸細胞,制成單細胞懸液,計數后接種到60 mm的細胞培養皿中,將細胞培養皿放置在37℃培養箱,培養14 d后除去培養液,用PBS洗滌細胞,加入1 ml甲醇固定15 min,流水下洗去甲醇,再加入1 ml Gimsa染液染色30 min,流水洗去染液,使用顯微鏡觀察并計數大于50個的細胞克隆。
1.8流式細胞術 3組U-CH1細胞轉染48 h后,以預冷的PBS洗滌細胞2次,收集細胞約1×105個,向細胞中加入100 μl結合緩沖液重懸細胞,依次向細胞懸液中添加AnnexinⅤ-FITC和PI染液各5 μl,放置在室溫下避光孵育15 min,在1 h內上流式細胞儀檢測,檢測結果使用CELL Quest軟件分析細胞凋亡情況。
1.9Transwell實驗 收集轉染后的U-CH1細胞,用不含血清的培養液重懸細胞制成3×104/ml的單細胞懸液,再以基質膠包被的Transwell小室的上室中加入細胞懸液200 μl,在下室加入含血清的培養液600 μl,將小室放置在37℃培養箱常規培養48 h,取出小室,用棉簽擦去上室未穿膜的細胞,以甲醛固定,隨后以結晶紫染色,放置在顯微鏡下隨機選5個視野觀察并統計侵襲細胞數。
1.10劃痕實驗 轉染后的3組U-CH1細胞生長至單層匯合時進行劃痕實驗,即使用滅菌的200 μl移液槍槍頭垂直于細胞培養板劃線,被劃下的細胞用PBS洗去,加入不含血清的培養液,放置在37℃培養箱繼續培養,在培養0 h和48 h時分別用顯微鏡觀察細胞劃痕寬度,計算細胞遷移率,細胞遷移率(%)=(0 h劃痕寬度-48 h劃痕寬度)/0 h劃痕寬度×100%。
1.11Western印跡實驗 收集轉染48 h的3組U-CH1細胞,加入適量RIPA裂解液在冰上提取總蛋白,蛋白樣品采用BCA法進行定量,在蛋白中加入上樣緩沖液,沸水浴致蛋白變性,取40 μg蛋白樣品加樣,經十二烷基硫酸鈉-聚丙烯酰胺凝膠電泳(SDS-PAGE)分離蛋白,隨后電轉至聚偏氟乙烯(PVDF)膜上,PVDF膜浸潤在含5%脫脂奶粉的封閉液中,室溫孵育2 h,取出膜并用TBST漂洗3次,加入相應一抗,其中RNF-11一抗1∶800稀釋,E-cadherin一抗1∶500稀釋,N-cadherin一抗1∶500稀釋,Vimentin一抗1∶500稀釋,4℃過夜孵育,取出膜并用TBST漂洗3次,加入稀釋的二抗,室溫孵育2 h,以ECL顯色,采用凝膠成像系統獲取圖像,以GAPDH標定,用Imag J軟件分析各組U-CH1細胞中目的蛋白相對表達水平。
1.12雙熒光素酶報告基因實驗 將RNF-11-Wt和RNF-11-Mut熒光素酶重組載體質粒分別與miR-21-3p mimics和或mimics NC共轉染至U-CH1細胞,放置在37℃培養箱常規培養48 h,收集細胞,參照雙熒光素酶報告基因檢測試劑盒使用說明書對細胞進行檢測,獲得螢火蟲熒光素酶活性和海腎熒光素酶活性,以二者比值表示細胞的相對熒光素酶活性。
1.13統計學分析 采用SPSS21.0軟件進行t檢驗、單因素方差分析、SNK-q檢驗。
2 結 果
2.1miR-21-3p在脊索瘤組織中表達上調 與癌旁組織相比,脊索瘤組織中miR-21-3p表達明顯上調(1.00±0.09 vs 3.61±0.34,P<0.05)。
2.2轉染miR-21-3p inhibitors對U-CH1細胞中miR-21-3p表達的影響 與Blank組相比,anti-miR-21-3p組U-CH1細胞中miR-21-3p的表達量明顯降低(P<0.05),anti-NC組miR-21-3p的表達量變化差異不顯著(P>0.05),見表1。
2.3抑制miR-21-3p對U-CH1細胞增殖能力的影響 與Blank組相比,anti-miR-21-3p組U-CH1細胞OD值明顯下降(P<0.05),克隆形成數明顯減少(P<0.05),anti-NC組細胞OD值和克隆形成數變化差異均不顯著(P>0.05),見表1、圖1。
表1 各組U-CH1細胞OD值、克隆形成數、miR-21-3p表達量、凋亡率、侵襲細胞數、遷移率比較

圖1 克隆形成實驗檢測各組U-CH1細胞克隆形成能力(Gimsa染色,×200)
2.4抑制miR-21-3p對U-CH1細胞凋亡能力的影響 與Blank組相比,anti-miR-21-3p組U-CH1細胞凋亡率明顯升高(P<0.05),anti-NC組細胞凋亡率差異不顯著(P>0.05),見表1、圖2。
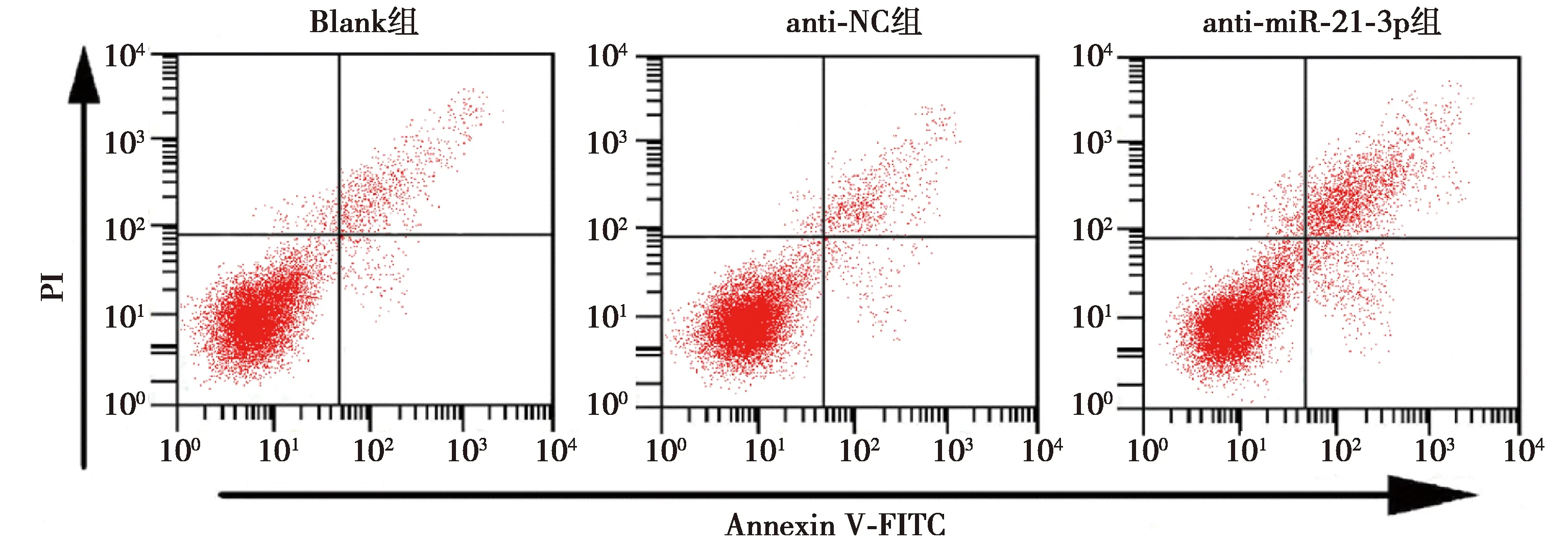
圖2 流式細胞術檢測各組U-CH1細胞凋亡情況
2.5抑制miR-21-3p對U-CH1細胞侵襲和遷移能力的影響 與Blank組相比,anti-miR-21-3p組侵襲細胞數明顯減少(P<0.05),細胞遷移率明顯降低(P<0.05),而anti-NC組侵襲細胞數和細胞遷移率差異均不顯著(P>0.05),見表1、圖3。
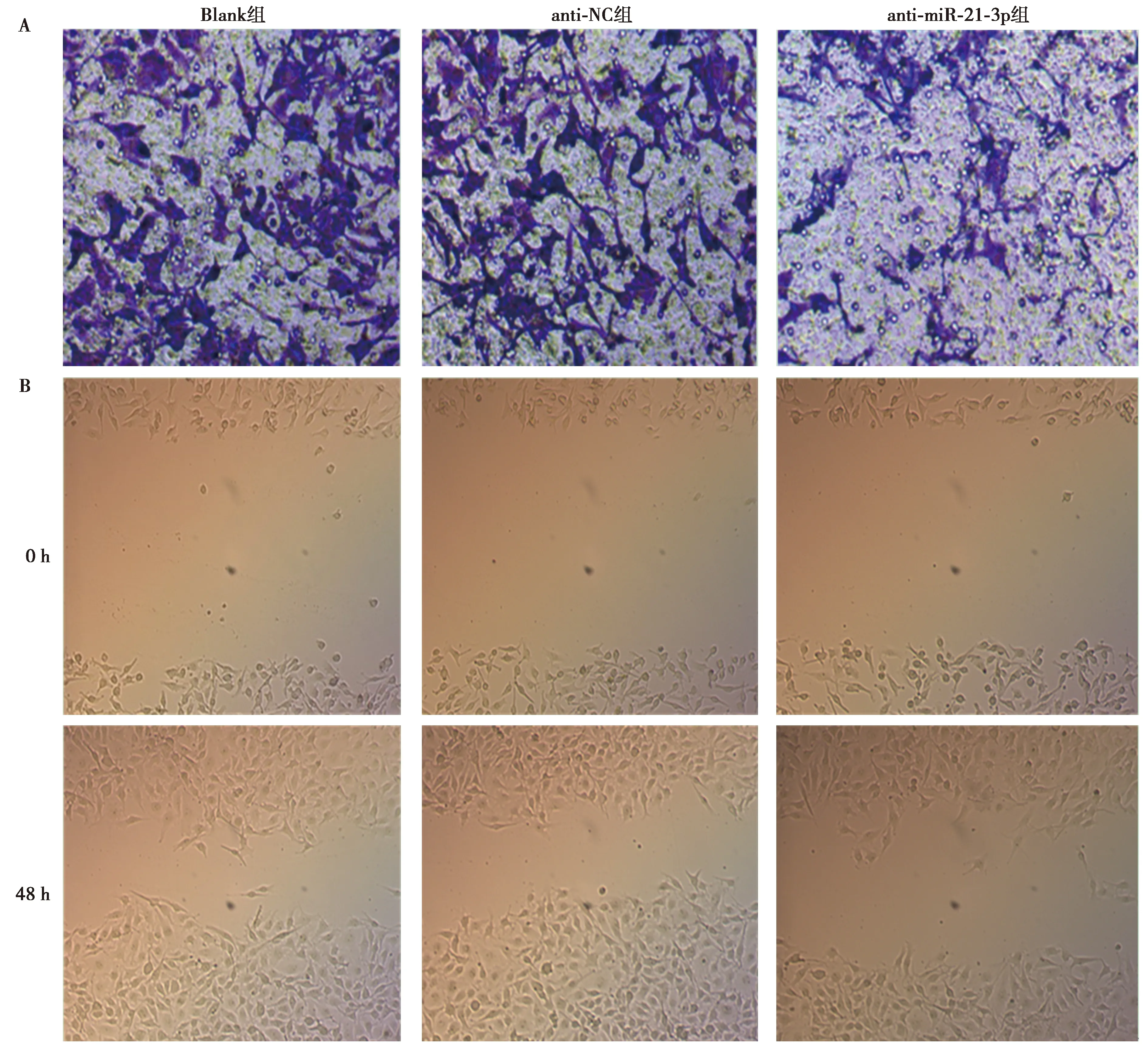
A:Transwell實驗檢測3組U-CH1細胞侵襲能力(結晶紫染色,×200);B:劃痕實驗檢測3組U-CH1細胞遷移能力(×200)圖3 3組U-CH1細胞侵襲和遷移能力比較
2.6抑制miR-21-3p對U-CH1細胞上皮間質轉化(EMT)能力的影響 與Blank組相比,anti-miR-21-3p組U-CH1細胞中E-cadherin mRNA和蛋白表達水平顯著升高(P<0.05),而N-cadherin、Vimentin mRNA和蛋白表達水平顯著降低(P<0.05),anti-NC組E-cadherin、N-cadherin和Vimentin的表達差異均不顯著(P>0.05),見表2、圖4。
表2 各組U-CH1細胞E-cadherin、N-cadherin和Vimentin mRNA及蛋白表達比較
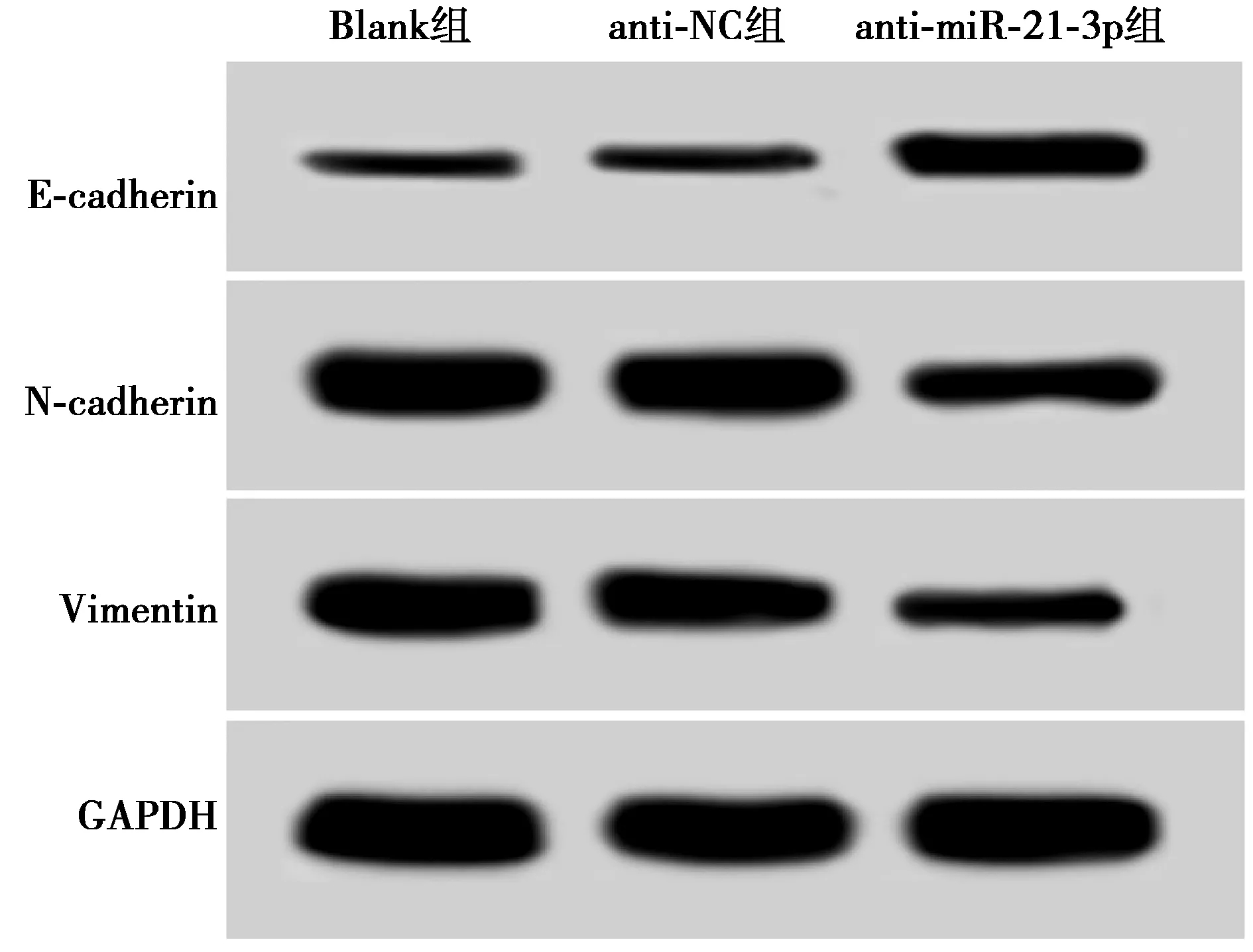
圖4 Western印跡檢測E-cadherin、N-cadherin和Vimentin蛋白表達
2.7miR-21-3p靶向RNF-11關系的驗證 采用TargetScan軟件預測miR-21-3p的靶基因,結果顯示,RNF-11的3′UTR中存在與miR-21-3p互補的序列(圖5)。雙熒光素酶報告基因實驗結果顯示,相較于miR-NC組過表達miR-21-3p后在轉染RNF-11-Wt的U-CH1細胞相對熒光素酶活性明顯降低(1.00±0.03 vs 0.41±0.07,P<0.05),而轉染RNF-11-Mut的U-CH1細胞相對熒光素酶活性變化不明顯(1.00±0.07 vs 0.97±0.08,P>0.05)。與Blank組相比,anti-miR-21-3p組U-CH1細胞中RNF-11 mRNA和蛋白表達明顯升高(P<0.05),anti-NC組中RNF-11 mRNA和蛋白的表達差異均不顯著(P>0.05),見圖6、表3。

圖5 生物信息學軟件TargetScan預測miR-21-3p與RNF-11的靶向結合位點
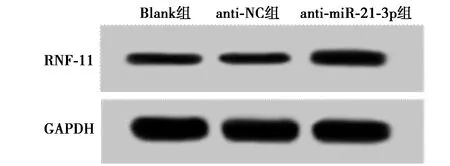
圖6 Western印跡檢測RNF-11蛋白表達
表3 各組U-CH1細胞中RNF-11 mRNA和蛋白表達量比較
3 討 論
脊索瘤早期無明顯的臨床癥狀,晚期往往會破壞周圍的骨骼侵犯鄰近的組織。研究顯示,在許多致癌過程中,miRNA已成為關鍵調控因子〔10,11〕。已經確定了許多miRNA與幾種類型的人類癌癥的發生和發展有關〔12,13〕。目前證據表明,異常表達的miRNA在脊索瘤的發展中起著至關重要的作用。例如,Osaka等〔14〕研究發現,miR-1可靶向調控Slug的表達抑制脊索瘤細胞增殖,而且還能夠抑制細胞遷移和侵襲活性。Ma等〔15〕實驗發現,miRNA-124負調控iASPP的表達,進一步導致凋亡相關蛋白的變化,并影響脊索瘤細胞增殖,侵襲和對順鉑的敏感性。有研究顯示,miR-16-5p通過靶向Smad3抑制脊索瘤細胞增殖、侵襲和轉移,在脊索瘤進展中起著抑癌作用〔16〕。Chen等〔9〕進行了miRNA陣列分析以篩選脊索瘤樣品中差異表達的miRNA,發現脊索瘤組織中miR-21-3p的表達明顯上調,這意味著miR-21-3p可能起促癌作用。本研究首次證明了miR-21-3p靶向RNF-11在脊索瘤中的促癌作用。
本實驗結果發現,miR-21-3p在脊索瘤組織中的表達顯著升高,這與Chen等〔9〕的研究相符。為探究miR-21-3p對脊索瘤細胞生物學行為的影響,本實驗通過在脊索瘤U-CH1細胞中轉染抑制miR-21-3p的表達,實驗結果顯示,抑制miR-21-3p的表達能夠抑制U-CH1細胞增殖,誘導細胞凋亡。腫瘤遷移和侵襲能力對于脊索瘤等癌癥的初始轉移過程至關重要〔17〕。因此抑制遷移和侵襲能力可能會減少脊索瘤常見的局部復發,從而提高生存率。研究指出,EMT是促進腫瘤細胞侵襲和轉移的主要機制之一〔18,19〕。當EMT發生時,上皮細胞表面標志物E-cadherin的表達下調,同時間充質細胞表面標志物N-cadherin和Vimentin的表達上調。本實驗結果顯示,miR-21-3p表達的抑制減少了脊索瘤細胞的遷移和侵襲,這由E-cadherin的表達升高和N-cadherin和Vimentin的表達降低所揭示。本實驗證實RNF-11是miR-21-3p的直接靶標,并且miR-21-3p在轉錄后水平上直接調節RNF-11的表達。RNF-11基因屬于 RING finger 基因家族成員之一,王季〔20〕利用基因芯片技術探究與脊索瘤發病相關的基因,發現RNF-11在脊索瘤組織中表達顯著下調,提示RNF-11在脊索瘤中可能發揮抑癌基因的作用。以上實驗結果提示,miR-21-3p靶向調控RNF-11影響脊索瘤細胞增殖、凋亡、侵襲和遷移等生物學行為。
綜上所述,miR-21-3p在脊索瘤組織中呈高表達,下調miR-21-3p的表達能夠抑制脊索瘤細胞增殖、侵襲和遷移能力,并誘導細胞凋亡,其可能的作用機制與靶向調控RNF-11的表達有關。miR-21-3p在脊索瘤發展中具有促癌作用,這可能為脊索瘤的治療提供有希望的預后和治療策略。

