基于TCGA構建口腔鱗癌自噬相關基因風險預測模型及驗證
王錦航,彭士雄,趙建廣,陳彥平,崔子峰
口腔鱗狀細胞癌(oral squamous cell carcinoma,OSCC)約占頭頸癌的90%[1]。目前臨床中多應用腫瘤分期或組織學分級等指標來評估OSCC患者的預后,存在導致部分低危患者接受過度治療的可能或導致部分高危患者因治療不足而面臨復發和轉移的風險,造成患者的預后差異較大[2],可見,臨床上仍需挖掘OSCC中潛在的生物標志物用于評估患者的預后。
自噬是維持內穩態的關鍵,然而研究中逐漸發現自噬也可有助于腫瘤的發生或發展,如可使癌細胞發生免疫逃逸從而導致細胞的增殖[3-4]。目前已有學者嘗試通過自噬相關機制為OSCC尋找新的治療策略,但研究主要集中于自噬相關基因(autophagy related gene,ARG)在OSCC發展或治療中的作用,缺乏通過大數據來篩選和鑒定ARG中可用于預測OSCC患者預后的生物標志物。本研究將癌癥基因組圖譜(the cancer genome atlas,TCGA)數據庫中OSCC相關ARG表達數據與臨床病理特征及預后數據相結合,探究ARG風險預測模型在OSCC預后中潛在的臨床應用價值,報道如下。
1 資料與方法
1.1 數據獲取與處理 本研究應用R軟件行數據處理和統計分析。從TCGA數據庫中共獲取501例OSCC樣本和44例癌旁樣本的RNA-seq數據。在OSCC樣本中498例具有完整的預后數據,432例具有完整的性別、年齡、腫瘤分化程度、腫瘤分期和T分期數據。通過Ensembl提供的“Homo_sapiens.GRCh38.104.chr.gtf.gz”文件行基因名稱注釋。
1.2 差異表達ARG的篩選 從HADb數據庫中獲取人ARG基因共232個,limma包以FDR<0.05和|logFC|>1為條件篩選出RNA-seq數據中差異表達的ARG。ClusterProfiler、Org.Hs.eg.db、Enrichplot和Ggplot2包行基因本體論(gene ontology,GO)和京都基因與基因組百科全書(Kyoto encyclopedia of genes and genomes,KEGG)富集分析,以p.adjust和qvalue均<0.05為條件發現差異表達ARG的主要生物學特征。
1.3 預后相關差異表達ARG的篩選 結合OSCC中差異表達ARG和預后數據,Survival包行單因素Cox分析后將P<0.05的數據進一步應用Glmnet包納入Lasso回歸分析,以達到簡化模型參數的目的。后再次通過Survival包對以上結果行多因素Cox分析篩選出預后相關的差異表達ARG。
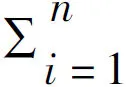
1.5 Western-blot驗證模型中基因在OSCC中的表達 因既往研究尚未闡明模型中BAK1在OSCC中的表達情況,故應用Western-blot檢測BAK1蛋白在OSCC中的表達。收集2021年7月—2022年1月河北醫科大學第四醫院口腔頜面外科行手術治療的OSCC患者17例的癌組織及相應癌旁組織樣本(距腫瘤邊緣>2.0 cm),且術后病理證實為OSCC和正常組織。所有患者術前均未接受任何腫瘤相關治療。本研究已通過醫院倫理委員會審批(2020KY283),患者及家屬均知情同意并簽署知情同意書。
RIPA裂解液(碧云天公司)提取組織蛋白,BCA蛋白濃度測定試劑盒(碧云天公司)測定蛋白濃度。10% SDS-PAGE分離蛋白,將蛋白電轉至PVDF膜。用含5% 脫脂奶粉的封閉液浸泡PVDF膜,室溫搖床封閉2 h。PVDF膜浸泡于一抗(BAK1,1∶2 000;β-actin,1∶5 000,Affinity公司)孵育液中,4℃ 孵育過夜。洗去多余一抗,PVDF膜浸泡于HRP標記二抗(1∶50 000,武漢博士德生物工程有限公司)孵育液中,37℃搖床孵育2 h。洗去多余二抗,顯色曝光。使用BandScan分析膠片灰度值,根據目標蛋白和內參條帶的灰度值之比計算相對表達量。結果應用Graph Prism軟件行t檢驗分析,以P<0.05為差異具有統計學意義。
2 結 果
2.1 OSCC中差異表達ARG的篩選 在RNA-seq數據中篩選出EIF4EBP1、BAK1、RGS19、HIF1A、CTSL、VMP1、SPNS1、TNFSF10、TP63、BID、VEGFA、SPHK1、EGFR、SERPINA1、DDIT3、EIF2AK2、ITGB4、ITGA3、APOL1、IRGM、BIRC5、FADD、ITGA6、IFNG、NRG1、IL24、CDKN2A等27個上調ARG和NRG2、NRG3、MAP1LC3C、PRKN、HSPB8、CCL2、FOS、TP53INP2、PTK6、NKX2-3等10個下調ARG(FDR<0.05,|logFC|>1)(圖1A、B)。箱線圖可視化了上述基因在OSCC和癌旁樣本中的表達(圖1C)。
注:A、C.37個差異表達ARG的表達情況;B.差異表達ARG的篩選,紅色為上調,綠色為下調,黑色為無差異
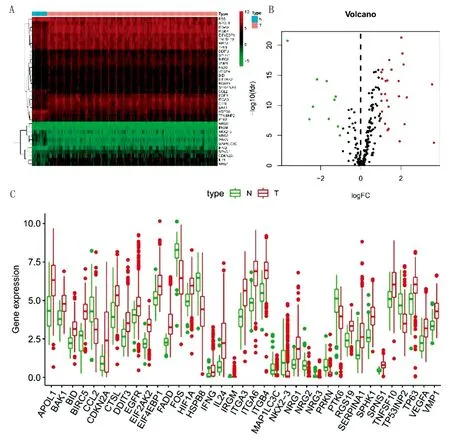
2.2 差異表達ARG的富集分析 差異表達ARG的GO富集分析表明,主要涉及自噬相關機制的生物學過程(圖2A)。KEGG富集分析表明,主要涉及細胞凋亡及人巨細胞病毒(human cytomegalovirus,HCMV)和人乳頭狀瘤病毒(human papillomavirus,HPV)感染等途徑(圖2B)。
注:A.GO富集分析前5位;B.KEGG富集分析前10位
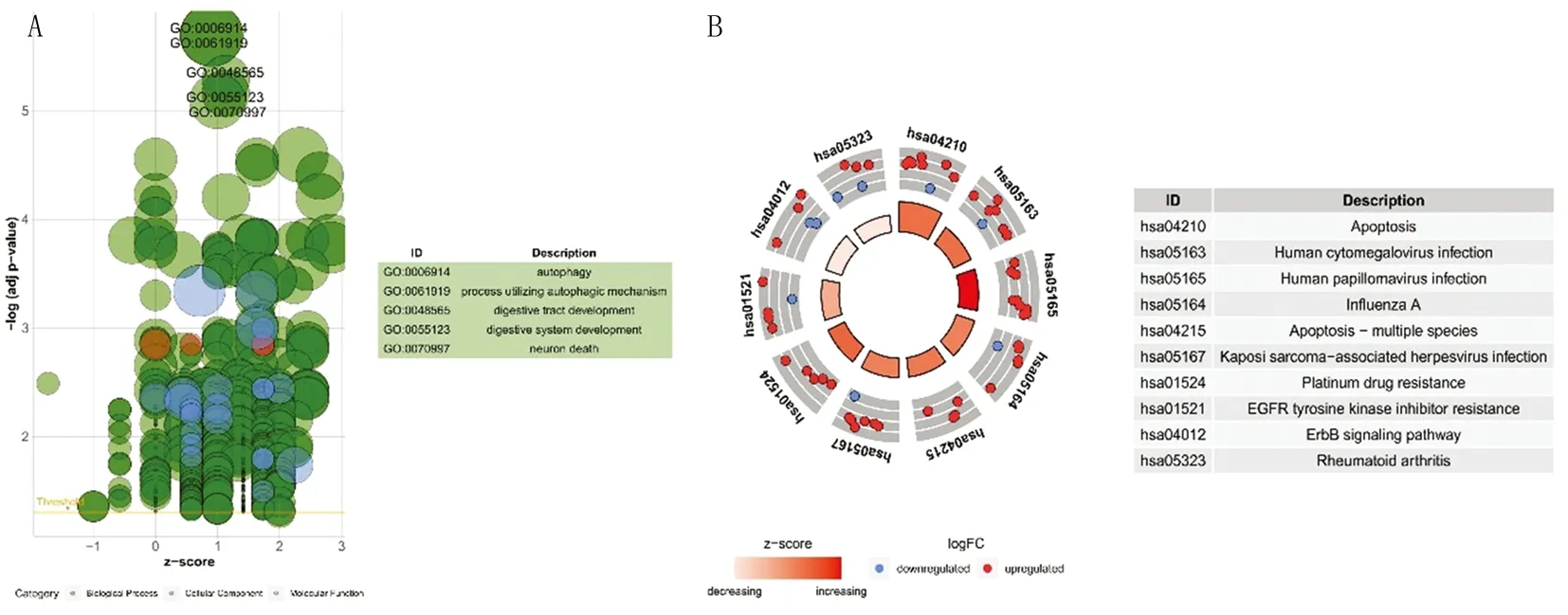
2.3 預后相關差異表達ARG的篩選與風險預測模型的構建 合并OSCC中差異表達ARG和預后數據后行單因素Cox分析獲得6個符合P<0.05的ARG,包括FADD、NKX2-3、ITGA6、CTSL、BAK1、ITGA3(圖3A)。進一步通過Lasso回歸分析(圖3B、C)及多因素Cox分析(圖3D)篩選出FADD、NKX2-3、BAK1作為預后相關差異表達ARG,用于風險預測模型的構建。即RS =(1.558 5×FADD)+(-0.557 8×NKX2-3)+(1.547 1×BAK1)。
注:A.單因素Cox分析確定6個P<0.05的ARG;B、C.Lasso回歸分析選擇最佳參數;D.多因素Cox分析確定3個預后相關差異表達的ARG
2.4 風險預測模型的分析 基于TCGA的相關數據顯示,以RS中位數分布的高、低風險組,見圖4A,組內患者的生存狀況及模型內3個預后相關差異表達ARG的表達情況,見圖4B、D。Kaplan-Meier生存分析表明,高風險組的5年生存率低于低風險組(P<0.001)(圖4C)。單因素Cox分析表明,RS與患者的預后顯著相關(P<0.001)(圖4E);多因素Cox分析表明,RS可作為OSCC患者的獨立預后指標(P<0.001)(圖4F);ROC曲線表明,與包括性別、年齡、腫瘤分化程度、腫瘤分期和T分期在內的傳統臨床病理特征相比,該預測模型具有較高的診斷優勢(AUC=0.614)(圖4G)。
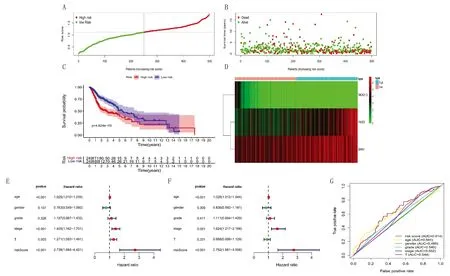
注:A.基于RS中位數的高、低風險分組;B.組內患者的生存狀況;C.高、低風險組的Kaplan-Meier生存分析;D.模型內ARG表達情況;E.模型的單因素Cox分析;F.模型的多因素Cox分析;G.模型的ROC曲線分析
2.5 風險預測模型的臨床效用 模型與臨床病理特征間的相關性分析表明,僅在較高T分期(圖5A)和較大年齡(圖5B)患者中可發現模型的RS顯著增高(P<0.05)。
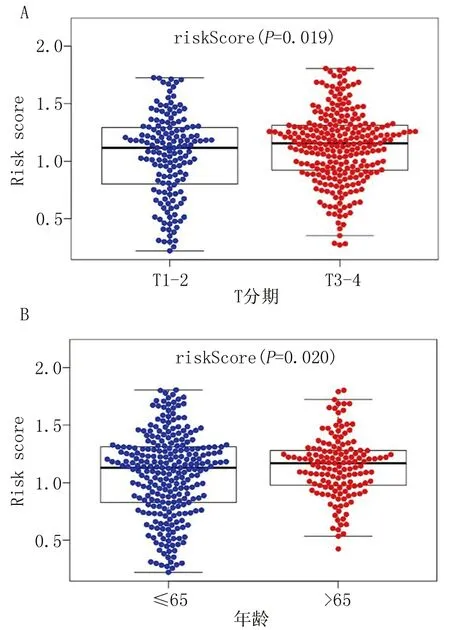
注:A.模型與T分期的相關性;B.模型與年齡的相關性
2.6 Western-blot驗證OSCC中BAK1蛋白的表達 Western-blot檢測結果顯示,在OSCC癌組織中BAK1蛋白的表達高于癌旁組織(t=3.197,P=0.033),見圖6。
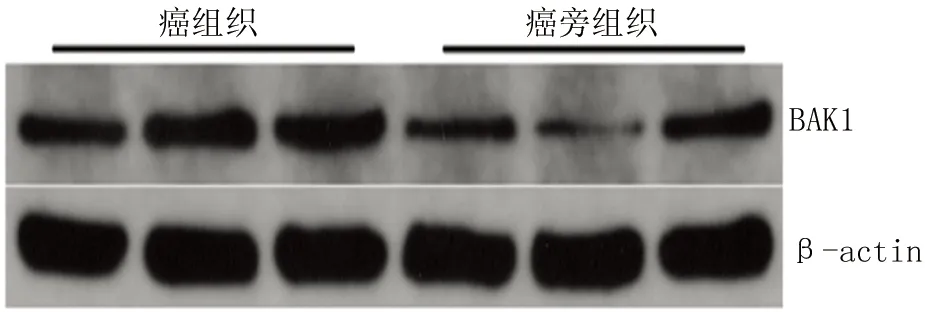
圖6 Western-blot 檢測BAK1蛋白在OSCC中的表達
3 討 論
自噬在腫瘤形成和癌癥治療中起著復雜且矛盾的作用,在腫瘤發生的早期自噬可通過促進腫瘤壞死以抑制腫瘤生長,而隨著腫瘤繼續發展自噬卻可通過促進血管形成或遠處轉移等加速腫瘤進展[5-6]。盡管目前已發現部分ARG與OSCC的進展相關,但仍缺乏對ARG中潛在預后或臨床意義的闡明。本研究將TCGA數據庫中的OSCC轉錄信息和人ARG列表進行分析,獲得了在OSCC中差異表達的ARG共37個。既往研究表明,自噬抑制后增加的FOXO3a可刺激促凋亡基因BBC3/PUMA的轉錄[7];HCMV可通過調控細胞周期、凋亡、遷移及腫瘤侵襲性和血管生成等參與疾病發展[8];而HPV與頭頸部鱗癌(HNSCC)之間存在明顯的聯系,約有26%的HNSCC對HPV呈陽性,其中HPV16為最常檢測到的類型[9]。這與本研究對37個差異表達ARG的富集分析結果相類似,在OSCC中差異表達的ARG多涉及自噬相關機制,以及多與細胞凋亡、HCMV感染和HPV感染等途徑相關。進一步將上述ARG表達數據與預后數據相結合,構建出包含FADD、NKX2-3、BAK1的風險預測模型。Kaplan-Meier生存分析、單因素和多因素Cox分析及ROC曲線結果表明,該模型具有較準確的生存預測性,與傳統臨床特征相比該模型還具有較高的預測優勢,以及在T分期和年齡中可表現出臨床效用。可見該模型內的FADD、NKX2-3、BAK1可能成為OSCC患者潛在的預后生物標志物或治療靶標。
BAK1可誘導線粒體外膜通透化以釋放凋亡因子從而使細胞發生凋亡,這是細胞凋亡中的關鍵步驟[10]。但查閱既往文獻尚未發現OSCC中BAK1的相關研究,因此本研究通過Western-blot檢測了BAK1蛋白在OSCC中的表達,試驗結果同數據分析結果一致,驗證了BAK1在OSCC中呈高表達。FADD位于人11q13.3號染色體,而11q13.3染色體常被發現在多種癌癥中擴增[11-12]。本研究的數據分析推測表達上調的FADD可能是OSCC的促進因素,這種推測在以往的研究中均得到了證實[12-14],其表明了FADD在OSCC中呈高表達,特別是在免疫組化蛋白中過表達,并且與較高的臨床分期及淋巴結轉移相關,或可作為有效的預后指標之一。NKX2-3作為模型中唯一的保護因素,可激活負責細胞分化、遷移和成熟等信號傳導途徑[15]。NKX2-3在口腔、咽腔、鰓弓外胚層和下頜骨的牙源性上皮中表達,其主要作用是在內皮細胞中表達MAdCAM-1,而MAdCAM-1可通過結合整合素47和L-選擇素在淋巴細胞歸巢至黏膜組織中起關鍵作用[16]。有研究表明,NKX2-3可抑制MAPK通路來抑制人結腸癌細胞和肝癌細胞的生長[17]。本研究的數據分析推測高表達的NKX2-3可能是OSCC進展的抑制因素,但目前僅有研究通過qRT-PCR和免疫組化驗證了其在OSCC中呈低表達[18],具體作用機制尚待進一步闡明。
綜上所述,本研究通過對TCGA數據庫中OSCC相關的ARG轉錄信息及臨床病理特征和預后數據進行分析,篩選出FADD、NKX2-3、BAK1等3個與預后相關差異表達ARG,構建的風險預測模型可有效評估OSCC患者的預后。雖研究尚存在如模型需在其他隊列中進行驗證及需實驗闡明具體調控機制等局限性,但本研究的數據可為未來臨床中對不同風險的OSCC患者實現個體化診療提供新的思路。
利益沖突:所有作者聲明無利益沖突
作者貢獻聲明
王錦航:實施研究過程,分析試驗數據,論文撰寫;彭士雄:分析試驗數據,論文撰寫;趙建廣:資料搜集整理,分析試驗數據;陳彥平:提出研究思路,論文修改;崔子峰:設計研究方案,論文審核

