微藻及其分泌物對溶解性有機磷礦化的促進效應
張曉燕,羅專溪,王振紅*
微藻及其分泌物對溶解性有機磷礦化的促進效應
張曉燕1,羅專溪2,王振紅1*
(1.閩南師范大學化學化工與環境學院,福建省現代分離分析科學與技術重點實驗室,污染監測與控制福建省高校重點實驗室,福建 漳州 363000;2.華僑大學化工學院,福建 廈門 361021)
為較好認識水生態環境中溶解性有機磷(DOP)的礦化過程及其影響因素,本實驗選取典型的DOP類型(腺苷-5'-三磷酸二鈉鹽(ATP)、β-甘油磷酸鈉(βP)和D-葡萄糖-6-磷酸二鈉鹽(GP))、溫度(4,15,25℃)、銅綠微囊藻及其分泌物占比(& EPS)(0%、50%、90%)、砷酸鹽(As(V))濃度(0,10,100μg/L)4種環境因素,通過L9(34)正交試驗探究影響DOP礦化過程的主要影響因素、水平及礦化過程中的環境變化.結果表明:& EPS作為主要影響因素可顯著促進DOP的初期(前2d)礦化,之后被溫度取代,溫度升高有利于DOP的礦化.典型DOP礦化過程中藻細胞增殖對最佳溫度下(25℃)DOP的礦化起促進作用,并使得βP與ATP環境下的pH值和氧化還原電位(ORP)產生較大波動.含As(V)環境中DOP礦化伴隨著As(V)形態的轉化,GP和ATP環境中均有明顯的三價砷(As(III))產生,使得砷的生態風險增強,而溫度與& EPS占比增高可促進βP環境中As(V)的甲基化.單獨DOP礦化可導致環境中以類蛋白質組分為主的溶解性有機質(DOM)含量顯著升高,而存在& EPS時則以可溶性微生物產物類DOM為主.研究結果對認識水體中不同DOP的礦化過程及其可能導致的水華爆發和水環境變化所帶來的生態風險的科學管控具有重要意義.
正交試驗;有機磷礦化;溫度;銅綠微囊藻;砷形態
近年來隨著對水體富營養化的管控,外源性磷輸入受限,內源性有機磷尤其是溶解性有機磷(DOP)在水體總磷中占比日漸突出(約占總磷的25%~ 50%)[1],使得作為水體潛在無機磷源之一的DOP礦化受到普遍關注.水體中DOP以植酸鹽、磷酸酯、核酸、核苷酸、磷脂、肌醇和有機磷農藥等形態存在[2-3],其中以不穩定的磷酸單酯類居多[4].DOP礦化伴隨的能量轉移和形態轉化,不僅能提供有效的磷源,同時其釋出的溶解性有機物亦可成為微生物的可利用性碳源[5],并由此可能引起藻華爆發.
水體中DOP的礦化受溫度、pH值、細菌、溶解氧、磷酸酶等多種因素影響[6-7].研究表明DOP的礦化率隨溫度升高而增加[8-9],且在缺氧環境下被顯著促進[10],偏酸或偏堿環境均有利于其礦化[11].浮游藻類因可分泌磷酸酶將DOP礦化為自身生長代謝所需的營養物質而在DOP的礦化中扮演重要角色[12-15].銅綠微囊藻()因在適宜溫度下能快速增殖而成為富營養化水體中常見的藍藻水華優勢藻種之一[16],其增殖的同時可向環境中釋出包括多糖、蛋白質、脂質、腐殖質及少量的堿性磷酸酶(AP)等多種胞外分泌物(EPS)[17],其中AP能水解DOP中的磷酸單酯[18],并由此增強微藻對低磷環境的適應性[13].
砷(As)作為地殼中的微量過渡金屬元素在水體中普遍存在,砷酸鹽(As(V))因與磷酸鹽(PO43-)具有相似的化學結構,被認為可通過PO43-轉運途徑在藻體內累積與轉化[19].研究認為EPS中的AP能誘導藻體對As(V)的轉化并減少As(V)的累積[20],這使得As(V)對DOP的礦化因銅綠微囊藻及其分泌物(EPS)的制約而相互產生影響成為可能.同時不同類型DOP的礦化過程在一定程度上也存在差異[21].基于此本研究選取DOP類型、溫度、銅綠微囊藻及其分泌物(EPS)、砷酸鹽(As(V))濃度作為影響DOP礦化的主要影響因素,采用正交試驗設計方法探討影響DOP礦化的主要因素及相關環境的變化,以更好地理解水環境中DOP的礦化過程及該過程可能產生的水生態環境風險.
1 材料與方法
1.1 正交試驗設計
選取有機多聚磷—腺苷-5'-三磷酸二鈉鹽(ATP)和小分子單酯磷—β-甘油磷酸鈉(βP)與D-葡萄糖-6-磷酸二鈉鹽(GP)為典型DOP類型,As(V)濃度參考《生活飲用水衛生標準(GB/5749-2006)》和《地表水環境質量標準(GB/3838-2002)》中As的規定限值并考慮無As污染作為對照設定[22-23],溫度則結合DOP的保存條件與藻的實際生長環境確定,& EPS依據實際水體藻細胞狀況并以無& EPS作為對照設定,具體各因素及水平如表1所示,采用L9(34)正交試驗設計(表2)探討影響DOP礦化的主要因素及相應環境條件.
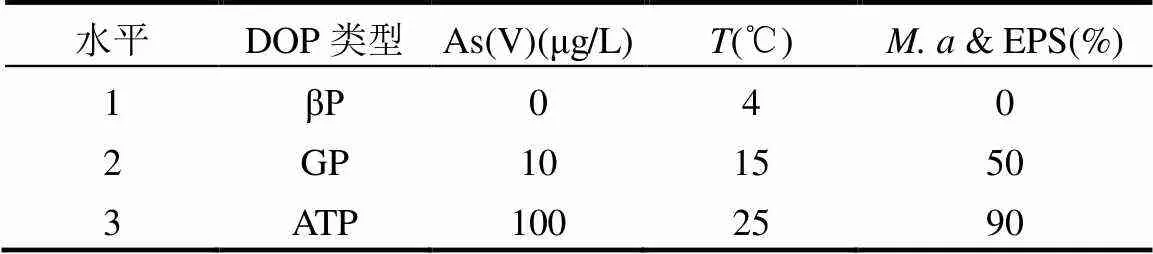
表1 正交試驗的環境因素與水平
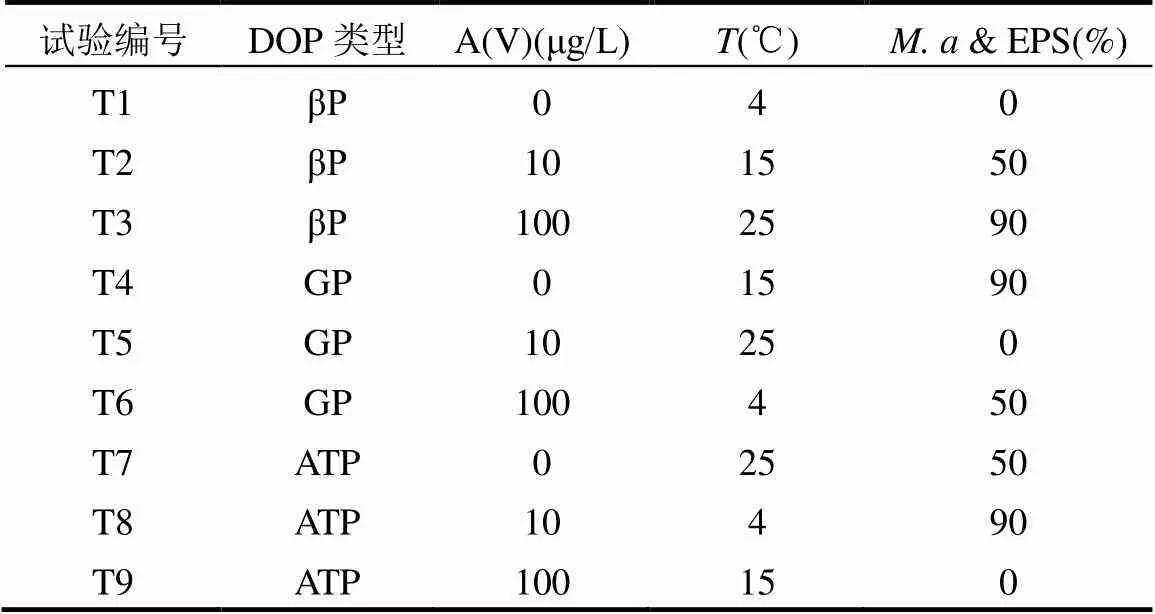
表2 L9(34)正交試驗設計
1.2 M. a & EPS的來源與處理
銅綠微囊藻()FACHB-905,購自中國科學院水生生物研究所,取1.5L正常培養的生長狀態良好的藻液以4000r/min離心15min,棄掉上清液,加入同體積滅菌去離子水洗滌2次以除去磷酸鹽.將其轉移至滅菌的無磷BG11培養液中,置于培養箱中(25℃,光照強度3000lx,光暗比16h:8h)進行3d的磷饑餓培養,使藻細胞處于磷饑餓狀態[24].取磷饑餓培養后的藻細胞以4000r/min離心15min,棄去離心管底部的藻體,上清液為EPS,上清液中藻細胞密度經流式細胞儀(美國BD C6Plus)測定為1.2×106cells/mL.
1.3 試驗的準備與操作
考慮無機磷及總磷的實際測定及藻細胞生長的需要,設定設置GP、ATP與βP的濃度為1.0mg/L (以P計),使用Na3AsO4.12H2O配置As(V)標準儲備液.根據表2中的實驗條件,分別配置100mL不同DOP溶液,各試驗均設置3個平行.所有玻璃儀器須在10% HNO3溶液中浸泡24h后經滅菌處理,以上實驗過程均在無菌環境下完成.
1.4 最佳實驗條件下DOP向無機磷的礦化過程
將GP、ATP和βP溶液分別與& EPS和滅菌超純水按1:9的比例進行混合(總體積為100mL,& EPS占比為90%,P濃度為1.0mg/L),置于25℃培養箱中,連續觀測6d,于每天取樣10mL,測定其溶解性無機磷、pH值和氧化還原電位(ORP)的變化.
1.5 測定方法
采用流式細胞儀測定藻細胞密度,同時用雷磁pH計和ORP測量儀(上海康儀)分別測定溶液的pH值和ORP.將上清液經0.22μm纖維素針式過濾器過濾,參照先前文獻中的方法采用高效液相色譜-等離子體質譜聯用儀(HPLC-ICP-MS,美國 Agilent 1200)測定砷形態,流動相為10mmol/L硝酸銨與10mmol/L磷酸氫二胺,并用優級純硝酸調節pH至6.2,流速為1mL/min[25-26].采用鉬酸銨分光光度法測定溶解性無機磷和總磷的濃度.
DOP礦化率的計算公式為:

式中:為DOP礦化率,%;表示總磷濃度,mg/L;X為時刻的溶解性無機磷濃度,mg/L.
1.6 三維熒光光譜測定
將第0d和第6d含藻試驗組溶液進行離心分離,取上清液并經0.45μm纖維素針式過濾器過濾后,采用熒光分光光度計(瓦里安Cary Eclipse)測定的三維熒光光譜,同時測定超純水.掃描條件:激發波長(Ex)為200~450nm,掃描間距為10nm;發射波長(Em)為250~550nm,掃描間距為2nm;狹縫寬度為20nm,掃描速度為1200nm/min.使用MATLAB軟件中的DOMFluor工具箱處理三維熒光數據并進行平行因子(PARAFAC)分析,三維熒光光譜測定結果扣除超純水數據以去除拉曼散射的影響,結果表明3個組分模型能很好地通過殘差分析、拆半檢驗、隨機初始化分析和 Tucker’s congruence coefficient(TCC)檢驗,說明結果具有可靠性[27-28].
1.7 數據分析及處理
采用 GraphPad Prism 8、Origin2019、MATLAB繪圖,正交實驗結果用Minitab18進行單因素方差分析(ANOVA),并用以下公式計算每個因素的貢獻百分比(PC)[29]:
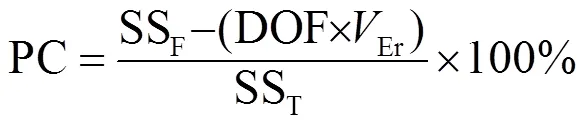
式中:SST為總平方和;SSF為階乘平方和;Er為誤差的方差;DOF為自由度.
2 結果與討論
2.1 影響DOP礦化的主要因素
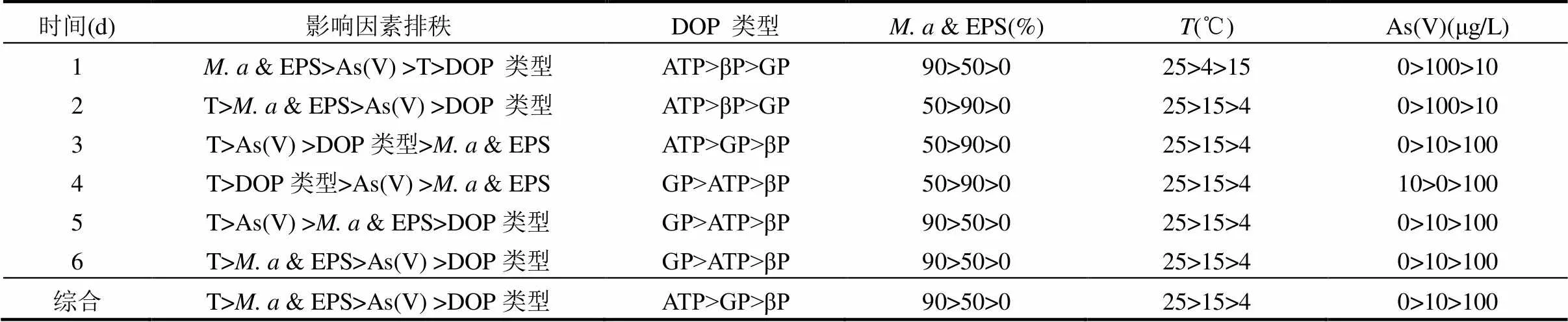
表3 不同時間下各因素對礦化率的影響主效應
由正交試驗得出6d內各因素對DOP礦化率影響的主效應結果如表3所示,可以看出不同時間下影響因素的排秩具有差異性,& EPS占比為DOP礦化第1d時的主要影響因素,之后則被溫度取代,溫度升高可促進DOP的礦化,表現為25℃> 15℃>4℃.& EPS的存在有利于DOP礦化,而As(V)則對DOP礦化具有抑制效應.前3d內ATP較GP和βP表現出更佳的礦化效果,之后則以GP的礦化效果更好.綜合得出25℃時& EPS占比為90%的無As(V)環境更有利于DOP的礦化.從不同DOP礦化率的均值主效應圖(圖1)可以看出,影響DOP礦化的因素主次排秩為:T>& EPS>As (V)>DOP類型,溫度升高可促進DOP的礦化,且25℃較15℃時DOP礦化率顯著增高.總體來看除溫度外其余3種因素對DOP礦化的影響均相對較小,且表現為隨& EPS占比增高礦化率增加的趨勢,表現為微量藻的存在有利于DOP的礦化,這可能受藻細胞能分泌AP進而對DOP礦化起促進作用[30]. As(V)對DOP礦化的抑制效應與其濃度呈正相關,ATP表現出較GP和βP更易被礦化的趨勢. DOP最佳礦化條件為:25℃時& EPS占比為90%不含As(V)的ATP環境,其礦化率于第5d達到100%.
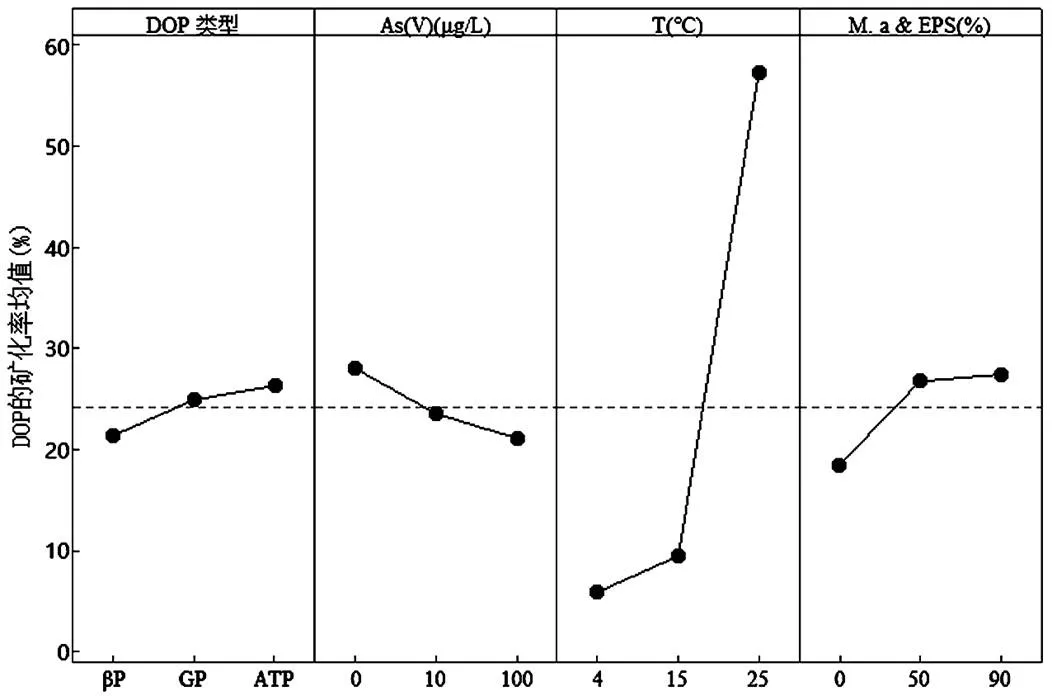
圖1 不同DOP的礦化率的均值主效應
由單因素方差分析得出不同時間下各因素對DOP礦化率的影響在不同水平間均具有顯著性差異(< 0.05),其貢獻占比如圖2所示,可以看出& EPS在轉化前2d作為主要影響因素影響DOP的礦化,第1d其占4個因素總貢獻的51.5%,是溫度貢獻的3倍,第2d則與溫度影響接近,占總貢獻的36.0%,之后則以溫度影響占絕對優勢,占總貢獻的90.5%以上,且隨時間趨于穩定.& EPS在礦化第1d表現出隨其占比增高DOP礦化率顯著增加的趨勢,其對DOP礦化率的促進是其他因子的2倍,第2d對礦化率的促進作用與溫度基本一致,且表現為其占比為50%和90%時無顯著差異,均較占比為0%時的顯著增高.
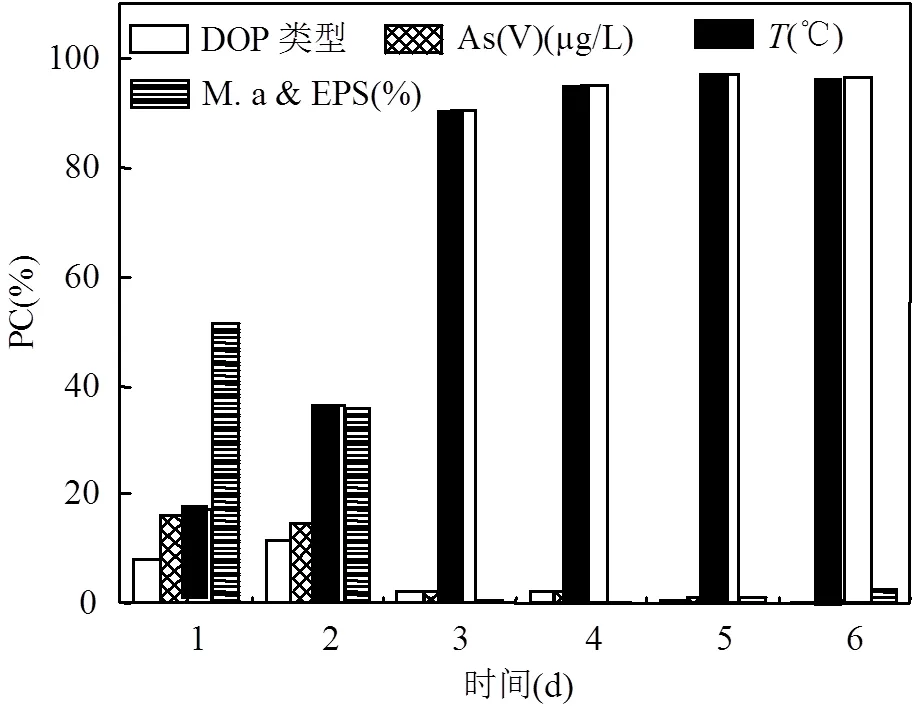
圖2 不同時間下各影響因素對DOP礦化率的貢獻占比
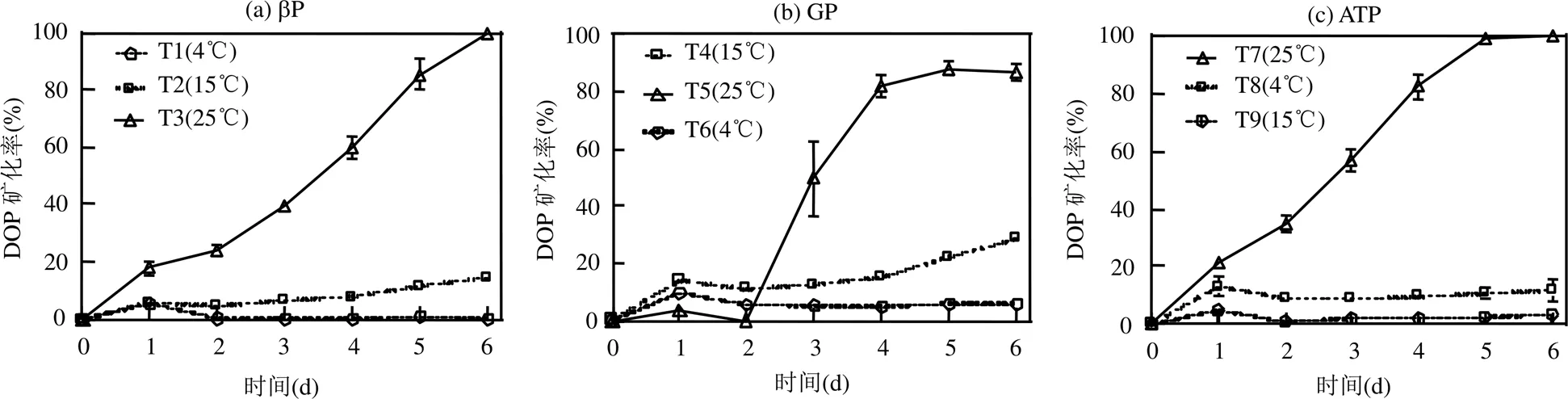
圖3 不同溫度下不同類型DOP礦化率隨時間的變化特征
3種類型DOP在不同溫度下礦化率隨時間變化如圖3所示, 25℃時除GP環境中的T5試驗組前2d礦化率相對較低,且低于T4(15℃)和T6(4℃)試驗組,其余兩種DOP環境下均顯著高于15和4℃試驗組,且DOP礦化率隨時間呈顯著增高趨勢,該溫度下第5d時T5(GP)試驗組礦化率達到88.1%之后趨于平穩,T3(βP)和T7(ATP)試驗組則分別于第6d時礦化率達到100%.15℃時T9(ATP)試驗組幾乎沒發生礦化,說明該溫度下As(V)的存在不會影響ATP的礦化,而T2(βP)與T4(GP)試驗組均分別高于4℃時的T1和T6試驗組,第6d時礦化率分別達到14.4%和28.4%說明即使EPS占比增加但該溫度下DOP的礦化率并不高,這可能與該溫度下藻的生長相對緩慢有關[31].4℃時,T1試驗組的βP幾乎沒有礦化,T6(GP)和T8(ATP)試驗組因EPS的存在其礦化率在第1d時略有升高,之后則保持平穩態勢,GP和ATP的平均礦化率分別為(6.0%±1.7%)和(10.5%±1.8%),這可能是由于初始時EPS中攜帶的AP對DOP的礦化作用所致,之后則由于低溫環境藻的生長與生物化學反應停止,使其礦化率保持穩定.
2.2 最佳條件下DOP的礦化率
根據正交試驗確定的DOP礦化的最佳條件:25℃時& EPS占比為90%的不含As(V)環境,得到的該環境下ATP、GP和βP的實際礦化率隨時間變化如圖4所示.可以看出ATP、GP和βP 3種DOP的礦化率均隨時間呈增高趨勢,在第6d時礦化率分別達到86.9%、87.3%和90.0%,較該環境下的預測值100%均相對偏低,其中ATP礦化率在第4d達到83.7%,分別高出βP和GP的29.8%和35.4%.與前期研究相比較得出& EPS對βP和GP在前4d的礦化率與單獨水環境的空白組相比無顯著差異,從第5d起則顯著高于空白組,而ATP則表現為& EPS的添加與空白組隨時間均無顯著差異[32].較單獨EPS環境相比較& EPS的添加均顯著促進了DOP的礦化,與前期研究得到的EPS在一定程度會抑制DOP的礦化結果不同[32],說明藻細胞的存在對DOP的礦化具有驅動作用.

圖4 最佳條件下不同類型DOP礦化率隨時間的變化特征
2.3 DOP礦化過程中主要的環境變化
2.3.1 含& EPS試驗組中的藻細胞密度變化 含& EPS試驗組中微藻細胞密度在礦化前后變化如圖5所示,& EPS占比為50%(T2、T6和T7試驗組)和90%(T3、T4和T8試驗組)對應的藻細胞密度分別為6.00×105cells/mL和1.08×106cells/ mL.可以看出第6d時T3和T7試驗組的藻細胞密度較初始相比均相對增高,顯著大于其余試驗組(<0.05),分別達到5.29×106cells/mL和1.03× 106cells/mL,是第0d的4.90倍和1.72倍,而其他試驗組則顯著降低.由先前研究可知銅綠微囊藻能以βP、ATP和GP分別作為單一磷源進行增殖,且對藻的生長無顯著差異[19],因此適宜微藻增殖的溫度下(25℃),T3較T7試驗組的& EPS占比高,使得T3試驗組藻細胞顯著高于T7試驗組,該溫度下微藻細胞增殖驅動了DOP的高礦化率,這與Bai等研究得出銅綠微囊藻可促進磷酸單酯(Mono-P)的轉化相一致[6,8].15℃(T2和T4試驗組)和4℃(T4和T8試驗組)環境下藻細胞增殖受到抑制,不同試驗組間無顯著差異(>0.05),這與Yang等研究發現低溫抑制微囊藻的生長一致[33].
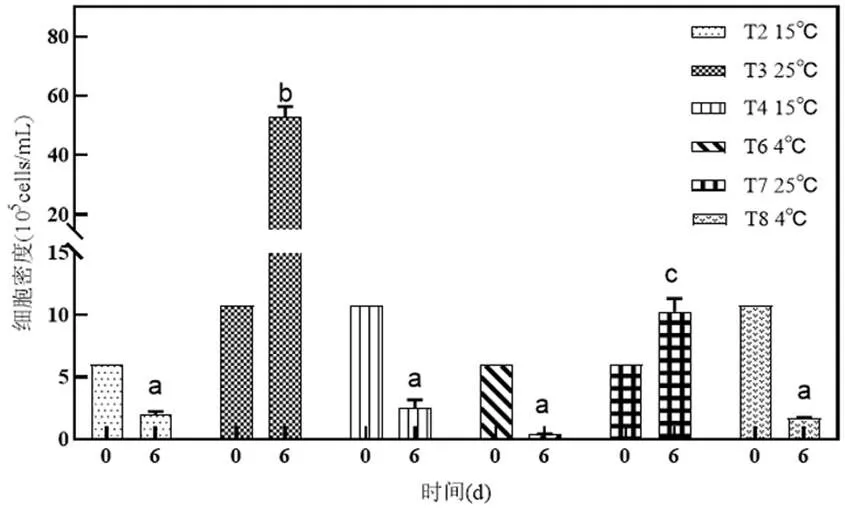
圖5 DOP礦化過程中含M. a & EPS組的藻細胞密度
2.3.2 含As(V)試驗組中的砷形態轉化 各DOP經6d礦化后其含As(V)試驗組中的砷形態變化如圖6所示,可以看出DOP礦化同時伴隨As(V)形態的轉化,T2(βP,15℃,& EPS占比50%)和T3(βP, 25℃,& EPS占比90%)試驗組均有二甲基砷(DMA)檢出,且T3試驗組發現有單甲基砷(MMA),說明& EPS促進βP礦化的同時也促進介質中As(V)的甲基化.T5、T6、T8和T9試驗組中均有亞砷酸鹽As(III)檢出,其中T5試驗組(GP,25℃,& EPS占比0%)中As(III)占總砷(TAs)的83.9%,說明該環境有利于As(V)的還原,究其原因可能是GP礦化生成還原性有機物而導致[34].T6(GP,4℃,& EPS占比50%)較T5試驗組As(III)占比減少,占TAs的11.5%,說明盡管低溫抑制了GP的礦化,但& EPS的存在一定程度上也能引起As(V)的還原,這與Wang等研究發現GP可促進As(V)的還原相一致[19]. T8(ATP,4℃,& EPS占比90%)和T9(ATP,15℃,& EPS占比0%)試驗組中As(III)占比接近,分別為12.4%、14.0%,說明盡管ATP礦化率低,但溫度增高引起的As(V)的還原比& EPS占比為90%所導致的As(V)的還原相對要高,反映出溫度增高更有利于該環境中As(V)的還原.T5和T9試驗組中As(III)的檢出表明DOP環境下溫度升高會增加水中As的生態風險.

圖6 DOP礦化過程中含As(V)環境中的砷形態變化
2.3.3 環境中的pH值變化 不同試驗組DOP礦化過程中水體pH值的變化如圖7所示,可以看出不含& EPS試驗組中的pH值均相對較低,T1(βP)和T5(GP)試驗組中的pH值在(6.62±0.17)范圍內波動,而T9(ATP)試驗組的pH值隨時間變化呈下降趨勢;其余各試驗組在第1d時pH值均顯著降低,說明環境中的DOP對& EPS引起pH值的增高具有緩沖效應.& EPS占比為50%時,除第0d外,T2(βP)和T6(GP)試驗組pH值為(7.22±0.05),但T7(ATP)試驗組中的pH值波動較大,第3d其pH值升高至7.91..& EPS占比為90%時,T3(βP)試驗組pH值呈先上升后下降的趨勢;T4(GP)和T8(ATP)試驗組的pH值為(7.52±0.22).T3(βP)和T7(ATP)試驗組較大的pH值波動可能是由于在適宜微藻生長的溫度下,較高的& EPS占比提升了環境的堿度[35],使DOP處于堿性礦化環境.
2.3.4 環境中的ORP變化 不同試驗組DOP礦化過程中水體ORP隨時間變化如圖8所示,各DOP環境中不含& EPS的T1、T5和T9試驗組與其余試驗組相比ORP均相對偏高,T1(βP)和T5(GP)環境中第0d的ORP分別為207mV和211mV,從第1d顯著升高隨后變化不大;T9(ATP)試驗組ORP前3d相對穩定,為(299±8)mV,第4d顯著增高至428mV,之后趨于穩定.& EPS占比為50%時,T2、T6和T7試驗組中ORP除第1d顯著增高外,其余時間相對穩定,分別為(212±23)mV、(247±14)mV和(238±16)mV.當& EPS占比增高為90%時,T3試驗組中ORP從第2d起呈緩慢降低至第6d時為181mV,T4試驗組除第1d顯著增高外其余時間保持穩定為(247±13)mV,T8試驗組中ORP隨時間變化略有升高,至第4d時最高為317mV之后又趨于降低.T3試驗組ORP有所減小,可能是由于在適宜微藻生長的溫度下使得環境的還原性增強,更有利于DOP礦化.

圖7 不同類型DOP礦化過程中水環境pH值隨時間變化
由各試驗組中得到pH值、ORP、DOP礦化率與各影響因子間的相關分析可知:ORP與pH值、& EPS占比和DOP礦化率均顯著負相關,相關系數分別為-0.667、-0.453和-0.223(<0.05),與As(V)濃度呈顯著正相關,相關系數為0.206(<0.01);說明水體pH值升高和& EPS占比增加與DOP礦化率增高可導致水體ORP降低,同時As(V)濃度增高會引起水體ORP上升.& EPS占比與pH值顯著正相關,與ORP顯著負相關,表明& EPS占比增加可引起水體pH值升高與ORP顯著降低;DOP礦化率與溫度和pH值均顯著正相關,相關系數分別為0.670和0.307(<0.01),與ORP顯著負相關,相關系數為-0.223(<0.01),說明溫度升高和水體pH值升高均會促進DOP礦化并引起水體ORP降低.總體得出環境溫度升高與& EPS介導的水體pH值升高能促進DOP礦化.
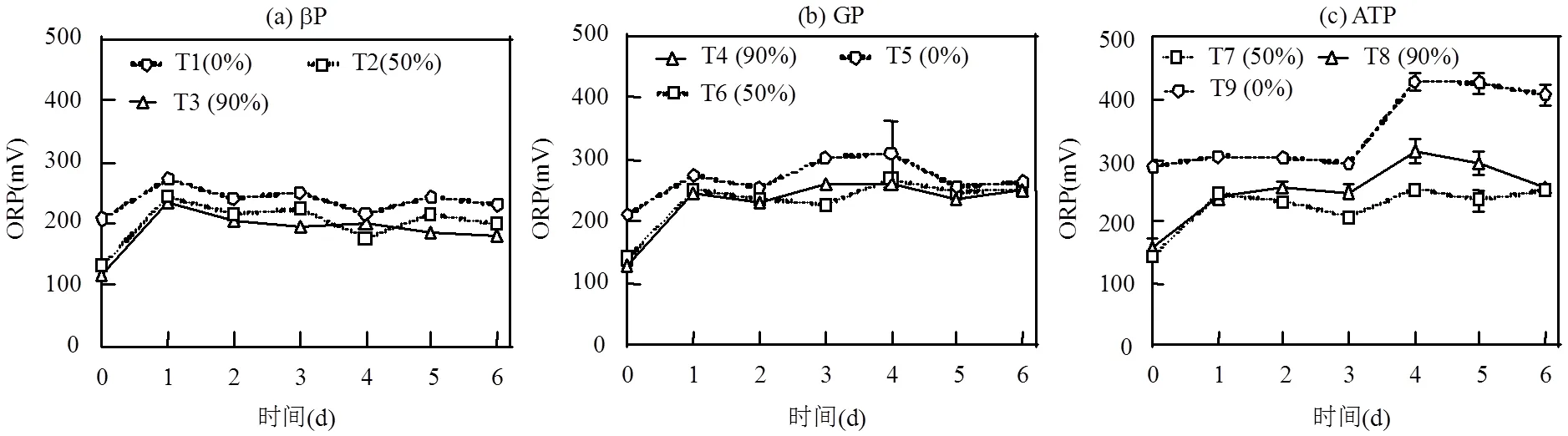
圖8 不同類型DOP礦化過程中水環境中的ORP隨時間變化
2.4 三維熒光光譜分析
各試驗組溶解性有機質(DOM)的三維熒光光譜結果通過PARAFAC模型共解析出3個主要化學組分,模型可靠性通過拆半檢驗和殘差分析得到充分驗證,各組分的三維熒光光譜及載荷如圖9所示,C1在x/m=280/334nm處有單一激發和發射峰,歸類為可溶性微生物產物組分,C2在x/m= 220/334nm處有單一激發和發射峰,歸類為類蛋白質組分,C3在x/m=340/436nm處有激發和發射主峰,x/m= 260/436nm處有二級峰,歸類為類腐殖酸組分[17,36].
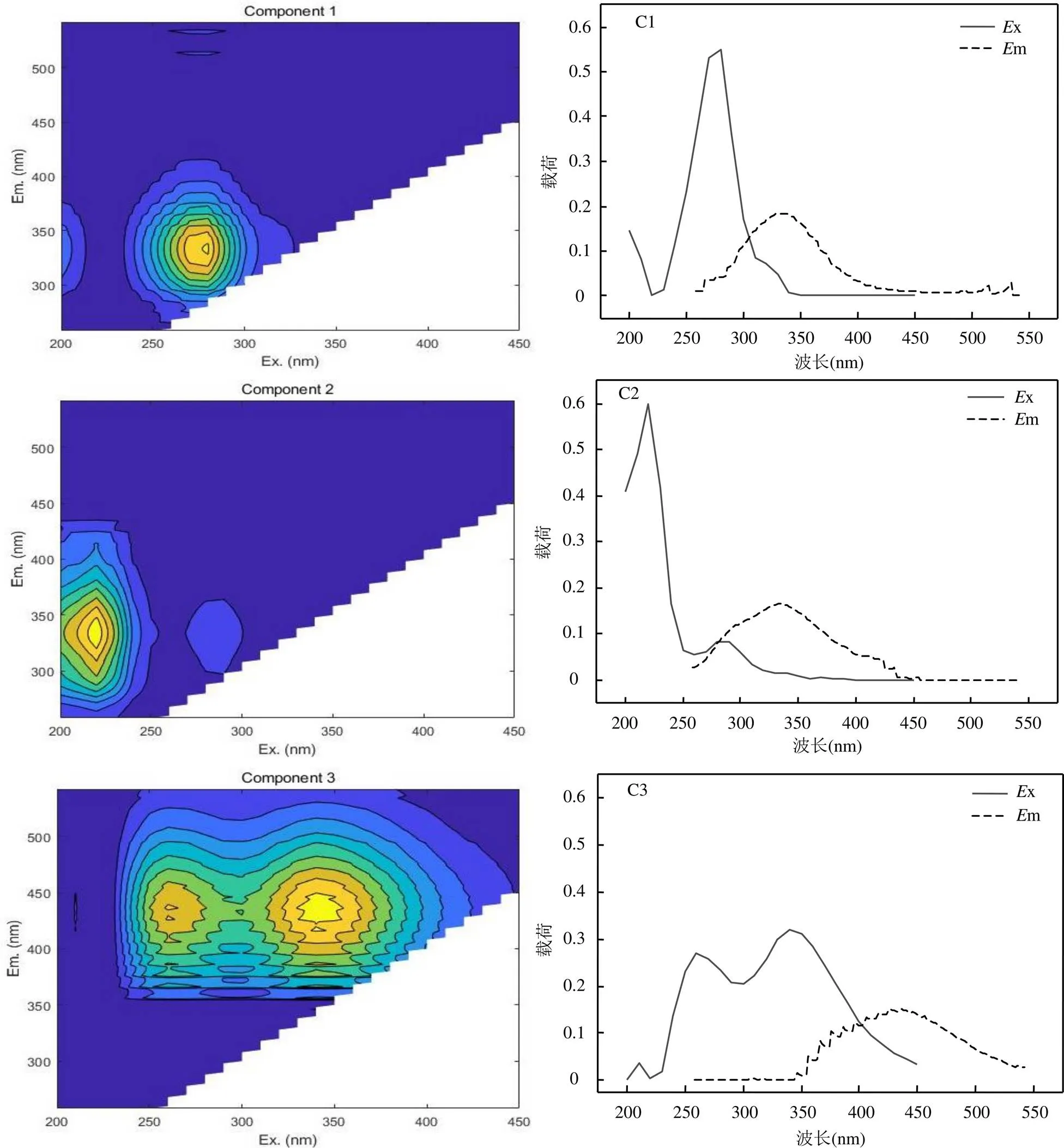
圖9 不同試驗組DOM中3個組分熒光光譜及載荷
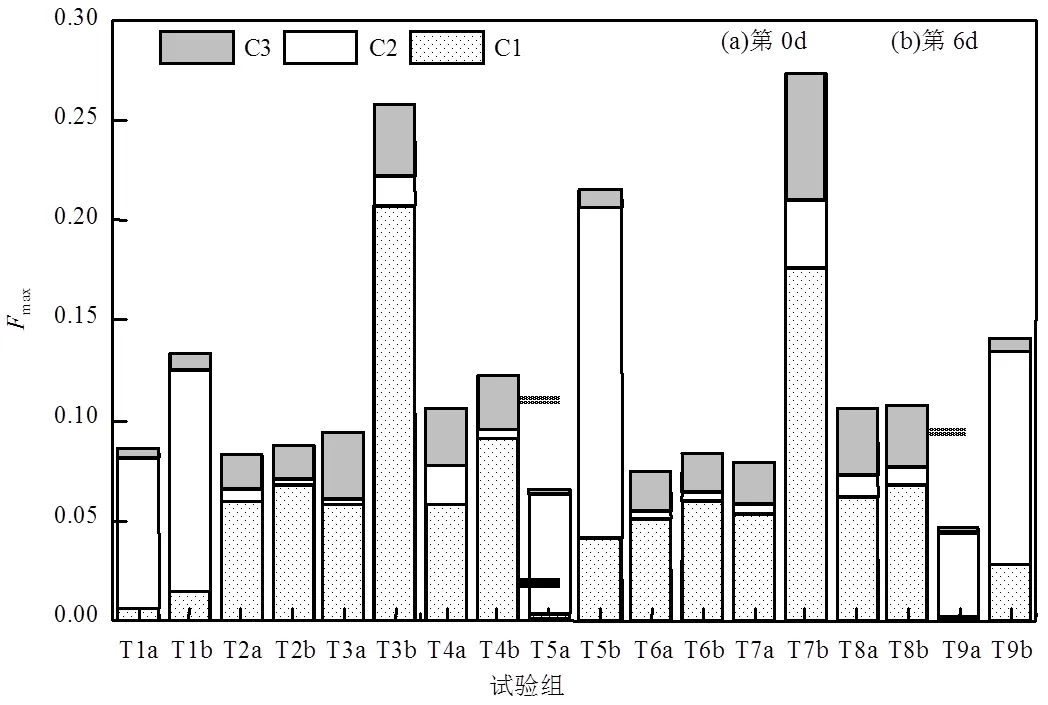
用平行因子分析得到不同試驗組DOM的最大熒光強度值(Fmax)表示各樣品中不同組分的含量[37].不同試驗組DOP礦化前后各組分的Fmax及其相對占比如圖10所示,由圖可知,DOP經6d礦化后其Fmax值均相對增高,礦化后的含& EPS試驗組中DOM主要為C1組分(可溶性微生物產物),不同試驗組礦化前后其在3個組分中的占比分別為(64.2%±6.4%)和(71.9%±6.8%);而無& EPS試驗組中DOM主要為C2組分(類蛋白質),礦化前后其占比分別為(90.4%±1.9%)和(78.6%±3.8%),主要是由于選取的這3種DOP均與類蛋白質的合成有關[38].T3與T7試驗組礦化后C1組分的Fmax值顯著增高,這主要是由于該試驗組適宜的環境溫度(25℃)促進了& EPS中藻細胞的增殖,進而向環境分泌較多的可溶性微生物產物.T2和T4試驗組礦化后C1組分的Fmax值及其占比都有所增加,可能是15℃下藻細胞分泌了少量的可溶性微生物產物.T6和T8試驗組礦化后3個組分的Fmax值均無明顯變化,可能是低溫(4℃)抑制了藻細胞的代謝以及DOP的礦化.在& EPS占比為0%時,T1、T5和T9試驗組中3個組分的Fmax值均相對增大,其中C1組分占比增加,而C2組分有所降低,C3組分占比無明顯變化,說明DOP礦化產生了一些可以發熒光的官能團,C2組分代表生物降解來源的類色氨酸物質,與微生物降解產生的芳香性蛋白類結構有關[35],說明βP、ATP和GP 3種DOP礦化后使得其相應的蛋白類組分出現分解.
3 結論
3.1& EPS在前2d對DOP的礦化影響顯著,之后則被溫度取代.溫度升高和& EPS占比增高可促進DOP的礦化;同時ATP表現出較GP和βP更易礦化.25℃時& EPS占比為90%不含As(V)的最佳礦化條件下,3種DOP第6d時的礦化率均達到86.0%以上.
3.2 DOP礦化過程中適宜的溫度能促進藻細胞增殖,使得βP與ATP環境中pH值增高、ORP降低.含As(V)環境中DOP礦化可引起As(V)形態轉化;βP環境中& EPS占比和溫度增高所導致的DOP礦化能促進As的甲基化,而GP和ATP的礦化則伴隨著還原性As(III)的產生,使得As的水生態風險增加.
3.3 DOP礦化會引起水中DOM含量顯著增高,僅DOP時水體DOM以類蛋白質組分為主,而& EPS存在時則以可溶性微生物產物組分為主.
[1] Thompson S K, Cotner J B. Bioavailability of dissolved organic phosphorus in temperate lakes [J]. Frontiers in Environmental Science, 2018,6.
[2] Sutherland D L, Bramucci A. Dissolved organic phosphorus bioremediation from food-waste centrate using microalgae [J]. Journal of Environmental Management, 2022,313:115018.
[3] Worsfold P, McKelvie I, Monbet P. Determination of phosphorus in natural waters: A historical review [J]. Analytica Chimica Acta, 2016, 918:8-20.
[4] Monbet P, McKelvie I D, J Paul, et al. Dissolved organic phosphorus speciation in the waters of the Tamar estuary (SW England) [J]. Geochimica et Cosmochimica Acta, 2008,73(4):1027-1038.
[5] 姜 一,步 凡,張 超,等.土壤有機磷礦化研究進展[J]. 南京林業大學學報(自然科學版), 2014,38(3):160-166.
Jiang Y, Bu F, Zhang C, et al. Research progress of soil organic phosphorus mineralization [J]. Journal of Nanjing Forestry University (Natural Science Edition), 2014,38(3):160-166.
[6] Jiang X, Jin X C, Yao Y, et al. Effects of biological activity, light, temperature and oxygen on phosphorus release processes at the sediment and water interface of Taihu Lake, China [J]. Water Research, 2008,42(8):2251-2259.
[7] Zhao G Y, Du J J, Jia Y, et al. The importance of bacteria in promoting algal growth in eutrophic lakes with limited available phosphorus [J]. Ecological Engineering, 2012,42:107-111.
[8] Bai X L, Zhou Y K, Ye W N, et al. Response of organic phosphorus in lake water to environmental factors: A simulative study [J]. Science of the Total Environment, 2021,785:147275.
[9] F W Y, Yang F, Zhang C, et al. Composition characterization and biotransformation of dissolved, particulate and algae organic phosphorus in eutrophic lakes [J]. Environmental Pollution, 2020,265: 114838.
[10] Ahlgren J, Reitzel K, Brabandere H D, et al. Release of organic P forms from lake sediments [J]. Water Research, 2011,45(2):565-572.
[11] 李英軍,熊善高,魏自民,等.鏡泊湖沉積物中有機磷的礦化特性研究[J]. 東北農業大學學報, 2011,42(8):112-116.
Li Y J, Xiong S G, Wei Z M, et al. Study on mineralization characteristics of organophosphorus in sediments of Jingbo Lake [J]. Journal of Northeast Agricultural University, 2011,42(8):112-116.
[12] Zhu Y R, Wu F C, Feng W Y, et al. Interaction of alkaline phosphatase with minerals and sediments: Activities, kinetics and hydrolysis of organic phosphorus [J]. Colloids and Surfaces A: Physicochemical and Engineering Aspects, 2016,495:46-53.
[13] Yuan R Y, Li J H, Li Y, et al. Formation mechanism of thebloom in the water with low dissolved phosphorus [J]. Marine Pollution Bulletin, 2019,148:194-201.
[14] Zhang T X, Lu X R, Yu R D, et al. Response of extracellular and intracellular alkaline phosphatase into organic phosphorus [J]. Environmental Science and Pollution Research International, 2020,27:42304-42312.
[15] Fitzsimons M F, Probert I, Gaillard F, et al. Dissolved organic phosphorus uptake by marine phytoplankton is enhanced by the presence of dissolved organic nitrogen [J]. Journal of Experimental Marine Biology and Ecology, 2020,530-531:151434.
[16] Nalewajko C, P Thomas, Murphy. Effects of temperature, and availability of nitrogen and phosphorus on the abundance of Anabaena and Microcystis in Lake Biwa, Japan: an experimental approach [J]. Limnology, 2001,2:45–48.
[17] Xu H C, Cai H Y, Yu G H, et al. Insights into extracellular polymeric substances of cyanobacteriumusing fractionation procedure and parallel factor analysis [J]. Water Research, 2013,47:2005-2014.
[18] Yuan H Z, Tai Z Q, Li Q, et al. Characterization and source identification of organic phosphorus in sediments of a hypereutrophic lake [J]. Environmental Pollution, 2020,257:113500.
[19] Wang Z H, Gui H R, Luo Z X, et al. Dissolved organic phosphorus enhances arsenate bioaccumulation and biotransformation in[J]. Environment Pollution, 2019,252:1755- 1763.
[20] Hussain M M, Wang J X, Bibi I, et al. Arsenic speciation and biotransformation pathways in the aquatic ecosystem: The significance of algae [J]. Journal of Hazardous Materials, 2021,403:124027.
[21] Lin S, Litaker R W, Sunda W G. Phosphorus physiological ecology and molecular mechanisms in marine phytoplankton [J]. J Phycol, 2016,52(1):10-36.
[22] GB/5749-2006 生活飲用水衛生標準 [S].
GB/5749-2006 Standards for drinking water quality [S].
[23] GB/3838-2002 地表水環境質量標準 [S].
GB/3838-2002 Surface water environmental quality standard [S].
[24] Zhang S Y, Rensing C, Zhu Y G. Cyanobacteria-mediated arsenic redox dynamics is regulated by phosphate in aquatic environments [J]. Environmental science & technology, 2014,48(2):994-1000.
[25] Yin X X, Chen J, Qin J, et al. Biotransformation and volatilization of arsenic by three photosynthetic cyanobacteria [J]. Plant physiology, 2011,156(3):1631-1638.
[26] Yan C Z, Wang Z H, Luo Z X. Arsenic efflux fromunder different phosphate regimes [J]. PLoS ONE, 2017, 9(12):116099.
[27] Krylov I N, Drozdova A N, Labutin T A. Albatross R package to study PARAFAC components of DOM fluorescence from mixing zones of arctic shelf seas [J]. Chemometrics and Intelligent Laboratory Systems, 2020,207:104176.
[28] Pucher M, Wünsch U, Weigelhofer G, et al. Murphy K, Hein T, Graeber D. staRdom: Versatile Software for Analyzing Spectroscopic Data of Dissolved Organic Matter in R [J]. Water, 2019,11(11):2366.
[29] Wang Z H, Luo Z X, Yan C Z, et al. Impacts of environmental factors on arsenate biotransformation and release inusing the Taguchi experimental design approach [J]. Water Research, 2017,118:167-176.
[30] Xie E, Su Y P, Deng S Q, et al. Significant influence of phosphorus resources on the growth and alkaline phosphatase activities of[J]. Environment Pollution, 2021,268:115807.
[31] Nalley J O, O'Donnell D R, Litchman E. Temperature effects on growth rates and fatty acid content in freshwater algae and cyanobacteria [J]. Algal Research, 2018,35:500-507.
[32] Zhang X Y, Wang Z H, Luo Z X, et al. Insights into the conversion of dissolved organic phosphorus favors algal bloom, arsenate biotransformation and microcystins release of Microcystis aeruginosa [J]. Journal of Environmental Sciences, 2023,125:205-214.
[33] Yang Z, Zhang M, Yu Y, et al. Temperature triggers the annual cycle of Microcystis, comparable results from the laboratory and a large shallow lake [J]. Chemosphere, 2020,260:127543.
[34] Granata G, Onoguchi A, Tokoro C. Preparation of copper nanoparticles for metal-metal bonding by aqueous reduction with d-glucose and PVP [J]. Chemical Engineering Science, 2019,209:115210.
[35] Xie L Q, Xie P, Tang H J. Enhancement of dissolved phosphorus release from sediment to lake water by Microcystis blooms—an enclosure experiment in a hyper-eutrophic, subtropical Chinese lake [J]. Environmental Pollution, 2003,122:391-399.
[36] Chen W, Westerhoff P, Leenheer J A, et al. Fluorescence excitation- emission matrix regional integration to quantify spectra for dissolved organic matter [J]. Environment Science Technology, 2003,37:5701- 5710.
[37] 姚 佳,楊 飛,張毅敏,等.黑藻葉、莖腐解釋放溶解性有機物的特性[J]. 中國環境科學, 2017,37(11):4294-4303.
Yao J, Yang F, Zhang Y M, et al. Characteristics of radiolytic organic matter explained by leaf and stem rot of Hydrilla verticillata [J]. china environmental science, 2017,37(11):4294-4303.
[38] 孫 艷,洪婉婷,韓 陽,等.植物內部磷循環利用提高磷效率的研究進展[J]. 植物營養與肥料學報, 2021,27(12):2216-2228.
Sun Y, Hong W T, Han Y, et al. Research progress of phosphorus recycling in plants to improve phosphorus efficiency [J]. Journal of Plant Nutrition and Fertilizer, 2021,27(12):2216-2228.
Promoting effect of microalgaend its secretions on dissolved organophosphate mineralization.
ZHANG Xiao-yan1, LUO Zhuan-xi2, WANG Zhen-hong1*
(1.School of Chemistry, Chemical Engineering and Environment, Minnan Normal University, Fujian Provincial Key Laboratory of Modern Separation and Analysis Science and Technology, Fujian Provincial Key Laboratory of Pollution Monitoring and Control, Zhangzhou 363000, China;2.School of Chemical Engineering, Huaqiao University, Xiamen 361021, China)., 2023,43(1):341~350
In order to better understand the mineralization process of dissolved organic phosphorus (DOP) and its related influencing factors in the aquatic ecological environment, the typical DOP types (adenosine-5'-triphosphate disodium salt (ATP), sodium β-glycerophosphoric and D-glucose-6-phosphate disodium salt (GP)), temperatures (4, 15 and 25℃), proportions ofand its secretions (& EPS) (0%, 50% and 90%), arsenate (As(V)) concentration (0, 10 and 100μg/L) were selected as the main four environmental factors(three levels for each). The L9(34) orthogonal test was then used to explore the main influencing factors and levels of DOP mineralization process and the main environmental changes during the mineralization process. Results showed that& EPS, as the main influencing factor, could significantly promote the mineralization of DOP at the initial stage (the first 2days), and then was replaced by temperature. Herein the increase of temperature was beneficial to the mineralization of DOP. During the typical DOP mineralization process, the proliferation of algal cells promoted the mineralization of DOP at the optimal temperature(25℃), and caused large fluctuations in pH and ORP in the environment of βP and ATP. The mineralization of DOP in the As(V)-containing environment was accompanied by the transformation of As(V) species. In particular, the production of arsenite (As(III)) was significant in both GP and ATP environments, which could enhance the ecological risk of arsenic. The increased proportion of& EPS promoted the methylation of As(V) in the βP environment. Additionally, the mineralization of individual DOP led to a significant increase in the content of soluble organic matter (DOM) in the environment, which mainly accounted to protein-like components. Meanwhile, the mineralization of DOP combined with& EPS also increased the DOM but with soluble microbial products.The obtain results are of great significance for the comprehensive understanding of the mineralization process of different DOPs in water bodies and the scientific management and control of the ecological risks caused by the outbreak of algal blooms and changes in the water environment.
orthogonal test;organophosphorus mineralization;temperature;;arsenic species
X172
A
1000-6923(2023)01-0341-10
張曉燕(1996-),女,閩南師范大學碩士研究生,研究方向為水環境化學.發表論文1篇.
2011-06-07
國家自然科學基金項目(42177384);福建省自然科學基金資助項目(2020J01804);福建省高校產學合作項目(2022N5002)
* 責任作者, 教授, zhhwang1979@163.com

