依達拉奉對間歇低氧損傷后大鼠腦組織自噬及凋亡的影響
王玲 楊馥宇 黃超
(華北理工大學附屬醫院 1呼吸科,河北 唐山 063000;2眼科)
阻塞性睡眠呼吸暫停低通氣綜合征(OSAHS)主要是間歇性缺氧,可導致多系統損害,尤其是神經系統,備受人們的關注〔1〕。體外動物試驗顯示間歇低氧可導致神經細胞的凋亡,是神經系統損傷的主要機制之一〔2〕。同時間歇低氧可引起神經細胞自噬的出現〔3〕。既往對間歇低氧早期導致神經細胞凋亡及自噬已有相關報道,但罕有應用臨床藥物干預來探討早期間歇低氧損傷后自噬在神經細胞凋亡中發揮作用的研究。本實驗應用臨床上氧自由基清除劑依達拉奉干預,探討依達拉奉對早期間歇低氧大鼠神經細胞自噬與凋亡的影響。
1 材料與方法
1.1主要儀器、試劑 自噬效應蛋白(beclin)-1及微管相關蛋白1輕鏈(LC)3-Ⅱ兔抗鼠多克隆抗體、免疫球蛋白(Ig)G羊抗兔單克隆抗體、PV6001試劑盒均購自欣博盛生物科技有限公司,TUNEL試劑盒由瑞士Roche公司提供,H-7650透射電鏡由日本日立公司提供。
1.2實驗動物及分組 96只雄性Wistar大鼠,采用隨機表法分為對照組、5%間歇低氧(IH)組及依達拉奉(ED)組,每組又分為1 d、3 d、7 d、14 d 4個亞組,每個亞組8只大鼠。
1.3動物模型的制備 5%IH組大鼠實驗箱內首先注入流速為10 L/min的氮氣30 s,使試驗箱內的氧濃度降至5%,半分鐘后注入流速為10 L/min的空氣40 s,使氧濃度至21%,再注入50 s的空氣,流速改變為5 L/min,使氧濃度維持21%。按上述操作,每2 min為1個周期循環。ED組大鼠尾靜脈注射依達拉奉(3 mg/kg),30 min后置于低氧箱內,與IH組大鼠實驗一致。對照組大鼠實驗箱內持續注入流速為3 L/min的空氣,氧濃度保持在21%。以上3組實驗均每日進行8 h,持續進行1 d、3 d、7 d、14 d。
1.4透射電鏡標本制備 實驗結束后,對大鼠進行麻醉及灌注固定術后,于冰上取出海馬組織,修剪成1 mm×1 mm×1 mm大小的組織塊,分別進行預固定(2.5%戊二醛,時間為4 h)、固定(1%鋨酸緩沖液,時間為2 h)。固定結束后,進行脫水、包埋、超薄切片、染色等步驟,最后于電鏡下攝片。
1.5免疫組織化學法檢測蛋白的表達 腦組織經脫水、透明、包埋等步驟后進行切片,供組織化學法應用。按PV法進行組織化學法操作步驟,將切好的完整切片脫蠟、脫水、高壓修復后,分別滴加一抗(beclin-1兔抗大鼠抗體、LC3-Ⅱ兔抗大鼠抗體),4℃冰箱內過夜,滴加二抗等,按二氨基聯苯胺(DAB)顯色試劑盒操作步驟進行顯色后,進行脫水、透明、封片。
1.6Tunel法計算神經細胞的凋亡情況 海馬組織切片進行脫蠟、脫水后經3%濃度的過氧化氫(H2O2)室溫浸泡、TBS溶液漂洗、加入蛋白酶K工作液、TBS溶液漂洗、加入TUNEL工作液、TBS溶液漂洗、加入山羊血清工作液進行封閉、加入POD-轉化液等,按試劑盒操作步驟進行顯色、蘇木素復染、脫水、透明、封片,最后進行攝片。應用Image-Pro Plus 圖像分析軟件進行分析,神經細胞凋亡指數(AI)=凋亡細胞數/總細胞數×100%。
1.7統計學方法 采用SPSS22.0軟件進行單因素方差分析、獨立樣本t檢驗。
2 結 果
2.1透射電鏡觀察海馬CA1區神經細胞的超微結構 對照組神經細胞形態正常,染色質均勻,線粒體、高爾基體等細胞器結構正常;與對照組比較,5%IH組從間歇低氧損傷3 d開始逐漸出現神經元變形腫脹,核膜模糊,染色質密度欠均勻,線粒體空泡化、嵴出現斷裂,激活溶酶體,出現自噬小體,隨著低氧時間的延長,損傷越重;與5%IH組比較,ED組各個時間點神經元超微結構損傷減輕,自噬小體數目增多。見圖1。

圖1 透射電鏡下觀察各組海馬CA1區神經細胞超微結構(×15 000)
2.2免疫組織化學法檢測beclin-1、LC3-Ⅱ蛋白的相對表達 對照組神經細胞beclin-1、LC3-Ⅱ蛋白表達較少,各個時間點差異無統計學意義(P>0.05);與對照組比較,5%IH組及ED組各個時間點神經細胞beclin-1、LC3-Ⅱ的表達量顯著增多(P<0.05);與5%IH組比較,ED組各個時間點神經細胞beclin-1、LC3-Ⅱ的相對表達量顯著增多(P<0.05)。見表1、圖2、圖3。

表1 3組不同時間點beclin-1及LC3-Ⅱ蛋白表達比較

圖2 光學顯微鏡下觀察3組不同時間點beclin-1蛋白的相對表達(免疫組織化學法,×400)
2.3TUNEL法檢測海馬CA1區神經細胞的凋亡情況 對照組海馬CA1區神經細胞凋亡較少,各個時間點AI差異無統計學意義(P>0.05);與對照組比較,5%IH組及ED組各個時間點神經細胞AI顯著增加(P>0.05);與5%IH組比較,ED組各個時間點神經細胞AI降低,差異有統計學意義(P>0.05)。見表2、圖4。
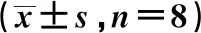
表2 TUNEL法檢測各組神經細胞AI的比較

圖4 光學顯微鏡下觀察各組不同時間點神經細胞凋亡的情況(TUNEL染色,×400)
3 討 論
OSAHS主要是指睡眠過程中反復出現上氣道阻塞,引起睡眠暫停及低通氣,進而導致一系列臨床癥狀及并發癥〔4〕。研究證實間歇低氧可導致神經系統損害,且機制復雜多樣。其中間歇低氧導致神經細胞的凋亡是神經系統受損的重要機制之一〔5〕。細胞凋亡受多種因素的調節,是細胞的程序性死亡,凋亡與自噬密切相關,細胞凋亡受自噬活性的調節〔6〕。在腦缺血、腦創傷等神經損傷中自噬均被激活,進而發揮神經保護作用。beclin-1及 LC3-Ⅱ均是特異的自噬診斷指標,分別是酵母中作為自噬密切相關基因Atg6及Atg8在哺乳動物體內的同源物〔7〕。在對胰腺癌干細胞的研究中發現,間歇性缺氧誘導了自噬相關蛋白beclin-1、LC3-Ⅱ的表達,進而激活自噬〔8〕。本實驗結果同樣顯示,間歇低氧早期促進了大鼠海馬CA1區神經細胞的自噬相關蛋白beclin-1、LC3-II的表達,誘導了自噬的發生。
依達拉奉是臨床常用的一種抗氧化劑及氧自由基清除劑,廣泛應用于腦梗死等多種神經系統疾病,可改善神經系統損傷〔9〕。通過模擬OSAHS發病機制制備間歇低氧模型,發現依達拉奉通過抑制氧化應激對間歇低氧損傷后神經細胞發揮保護作用〔10〕。動物實驗也證實,依達拉奉能明顯減少間歇低氧損傷后神經細胞的凋亡,但依達拉奉對間歇低氧自噬的影響研究尚少,本實驗結果顯示:依達拉奉可提高早期間歇低氧大鼠海馬神經細胞的自噬水平,進而減少神經細胞的凋亡,發揮神經保護作用。這與既往對蛛網膜下腔出血中依達拉奉對大鼠海馬神經元自噬及凋亡影響研究結果一致〔11〕。
綜上所述,間歇低氧早期可導致神經元自噬及凋亡的出現,應用依達拉奉治療后,可提高大鼠海馬神經細胞的自噬水平,進而減少神經細胞的凋亡,發揮神經保護作用,為臨床早期治療OSAHS提供動物實驗證據。

