基于iTRAQ蛋白組技術的沙門氏菌抗酸性機理的研究
張麗君,李琳瓊,尹大成,高瑀瓏
(南京財經大學食品科學與工程學院,江蘇省現代糧食流通與安全協同創新中心,江蘇南京 210023)
沙門氏菌是一種常見的的食源性致病菌,在自然界中分布較廣,在適宜條件下可迅速生長繁殖,引起人類急性、慢性和隱性感染病,如食物中毒和腸胃炎等[1]。在食品的生產、儲運和銷售過程中,沙門氏菌極易反復受到極端溫度、酸、堿、抗生素以及消毒劑等不適生長環境條件的脅迫作用,誘發其產生一系列的適應性變化,達到維持生存的目的[2]。沙門氏菌對食品加工中的消殺措施的適應性變化,潛在地增加了沙門氏菌感染的可能性[3]。已有相關研究表明,大多數微生物在不適生長的環境中會通過特定的抗性蛋白來保證其生存[4]。Chen等[5]研究發現,微生物處于高溫、低溫和高滲等一系列壓力環境下其部分蛋白質的表達會發生變化,來穩定膜結構、維持細胞功能等。
近年來不斷完善的蛋白組學技術已用于研究不同環境壓力下對微生物產生的影響以及微生物在這些脅迫下的應激機制[6]。蛋白質組學是用于研究單個細胞或一種生物所表達全部蛋白質特征的技術,主要包括蛋白的表達水平、翻譯的修飾、蛋白之間的相互作用等[7]。iTRAQ蛋白組技術具有通量高,靈敏度高,可重復性高,定量效果好,結果可靠,適用樣品類別廣泛等優點,是系統研究生物學規律和相關機制的有效工具[8]。Liu等[9]利用iTRAQ蛋白組技術,探討沙雷氏菌在鉻脅迫下的潛在機制,發現差異蛋白主要集中在碳水化合物代謝、應激反應、氨基酸代謝等方面。張佩佩[10]通過對甲型鼠傷寒沙門氏菌進行熱處理,發現其產生抗熱性,利用iTRAQ蛋白組技術分析其在熱脅迫前后產生的差異蛋白,發現5%的差異蛋白參與熱刺激適應,其中DNA連接酶(ligB)、逆境壓力反應蛋白(dps)、分子伴侶(HdeB)以及未知蛋白ACN8920515和ynaF均下調,在熱脅迫適應中發揮作用,使甲型鼠傷寒沙門氏菌在熱脅迫下得以存活。但采用iTRAQ技術從蛋白質組學對鼠傷寒沙門氏菌的抗酸性機制的研究,國內外鮮見相關報道[11]。
本研究以食源致病菌鼠傷寒沙門氏菌為試材,采用iTRAQ技術對鼠傷寒沙門氏菌抗酸性菌株的蛋白組進行了分析,找出酸脅迫處理前后菌體之間的差異表達蛋白,通過GO功能注釋和富集對差異蛋白進行生物過程、分子功能和細胞組分的聚類分析,通過KEGG注釋和富集對差異蛋白參與的通路進行聯合分析,篩選出與菌株抗酸性相關的差異蛋白,并揭示酸脅迫條件下鼠傷寒沙門氏菌在應激反應、雙組分系統、ABC轉運系統和能量代謝等過程中相關蛋白表達的差異,旨在揭示酸脅迫誘導鼠傷寒沙門氏菌產生抗酸性的機理,對優化食品加工條件和建立食品安全控制體系具有重要意義。
1 材料與方法
1.1 材料與儀器
鼠傷寒沙門氏菌CGMCC 1.1190 中國普通微生物菌種保藏管理中心;異丙醇、磷酸、檸檬酸、氯化鉀、磷酸二氫鉀、乙腈、甲酸、三氯乙酸、丙酮、溴化四乙銨、十二烷基硫酸鈉、二硫蘇糖醇、鹽酸、三羥甲基氨基甲烷 南京慧杰誠生物科技有限公司;所有試劑 均為分析純。
SAF-680T型酶標儀、SF-CF-2A型超凈工作臺上海三發科學儀器有限公司;AKTA Purifier 100型純化儀、PHS-3G型pH計 上海儀電科學儀器股份有限公司;Easy nLC 1200型液相色譜儀、Q Exactive型質譜儀 賽默飛世爾科技有限公司;SM-650D型超聲波破碎儀 南京舜碼儀器設備有限公司;GL-21M型高速冷凍離心機 上海市離心機械研究所有限公司;LDZX-50FBS型立式壓力蒸汽滅菌器 上海申安醫療器械廠;GNP-9160型隔水式恒溫培養箱 上海三發科學儀器有限公司;ME55型塞多斯精密電子天平 北京塞多斯天平有限公司;SK-1型快速混勻器 金壇市杰瑞爾電器有限公司。
1.2 實驗方法
1.2.1 菌種活化與預處理 實驗菌株CGMCC 1.1190采用胰蛋白胨大豆肉湯(Trypticase Soy Broth,TSB)培養。供試菌經活化后,接入pH7.2的TSB培養基,于37 ℃、150 r/min搖床振蕩培養18 h,為后續備用。
1.2.2 鼠傷寒沙門氏菌CGMCC 1.1190抗酸性菌株的獲得 pH2.5檸檬酸脅迫處理:將1.2.1中活化的CGMCC 1.1190以體積分數1%轉接至100 mL TSB培養基中,37 ℃振蕩培養18 h,取10 mL培養液離心(5000 r/min,4 ℃,10 min),棄上清,重懸于檸檬酸調節pH2.5的TSB中進行酸脅迫處理,處理30 min,取體積分數為1%經pH2.5檸檬酸脅迫后的CGMCC 1.1190接種于100 mL TSB培養基中,37 ℃振蕩培養18 h,再取10 mL培養液離心(5000 r/min,4 ℃,10 min),取沉淀,重懸于檸檬酸調節pH2.5的TSB中進行酸脅迫處理,處理30 min;以此類推,重復上述搖床振蕩培養和酸脅迫處理12次,后續備用[12]。
1.2.3 蛋白組樣品的制備 將1.2.1中活化的CGMCC 1.1190原始對照菌株及1.2.2節獲得抗pH2.5檸檬酸的菌株分別接種于100 mL TSB中,搖床振蕩培養(37 ℃,150 r/min,24 h),離心(5000 r/min,4 ℃,10 min),取沉淀,將菌體沉淀的離心管置于液氮中,速凍10 min,并標記樣品號為對照組CK1、對照組CK2、處理組T1和處理組T2,置于-80 ℃冰箱保存,備用。
1.2.4 iTRAQ標記 采用SDT裂解法和TCA丙酮沉淀法提取CGMCC 1.1190菌體蛋白[13],用BCA蛋白濃度測定試劑盒測定蛋白樣品濃度。取制備的蛋白樣品各100 μg,用FASP法[14]進行酶解,酶解后采用C18 Cartridge對肽段進行脫鹽,將上述樣品真空冷凍干燥2 h,加入0.1%、40 μL的甲酸溶液復溶肽段。用iTRAQ試劑盒對肽段進行標記,室溫靜置2 h,標記信息分別為:CK1,113;CK2,114;T1,115;T2,116。等量混合經iTRAQ標記的4組肽段樣品,根據強陽離子交換柱法對混合后的肽段進行預分離,之后進行液相分離和質譜分析。
1.2.5 實時熒光定量PCR驗證 本研究選取CGMCC 1.1190菌株酸脅迫前后的8個顯著差異蛋白的對應表達基因進行實時熒光定量PCR驗證和分析。通過在線設計軟件Primer 3.0來設計用于熒光定量PCR的引物,引物見表1。用HiScript? II 1st Strand cDNA Synthesis Kit試劑盒進行CGMCC 1.1190菌體第一鏈cDNA的合成。以cDNA鏈為模板,16S rRNA基因為內參基因,用ChamQTMSYBR? qPCR Master Mix試劑盒進行實時熒光定量PCR反應,采用ABI 7500 PCR分析熒光定量PCR反應中CGMCC 1.1190菌體對照菌株和抗酸菌株樣品中8個待測基因的RNA相對表達含量,對照組為未經過酸處理的CGMCC 1.1190菌體RNA,設其表達水平為1,按照2-△△Ct法計算基因的相對表達量。

表1 RT-qPCR驗證基因及引物設計Table 1 RT-qPCR verification gene and primer design
1.2.6 生物信息學分析 采用Mascot2.2和Proteome Discover1.4對質譜分析原始數據進行查庫鑒定及質量分析[15]。通過對蛋白質相對分子質量、等電點、肽段序列長度、肽段序列覆蓋度等方面來對蛋白質鑒定和定量的結果可信度進行評估。以P≤0.05對差異蛋白進行顯著性篩選,倍數變化大于1.2或小于0.83的蛋白質被定義為差異蛋白,得到CGMCC 1.1190對照菌株和抗酸菌株之間的上調和下調蛋白的數目。
根據抗酸性CGMCC 1.1190菌株顯著差異蛋白的表達特性,采用層次聚類算法對差異表達蛋白質進行分組歸類,以熱圖的形式將表達趨勢相同的基因進行聚類[16],同時與抗酸性CGMCC 1.1190菌株的生物學特性建立關聯,篩選出符合抗酸性生物學特性的蛋白表進行重點研究。采用Blast2Go軟件對CGMCC 1.1190酸脅迫前后篩選出的所有差異表達蛋白質進行GO功能注釋[17],向GO數據庫中對應功能的term映射,計算每個term中差異蛋白質的數量,然后應用Fisher精確檢驗CGMCC 1.1190抗酸性菌株與對照菌株差異蛋白的顯著性[18],找出差異蛋白顯著富集的GO條目,從而對CGMCC 1.1190菌株篩選出的差異蛋白行使的生物學功能進行分析。采用KAAS軟件對CGMCC 1.1190菌株酸脅迫前后篩選出的差異表達蛋白質進行KEGG通路注釋,通過Fisher精確檢驗CGMCC 1.1190抗酸性菌株與對照菌株差異蛋白的顯著性,找出所有顯著差異表達蛋白,并對抗酸性相關代謝的關鍵蛋白進行分析。
2 結果與分析
2.1 鼠傷寒沙門氏菌CGMCC 1.1190蛋白濃度的測定結果
利用BCA法測定所提取總蛋白的濃度,結果見表2。由表2可知,CGMCC 1.1190原始對照菌株(CK1,CK2)提取總蛋白濃度均為2.8 μg/μL,抗pH2.5菌株(T1,T2)提取總蛋白濃度分別為1.7和1.9 μg/μL,提取濃度能滿足后續蛋白組測定相關的要求,樣品的平行性和評價均較好。
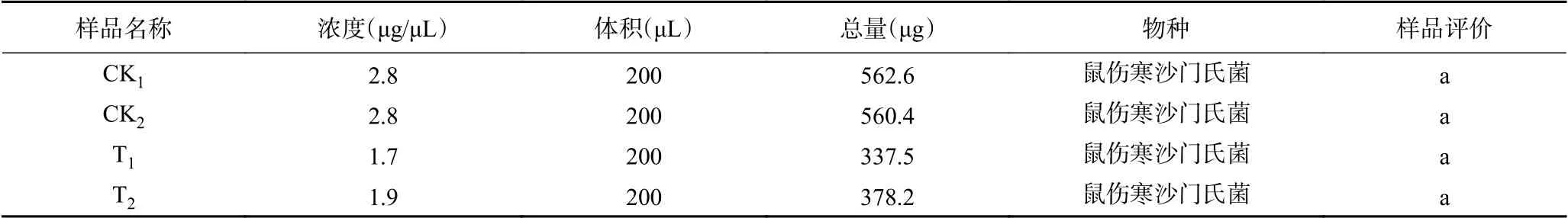
表2 CGMCC 1.1190對照組和抗酸組菌株蛋白質樣品濃度及評價結果Table 2 Concentration and valuation results of protein samples of CGMCC 1.1190 control strain and the acid-resistant strain
2.2 CGMCC 1.1190蛋白表達差異分析
2.2.1 CGMCC 1.1190蛋白表達差異統計 成功鑒定到的蛋白共2373個,已定量的蛋白占99.71%,CGMCC 1.1190對照組和抗酸組的差異蛋白總數為195個,其中包括95個顯著下調蛋白和100個顯著上調蛋白。蛋白質定量差異結果見圖1。
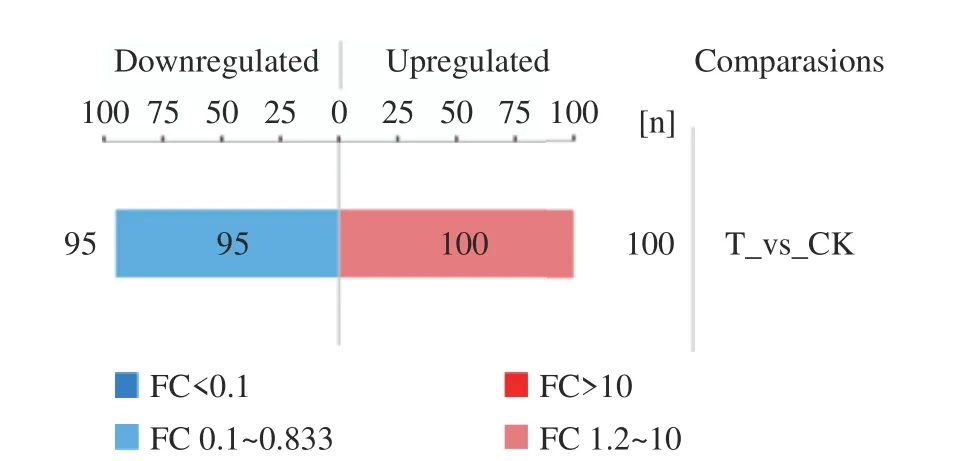
圖1 CGMCC 1.1190對照組和抗酸組菌株的蛋白質定量差異結果柱狀圖Fig.1 Histogram of protein quantitative difference results of CGMCC 1.1190 control strain and the acid-resistant strain
2.2.2 CGMCC 1.1190蛋白表達模式聚類分析 本研究對CGMCC 1.1190對照菌株和抗酸性菌株的差異表達蛋白質進行分析,結果見圖2,橫坐標對樣品進行分析,縱坐標對蛋白質進行分析。從圖2中可以看出組內的數據相似性較高,而組間的數據相似性較低,說明對照組和抗酸組的差異蛋白質表達量變化說明酸脅迫處理對樣本造成的影響顯著,組內平行性較好。100個上調蛋白在CGMCC 1.1190抗酸性菌株中的表達量高于對照菌株,其中,RNA聚合酶σ因子(rpoS)、膜融合蛋白家族蛋白(STM4260)、外膜孔道蛋白(ompC)、鞭毛絲蛋白(fliC)的變化倍數分別為1.83、3.34、2.13、1.88;95個下調蛋白在CGMCC 1.1190抗酸性菌株中的表達量高于對照菌株,其中,LexA阻遏蛋白(lexA)、異檸檬酸脫氫酶(IcdA)、精氨酸脫亞胺酶(arcA)、鳥氨酸氨基甲酰轉移酶(arcB)的變化倍數分別為0.75、0.70、0.55、0.57。
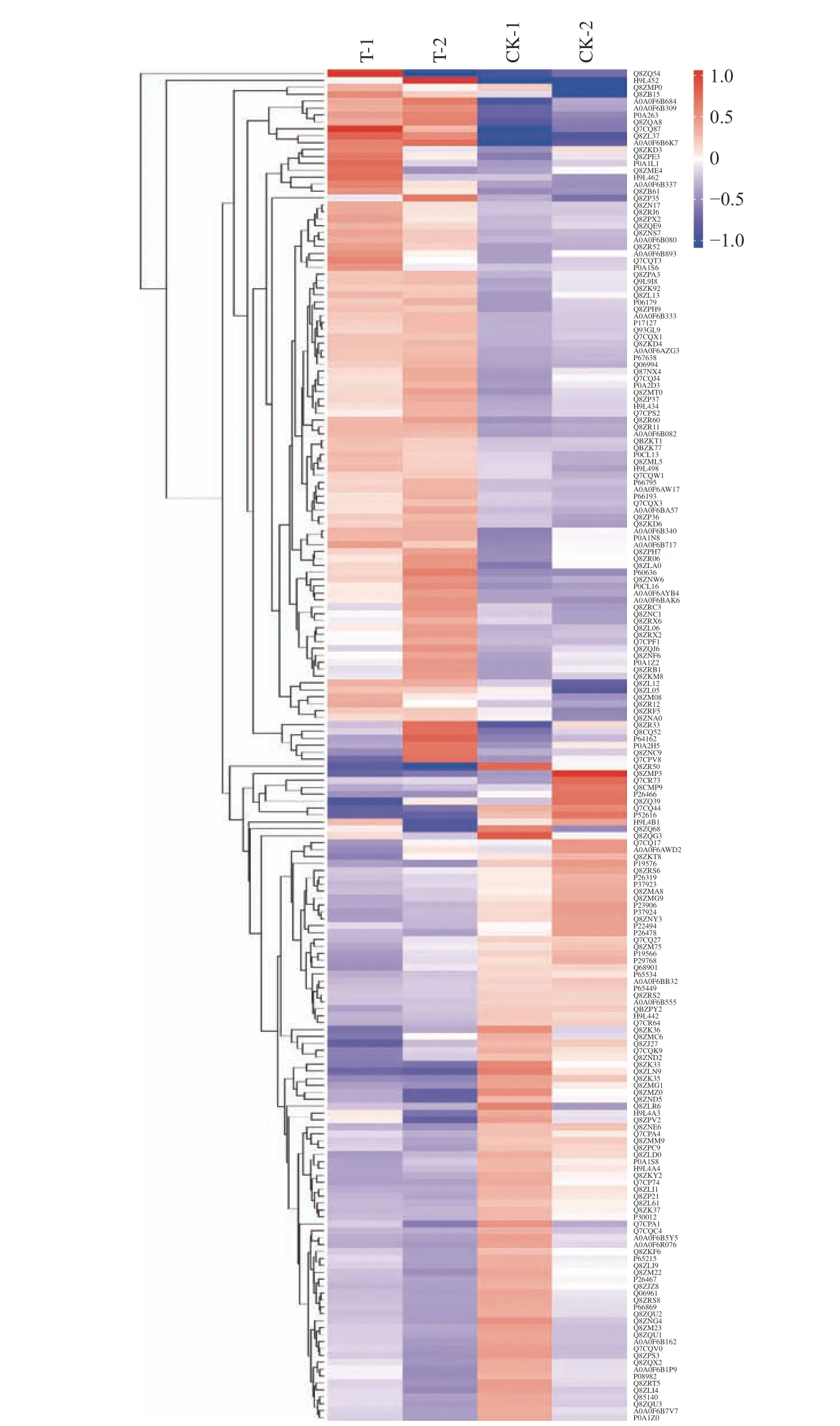
圖2 CGMCC 1.1190對照組和抗酸組菌株的差異蛋白質聚類分析Fig.2 Cluster analysis of differential protein of CGMCC 1.1190 control strain and the acid-resistant strain
2.2.3 CGMCC 1.1190差異表達功能蛋白分類分析本研究對CGMCC 1.1190對照菌株和抗酸性菌株的蛋白質圖譜進行對比分析,得到195個表達差異顯著的相關蛋白。在這些差異蛋白中,大多數蛋白質主要參與CGMCC 1.1190內部調節代謝途徑的生理功能,包括參與應激反應、細胞膜變化、鞭毛合成、轉運系統、雙組份系統相關的蛋白等,表明CGMCC 1.1190抗酸性菌株通過上述代謝途徑相關的蛋白來調控適應酸脅迫環境。在195個顯著差異表達的蛋白中,與應激反應、細胞膜變化、鞭毛合成、轉運系統、雙組份系統相關的蛋白的信息分別見表3~表8。
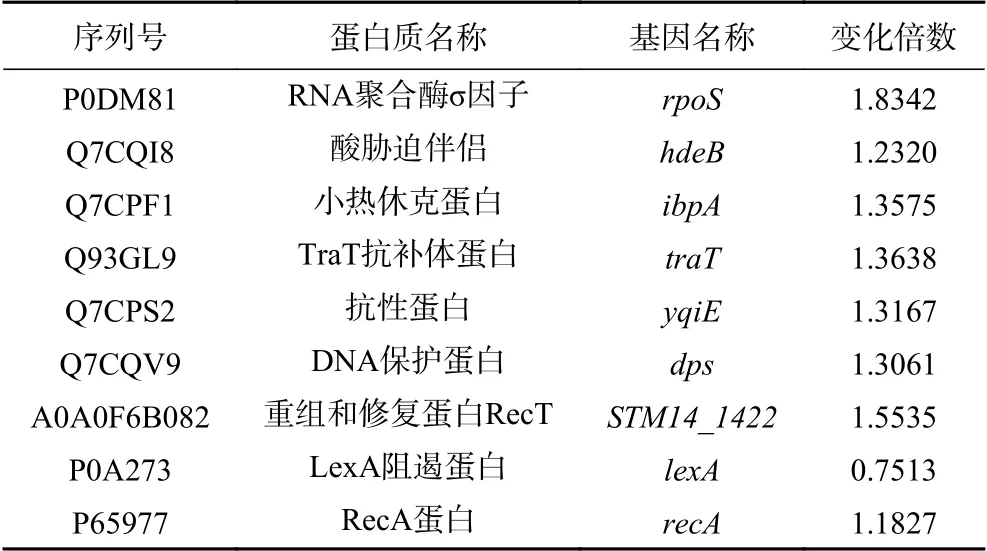
表3 應激相關蛋白信息Table 3 List of protein information related to stress

表8 與能量代謝相關蛋白信息Table 8 List of protein information related to energy metabolism
2.2.4 CGMCC 1.1190差異蛋白的GO富集分析GO分析結果如圖3所示,根據生物過程注釋,差異蛋白主要與菌體內代謝、應激調節反應有關;根據分子功能注釋,差異蛋白主要是各種酶類、修復蛋白以及轉運蛋白;根據細胞組分注釋,差異蛋白主要涉及細胞膜組成蛋白,得到注釋的蛋白中膜蛋白占32.7%。

圖3 CGMCC 1.1190對照組和抗酸組菌株差異表達蛋白質的GO功能注釋及富集分析圖Fig.3 GO function annotation and enrichment analysis map of differentially expressed proteins of Salmonella typhimurium CGMCC 1.1190 control strain and the acid-resistant strain
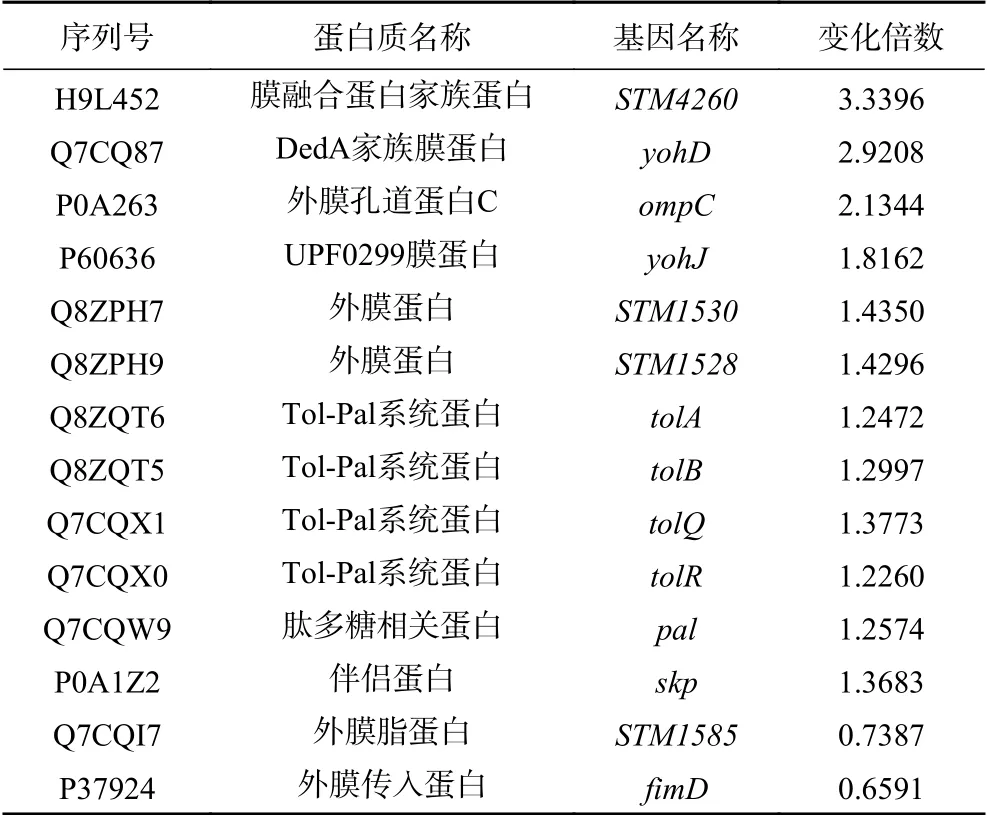
表4 細胞膜相關蛋白信息Table 4 List of protein information associated with membrane

表5 鞭毛相關蛋白信息Table 5 List of protein information related to flagella
2.2.5 CGMCC 1.1190差異蛋白的KEGG生物通路分析 KEGG分析發現CGMCC 1.1190對照菌株和抗酸性菌株的差異蛋白質富集于60條代謝通路上,顯著性分析結果見圖4~圖5。由圖4~圖5可知,CGMCC 1.1190菌株的差異蛋白質主要影響了6個代謝通路,其中雙組分調節系統途徑參與的蛋白質有19個,三羧酸循環途徑參與的蛋白質有10個,碳固定途徑參與的蛋白質有10個,氧化還原途徑參與的蛋白質有7個,丙酮酸代謝途徑參與的蛋白質有7個,ABC轉運系統參與的蛋白質有6個。與CGMCC 1.1190對照菌株相比,抗酸性菌株的蛋白質在雙組分調節系統、三羧酸循環、碳固定等通路差異顯著。

圖4 CGMCC 1.1190對照組和抗酸組菌株差異表達蛋白質的KEGG通路注釋及富集分析圖Fig.4 KEGG pathway function annotation and enrichment analysis map of differentially expressed proteins of CGMCC 1.1190 control strain and the acid-resistant strain
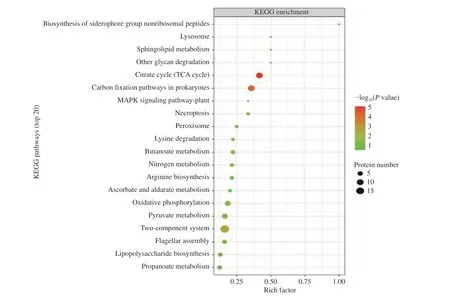
圖5 CGMCC 1.1190對照組和抗酸組菌株差異表達蛋白質的KEGG顯著性分析Fig.5 KEGG significance analysis of differentially expressed proteins between CGMCC 1.1190 control strain and the acid-resistant strain

表6 雙組分系統相關蛋白信息Table 6 List of protein information related to two-component system

表7 ABC轉運系統相關蛋白信息Table 7 List of protein information related to ABC transfer system
2.2.6 CGMCC 1.1190部分差異表達基因的RT-qPCR驗證 為驗證本研究中iTRAQ蛋白組數據的準確性,在經檸檬酸調節pH為2.5的TSB培養基反復脅迫后的CGMCC 1.1190中選取8個差異顯著蛋白(5個上調蛋白和3個下調蛋白),進行RT-qPCR驗證,結果見圖6。8個目的基因的RT-qPCR結果與8個差異蛋白的iTRAQ蛋白組測定結果在表達幅度上有一定的差異,但其表達趨勢基本一致。

圖6 CGMCC 1.1190對照組和抗酸組菌株部分基因的RTqPCR驗證Fig.6 RT-qPCR verification of some genes between CGMCC 1.1190 control strain and the acid-resistant strain
3 討論
3.1 抗酸性鼠傷寒沙門氏菌CGMCC 1.1190與應激相關蛋白的分析
微生物常處于不適的環境中,應激蛋白指大多數菌體在遭受外界壓力時合成的蛋白,在菌體迅速回應逆境等方面發揮重要作用[19]。對比分析CGMCC 1.1190對照菌株和抗酸性菌株的蛋白組,當菌體經過酸脅迫后,RNA聚合酶σ因子(rpoS)蛋白水平上調約1.8倍,其處于調控較上游的位置并控制休克蛋白表達,保護環境壓力下的菌體,對其適應性有調控作用[20]。本研究發現,RNA聚合酶σ因子對CGMCC 1.1190菌體適應酸脅迫環境起到一定的調控作用。熱休克蛋白是一種保護性蛋白,通過參與蛋白的正確折疊、維持細胞骨架等來提高細胞的耐熱等應激能力,使菌體細胞內的生理過程保持穩定[21]。本研究發現,抗酸性CGMCC 1.1190的小熱休克蛋白(ibpA)表達增加,表明其對菌株的耐酸能力也具有一定的調控作用,該調控作用可能與菌株產生耐熱性的過程類似。RecA蛋白和LexA阻遏蛋白是與菌體遭受環境脅迫后與修復機制相關的蛋白,當SOS系統被激活,recA和單鏈DNA會結合生成recA-ssDNA,誘導LexA阻遏蛋白進行自我降解,增加重組酶和聚合酶的表達,修復損傷[22]。本研究發現,抗酸性CGMCC 1.1190的recA蛋白表達增加,lexA阻遏蛋白表達減少,表明在經過酸脅迫后,CGMCC 1.1190抗酸性與菌體內部SOS系統的激活有關,菌體通過相關蛋白的協同作用修復損傷來提高其在酸環境下的生存能力。
3.2 抗酸性CGMCC 1.1190與膜相關蛋白的分析
細菌膜蛋白在其生命活動中起著重要的作用,主要維持細胞膜的完整、流動性、參與菌體內營養物質的運輸以及物質代謝[23]。本研究發現,抗酸性CGMCC 1.1190部分膜蛋白的表達量發生改變,其中ompC基因編碼的外膜孔道蛋白C表達水平顯著上調。戎建榮等[24]發現,在高滲環境中,大腸桿菌通過改變外膜孔道蛋白C的表達水平減少膽鹽滲入菌體細胞;受到抗菌藥物脅迫的細菌,其外膜孔道蛋白C蛋白表達有助于降低菌體內抗菌藥物的濃度、增加耐受力。本研究結果表明外膜孔道蛋白C對CGMCC 1.1190的抗酸性起到一定的調控作用,通過改變細胞膜的通透性,如降低細胞膜對H+的通透性來幫助細菌適應酸脅迫環境。Tol-Pal系統是革蘭氏陰性菌高度保守的膜蛋白系統之一,主要由Tol-Pal系統蛋白(tolB)、肽多糖相關蛋白(pal)、Tol-Pal系統蛋白(tolA)、Tol-Pal系統蛋白(tolR)和Tol-Pal系統蛋白(tolQ)組成,其中tolA、tolQ和tolR構成細菌的內膜蛋白,tolB和pal構成細菌外膜復合體,Tol-Pal系統維持革蘭氏陰性菌細胞膜的完整性和穩定性。Prouty等[25]研究發現,鼠傷寒沙門氏菌耐受膽鹽的能力與Tol-Pal系統的調控有關。本研究CGMCC 1.1190抗酸性菌株Tol-Pal系統蛋白均上調,表明酸脅迫后CGMCC 1.1190產生的抗酸性與其Tol-Pal膜蛋白系統的調控有關,可能通過增加細胞膜的完整性和穩定性來幫助其抵抗并適應極端酸脅迫環境。因此,膜蛋白表達量的變化可能是CGMCC 1.1190酸脅迫菌株比原始菌株更抗酸的原因之一。
3.3 抗酸性CGMCC 1.1190與鞭毛相關蛋白的分析
細菌的鞭毛是一種位于菌體表面的細絲狀蛋白質附屬物,主要與細菌的運動性和大分子蛋白質的轉運有關[26]。Duan等[27]通過對比研究大腸桿菌fliC基因缺失株的運動能力和侵襲能力,發現大腸桿菌fliC缺失株的運動能力和侵襲能力顯著低降低。本研究發現,抗酸性CGMCC 1.1190的鞭毛相關差異蛋白均上調,其中鞭毛絲蛋白(fliC)上調約1.9倍,表明抗酸性CGMCC 1.1190的運動能力對其抗酸性有重要影響。細菌鞭毛蛋白調控的運動性也是生物被膜形成初期和成熟期的決定性因素,大腸桿菌運動性的強弱與生物被膜形成能力呈正相關[28]。這與本研究結果一致,表明鞭毛蛋白調控的運動性增強可以促進菌體形成具有抵抗能力的生物被膜。本研究中鞭毛相關蛋白表達的變化表明抗酸性CGMCC 1.1190可能通過調控鞭毛蛋白的表達來增強運動能力,促進生物被膜的形成,使其抗酸性增強。
3.4 抗酸性CGMCC 1.1190與雙組分系統相關蛋白的分析
雙組分系統(Two-Component System,TCS)是存在于細菌內的一種信號傳導系統,與細菌的群體感應、致病性、耐藥性、毒力因子表達和生物被膜生成等生物學功能密切相關,是細菌適應環境變化并響應多種刺激的一種調節機制[29]。TCS與細菌的群體感應有關,群體感應是細菌之間信號傳遞的重要機制,當細胞密度增加達到一定閾值,細菌通過信號傳遞影響特定基因的表達,來調控微生物群體的生理特征[30]。何綠琴[31]通過構建轉錄調控蛋白(qseB)/感應蛋白(qseC)缺失株,發現副豬嗜血桿菌生物膜生成能力降低,抵御不良環境能力減弱,毒力下降。雙組分系統組氨酸激酶傳感蛋白(envZ)/DNA結合雙轉錄調節因子(ompR)主要與細菌的滲透調節相關,通過對膜孔道蛋白進行正向或負向的調控來影響膜內外離子轉運、平衡滲透壓力[32]。雙組分系統精氨酸脫亞胺酶(arcA)/鳥氨酸氨基甲酰轉移酶(arcB)對厭氧和需氧生長下細菌的呼吸代謝、生物合成和運動能力有調控作用,主要影響菌體的能量代謝過程。武珊珊[33]研究發現沙門氏菌arcA/arcB缺失株對氨基糖苷類抗生素的抗性有所提高,但其引起的耐藥性變化的機理尚未闡明。本研究發現,抗酸性 CGMCC 1.1190雙組分系統病毒性傳感器組氨酸激酶(phoP)/病毒性轉錄調節蛋白(phoQ)、qseB/qseC、envZ/ompR的蛋白水平均上調,雙組分系統arcA/arcB蛋白水平下調,表明CGMCC 1.1190雙組分系統與其抗酸性調控具有密切關系。
3.5 抗酸性CGMCC 1.1190與ABC轉運系統相關蛋白的分析
ABC轉運系統相關蛋白是指含有ATP結合區域的蛋白,主要功能包括營養物質的轉運和排出有害物質等[34]。謝騰飛[35]研究發現,冷脅迫后的副溶血性弧菌通過抑制ABC轉運蛋白的量來保護菌體免于低溫損傷。MalEFGK是位于菌體內膜上的ABC轉運蛋白復合體,麥芽糖/麥芽糊精導入ATP結合蛋白(malK)負責與運輸系統的能量偶聯;麥芽糖/麥芽糊精運輸系統滲透酶蛋白(malF)負責跨膜轉運;麥芽糖/麥芽糊精結合周質蛋白(malE)是麥芽糖攝取的關鍵,參與麥芽糖的ABC運輸系統[36]。本研究發現,CGMCC 1.1190抗酸性菌株的菌體中構成MalEFGK復合物的3種蛋白(malK、malF、malE)表達水平均下調,表明CGMCC 1.1190在酸脅迫后可能通過改變細胞膜的通透性和控制轉運物質來保護菌體、抵抗不良環境。
3.6 抗酸性CGMCC 1.1190與能量代謝相關蛋白的分析
微生物代謝需要的能量是菌體在酶的作用下通過其細胞內一系列氧化還原反應產生的,微生物提供能量的途徑以三羧酸循環和糖酵解為主,能量代謝的正常進行是保證菌體正常生長的必要條件[37]。本研究探討CGMCC 1.1190抗酸性菌株的蛋白組,發現參與三羧酸循環的蛋白表達多上調,包括異檸檬酸脫氫酶(IcdA)、異檸檬酸裂解酶(aceA)、檸檬酸裂合酶(citG)等,表明CGMCC 1.1190菌體在適應酸脅迫環境時消耗了大量能量來維持自身正常的生理代謝。本研究發現, 抗酸性CGMCC 1.1190丙酮酸分解代謝途徑的磷酸烯醇式丙酮酸碳羧化酶(PckA)活躍,說明其分解產生了更多能量以維持酸脅迫下菌體細胞的穩態。此外,本研究還發現,CGMCC 1.1190菌體內氨基烷基膦酸酯N-乙酰轉移酶(phnO)上調,該路徑可以促進CoA生成。有研究報道,當生物體遭受外界脅迫作用,可以通過CoA激活體內的免疫應答來抵抗外部脅迫[38]。由此推測,酸脅迫下CGMCC 1.1190菌體內的CoA的表達變化激活了菌體內的應激反應,導致抗酸性增加。
4 結論
本實驗通過ITRAQ蛋白組技術對鼠傷寒沙門氏菌CGMCC 1.1190在經檸檬酸調節pH為2.5的TSB基質中進行多次酸脅迫處理后的差異表達蛋白進行研究,共檢測到2373個蛋白,其中195個差異蛋白,包括95個顯著下調蛋白和100個顯著上調蛋白。通過對CGMCC 1.1190菌株的差異蛋白進行GO分析和KEGG分析,發現抗酸性菌株高表達應激蛋白相關基因,可以通過合成一些應答外界刺激的蛋白質來幫助CGMCC 1.1190增強抗酸性;高表達細胞膜相關蛋白來增加CGMCC 1.1190菌體細胞膜的完整性;高表達鞭毛相關蛋白來增強CGMCC 1.1190菌體的運動能力和增加保護性生物被膜的形成;高表達雙組分系統相關蛋白來響應酸信號,通過調控酸激蛋白的產生增強CGMCC 1.1190菌體的抗酸性;低表達ABC轉運系統相關蛋白來降低細胞膜對H+的通透性,達到保護菌體的作用;高表達能量代謝途徑相關蛋白來為CGMCC 1.1190菌體應對酸脅迫提供能量、維持穩態。綜上可知,CGMCC 1.1190在經過pH2.5的檸檬酸脅迫,能通過蛋白水平的表達變化啟動一系列應答機制并生存下來。

