δ-葡萄糖酸內酯添加量對豆腐凝膠特性的影響
楊雅婧,張志衡,琚魏波,李玉娥,陳振家
(山西農業大學 食品科學與工程學院,山西 晉中 030801)
大豆(Glycinemax(Linn.) Merr.),豆科大豆屬,在全世界范圍內均有種植。大豆中有35%~40%的蛋白質,是良好的蛋白質來源之一,脂類約占20%,還含有約9%的膳食纖維[1]。已證明大豆中的蛋白質、異黃酮、皂甙和蛋白酶抑制劑等生物活性物質在調節人體生理功能和預防慢性疾病方面起著重要作用[2]。豆腐作為一種傳統豆制品,由于其熱量較低而在全球范圍內廣受歡迎。研究表明,豆腐可以潛在地降低心血管疾病、高血壓、糖尿病和其他疾病的風險[3]。隨著豆腐形成理論的確認和現代食品加工技術的發展,豆腐產品的多樣性滿足了不同的消費需求。
豆腐的生產過程中點漿是最關鍵的一步,即在豆漿中添加不同的凝固劑使其發生凝固[4]。內酯豆腐是加入GDL這種酸類凝固劑形成的,GDL在豆漿中溶解,釋放出葡萄糖酸,由于H+釋放速率相對緩慢,蛋白質表面的靜電斥力減弱,蛋白質網絡結構形成緩慢,有助于形成細膩均勻的結構[5],因此制作出的內酯豆腐爽口滑嫩、質地細膩,深受消費者喜愛。
然而長期以來,我國內酯豆腐生產企業大多生產模式較粗放,凝固劑的用量依靠經驗確定,這些因素會導致內酯豆腐品質極不穩定,無法進行標準化生產。基于此,通過對不同GDL添加量形成的內酯豆腐品質進行檢測與分析,研究GDL添加量與內酯豆腐凝膠特性的相關性,以期為豆制品的工業化生產提供一定的參考。
1 材料和方法
1.1 材料
市售大豆樣品:綏化市正大米業有限公司;市售δ-葡萄糖酸內酯:安琪酵母股份有限公司。
1.2 試劑
考馬斯亮藍G-250、SDS、β-巰基乙醇、溴酚藍、低分子量蛋白質Marker(14.4~97.4 ku)、Tris:北京索萊寶科技有限公司;甲叉雙丙烯酰胺、無水乙醇、甘氨酸、甘油:生工生物工程(上海)股份有限公司;氯化鈉、尿素、鹽酸、羅丹明:國藥集團化學試劑有限公司。所有試劑均為分析純,均用普通蒸餾水配制。
1.3 主要儀器與設備
九陽JYL-G12E型榨汁攪拌機;華帝TLSK-22GB01型電陶爐;HH型數顯恒溫水浴鍋 金壇市科析儀器有限公司;TMS-Pro型質構儀 Food Technology Corporation;TCS SP8型激光掃描共聚焦顯微鏡 德國徠卡(Leia)儀器公司;HC-2064型高速離心機 安徽中科中佳科學儀器有限公司;UV-1200型可見分光光度計 上海菁華科技儀器有限公司;DYY-7C型電泳儀 北京六一儀器廠;Tensor 27傅里葉變換紅外光譜儀 德國布魯克(Bruker)公司。
1.4 方法
1.4.1 內酯豆腐的制備
大豆浸泡12 h,按1∶5的比例與水磨漿,過200目篩,取豆漿煮沸5 min[6],冷卻至85 ℃,在豆漿pH為6.5的條件下分別按照豆漿0.2%、0.3%、0.4%的比例添加GDL,于85 ℃水浴鍋中恒溫1 h取出。
1.4.2 內酯豆腐質構性的測定
將豆腐切成長方體(4 cm×4 cm×1 cm),采用質構儀測定[7],重復10次。
1.4.3 內酯豆腐含水量及保水性的測定
含水量(MC)參照GB 5009.3-2016《食品安全國家標準 食品中水分的測定》中的直接干燥法[8]進行測定。
參考王睿粲[9]的方法。離心管內管底部為網狀,放一張濾紙于內管中,記濾紙和內管的質量為m1,稱取豆腐約1 g于內管中,記此時內管質量為m2,離心管在3 500 r/min下離心10 min后,記內管質量為m3,其保水性通過下式計算:
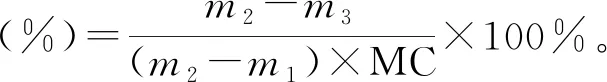
1.4.4 內酯豆腐凝膠作用力的測定
參考Gómez-Guillén等[10]的方法。采用考馬斯亮藍法測定。
1.4.5 SDS-PAGE
參考Lars等[11]的方法。稱取5 mg固體樣品加入處理液中,液體樣品的蛋白濃度為1 mg/mL,分離膠濃度為12%,濃縮膠濃度為5%,上樣量為6 μL。
1.4.6 傅里葉變換紅外光譜分析
參照Shin等[12]的方法。將凍干樣品與KBr按1∶100研磨,壓成透明片狀后測定,利用PeakFit軟件計算二級結構的相對含量。
1.4.7 內酯豆腐微觀結構的測定
參考Kuipers等[13]的方法。將1 mL 0.2%羅丹明溶液加入100 mL豆乳中,分別配制0.2%、0.3%、0.4% GDL添加量的混合溶液,振蕩均勻后取10 μL滴在載玻片上,蓋上蓋玻片,并滴加少量指甲油防止水分蒸發,包裹錫紙,在90 ℃保溫箱中保溫1 h,冷卻至室溫,避光放置,通過激光共聚焦顯微鏡進行觀察,激發波長設置為543 nm,測定范圍為580~700 nm。
1.4.8 數據處理
利用Origin 8.0和Excel軟件統計分析數據并作圖,用SPSS軟件分析不同處理間的差異性,顯著水平為P<0.05。
2 結果與分析
2.1 GDL添加量對豆腐質構性的影響
質構性是評價豆腐感官特性的重要指標之一,在測定過程中,模擬施加的食物在口腔中的咀嚼過程,選取以下4個參數:硬度、內聚性、彈性和咀嚼性[14]。由表1可知,隨著GDL添加量的增加,內酯豆腐的彈性、硬度和咀嚼性均呈上升趨勢,內聚性先降低后升高。表明隨著GDL添加量的增加,H+釋放增多,進一步降低豆漿水溶性蛋白體系的pH值,使大豆蛋白H+電離程度降低,進而削弱大豆蛋白的水合能力,促使大豆蛋白失去水化膜而發生聚集[15]。GDL添加量的增加也導致更多的蛋白質參與豆腐凝膠的形成,進而形成更加完善的凝膠三維網絡結構,這是導致內酯豆腐的硬度、彈性和咀嚼性增加的原因[16]。
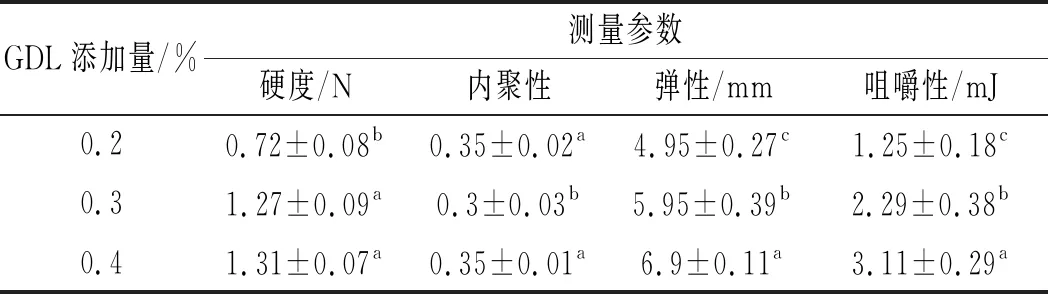
表1 GDL添加量對豆腐質構性的影響Table 1 Effect of GDL addition amount on the texture properties of tofu
2.2 GDL添加量對豆腐含水量與保水性的影響
含水量指食物中水分所占比例;保水性指蛋白質保留住水分的能力,隨著豆腐保水性的增加,其得率也增加,豆腐品質得到提升[17]。由圖1可知,內酯豆腐的含水量很高,均在90%左右,當GDL添加量為0.2%時含水量最高,達到91.78%,隨著GDL添加量的增加,含水量逐漸降低;GDL添加量對豆腐保水性的影響很大,內酯豆腐的保水性隨著GDL添加量的增加呈逐漸上升趨勢,0.4%內酯豆腐的保水性最高,達到83.38%。
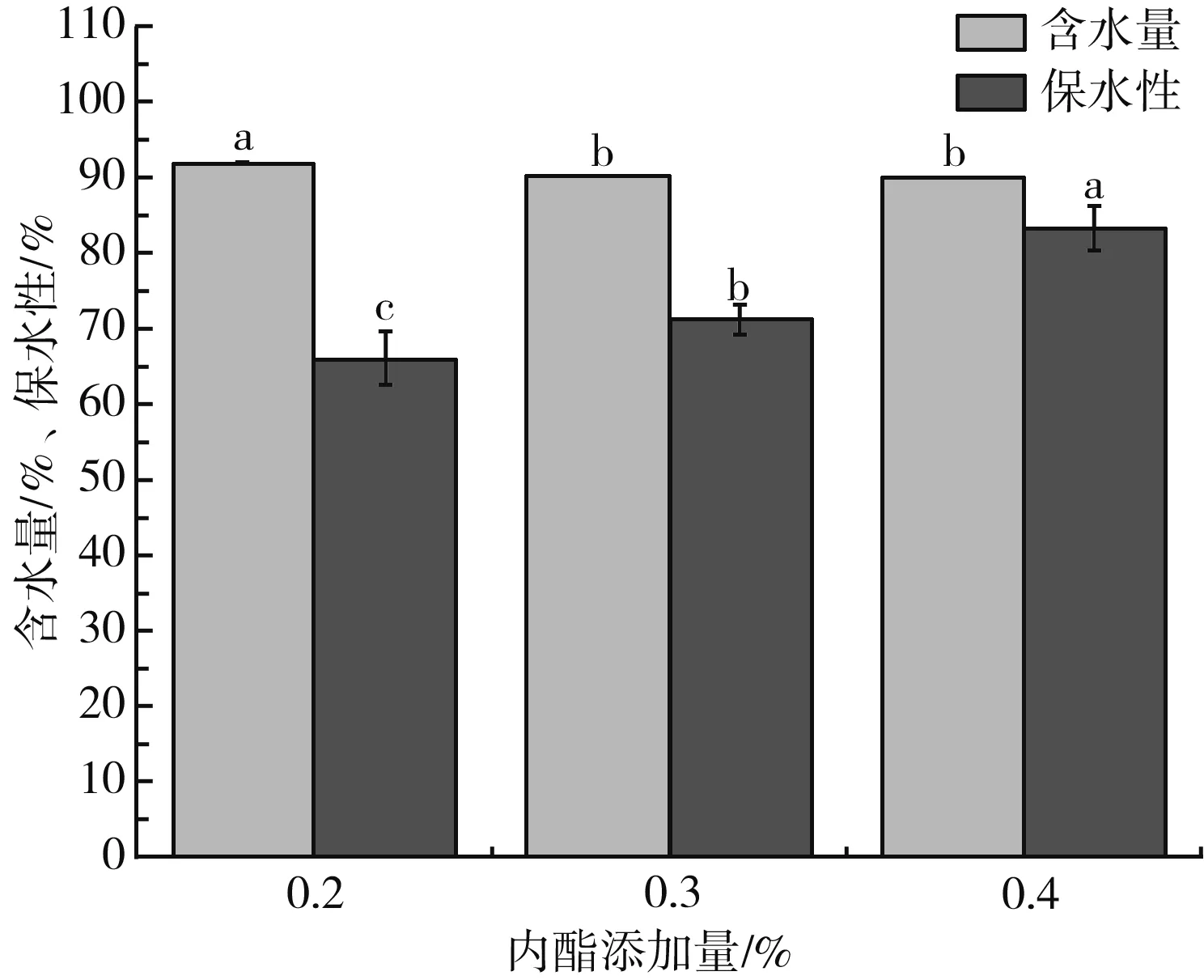
圖1 GDL添加量對豆腐含水量和保水性的影響Fig.1 Effect of GDL addition amount on water content and water retention of tofu
GDL添加量的增加會促進豆漿中蛋白質的聚集,而聚集程度的增加會加速豆腐凝膠網絡形成的速率,導致部分水分從凝膠網絡中析出[18]。因此,隨著GDL添加量的增加,內酯豆腐的含水量逐漸降低,此外,GDL添加量會促進更多蛋白質參與凝膠形成和凝膠網絡的充分形成,加大對凝膠網絡內部水分的束縛,進而內酯豆腐的保水性隨著GDL添加量的增加呈逐漸上升趨勢[19]。
2.3 GDL添加量對豆腐凝膠作用力的影響
在豆腐制備過程中大豆蛋白的凝膠化過程較為復雜,包括通過熱變性暴露疏水基團,通過蛋白質締合聚集,以及通過疏水和電荷相互作用凝結,形成三維網狀結構[20]。內酯豆腐中維持凝膠結構的分子間作用力主要包括氫鍵、離子鍵、疏水相互作用和二硫鍵,這些作用力使得凝膠達到平衡狀態[21]。由圖2可知,0.2%內酯豆腐的凝膠作用力貢獻大小排序為:疏水作用>二硫鍵>氫鍵>離子鍵,0.3%內酯豆腐的凝膠作用力貢獻大小排序為:疏水作用>二硫鍵>離子鍵>氫鍵,0.4%內酯豆腐的凝膠作用力貢獻大小排序為:疏水作用>氫鍵>二硫鍵>離子鍵,隨著GDL添加量的增加,內酯豆腐的疏水作用有一定增加,離子鍵和二硫鍵先增加后減少,而氫鍵則先減少后增加,由于豆漿中的蛋白質全部參與了內酯豆腐凝膠結構的形成,因此作用力的測定結果說明,增加GDL添加量后,更多的蛋白質通過疏水作用結合到凝膠網絡結構中,改變了內酯豆腐中凝膠作用力的比例。
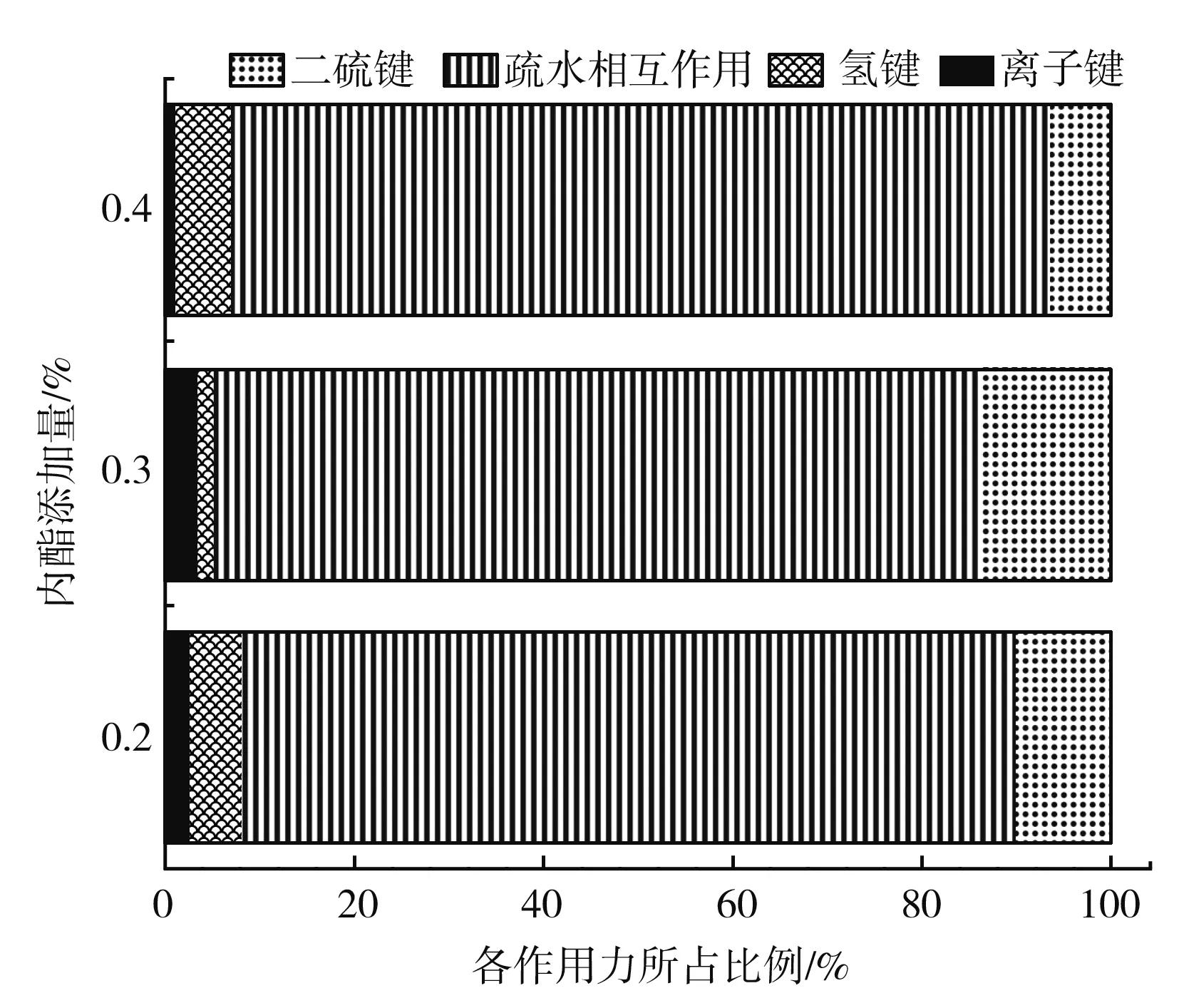
圖2 GDL添加量對豆腐中凝膠作用力組成的影響Fig.2 Effect of GDL addition amount on gel force composition of tofu
在豆腐形成過程中,大豆蛋白在豆漿煮制過程中已經得到充分變性,變性后的蛋白疏水基團充分暴露,此時豆漿中蛋白已經具備足夠的聚集趨勢,但蛋白與水分之間的水合狀態在氫鍵作用下得以保持[22]。而隨著內酯的添加,在改變pH值的同時,破壞蛋白質的水合狀態,引發蛋白聚集。因此,GDL的添加促進更多的蛋白質通過疏水作用力形成并構建凝膠三維網絡結構[23]。
2.4 SDS-PAGE
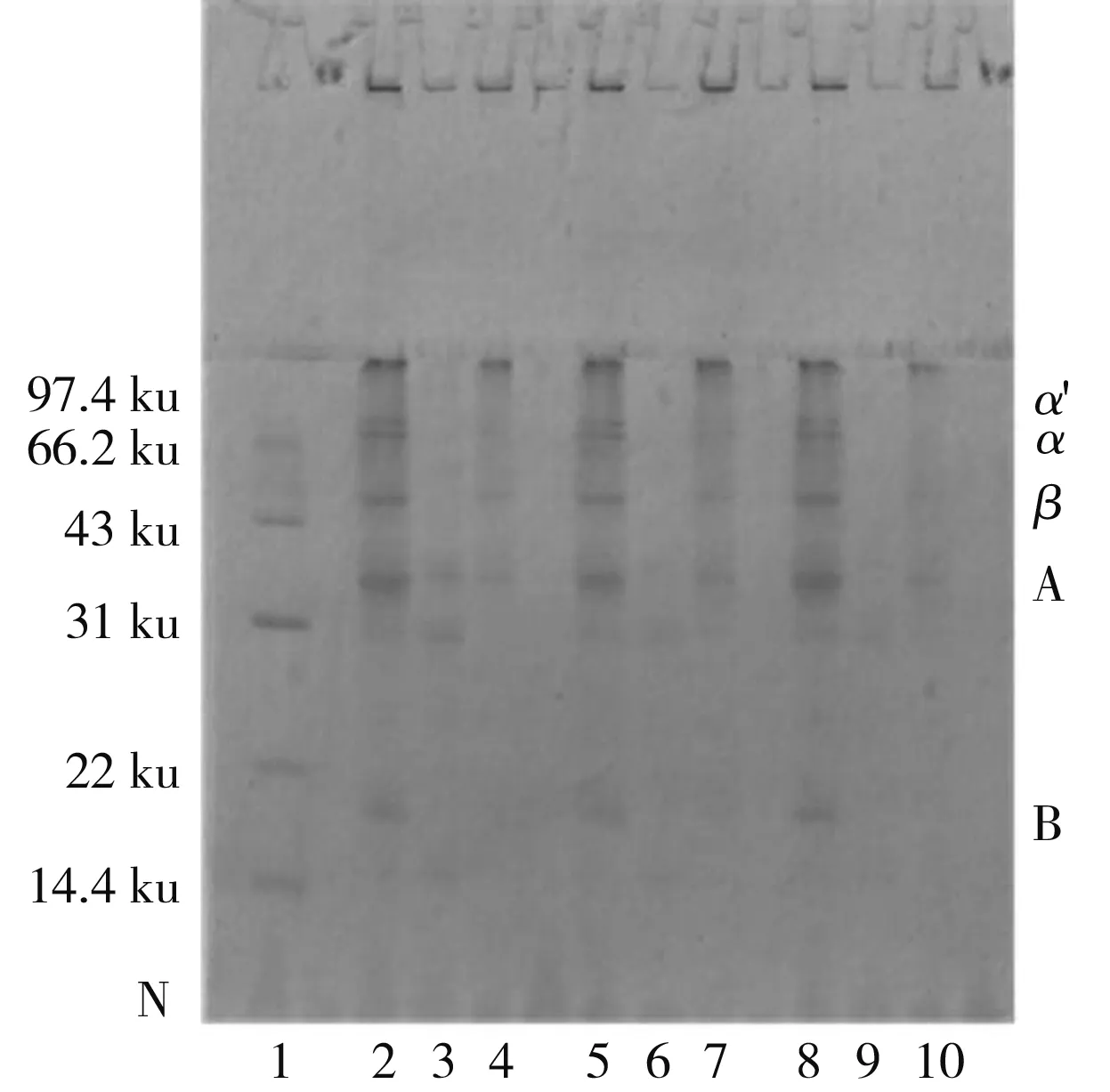
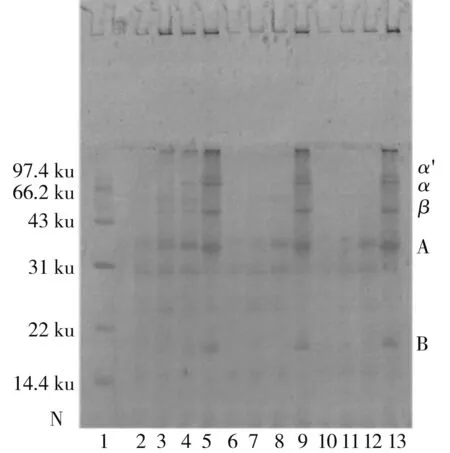
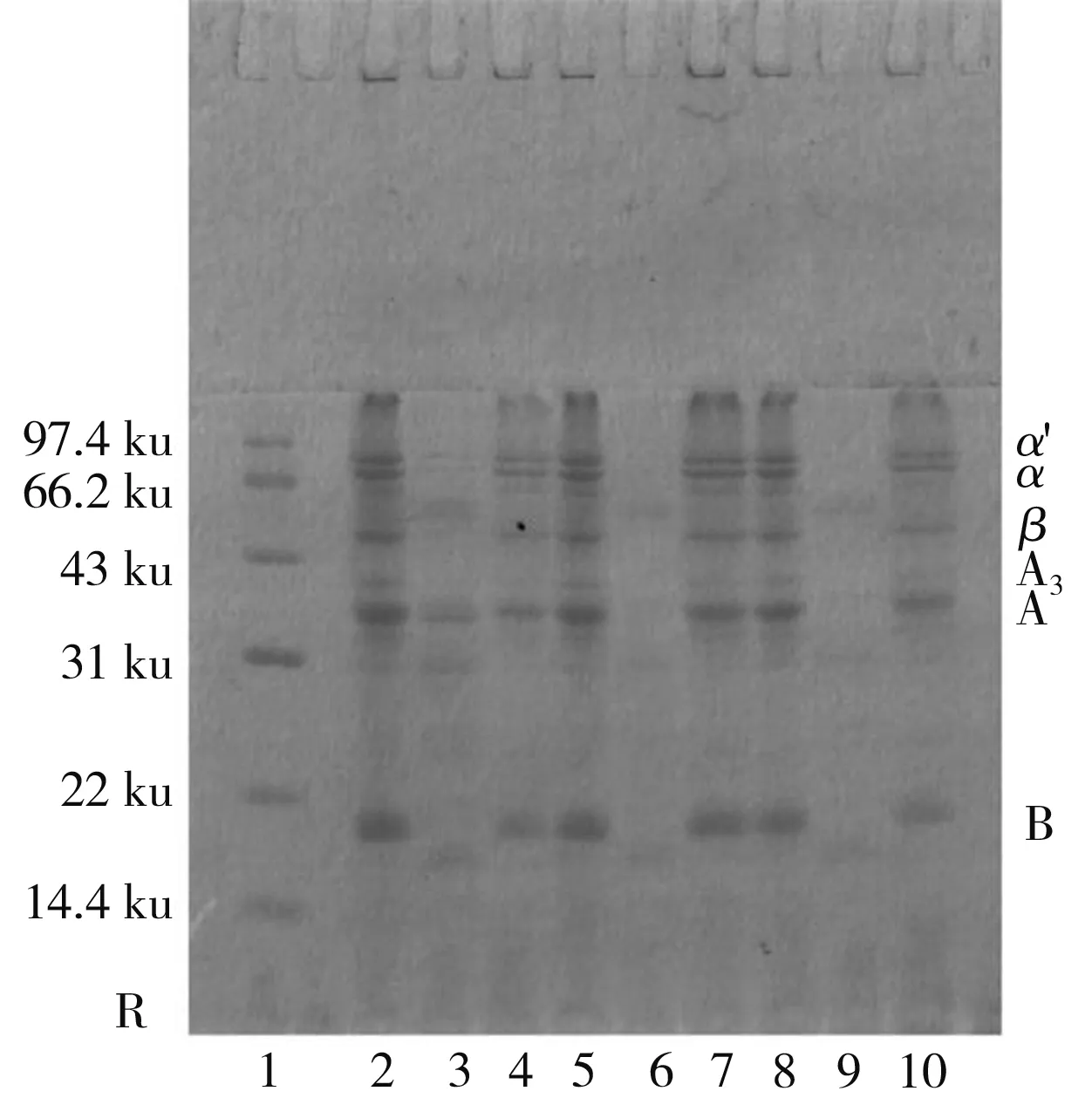
由圖3中a可知,內酯豆腐中的亞基組成主要包括11S的A、B亞基和7S的α、α′、β亞基,以及部分大分子聚集體(>100 ku),豆腐中可溶性蛋白含量很少且主要由11S亞基組成,不溶性蛋白主要由7S亞基組成,且隨著GDL添加量的增加,可溶性蛋白的亞基條帶逐漸減少,說明蛋白質向凝膠轉化的趨勢增大;由圖3中b可知,內酯豆腐在SA、SB、SC、SD 4種溶液中的亞基條帶逐漸增加,尤其以SC、SD溶液中的變化最為明顯,說明疏水作用是內酯豆腐中主要作用力,而離子鍵和氫鍵在豆腐中的占比較少,SA、SB、SC溶液中以11S的A亞基條帶為主,說明離子鍵和氫鍵主要參與了11S凝膠網絡的形成,SD中7S條帶大幅增加,11S亞基條帶也有所加深,說明疏水作用主要參與7S凝膠的形成,同時對11S凝膠的形成也有一定的貢獻,增加GDL添加量后,SB、SC溶液7S亞基逐漸消失,離子鍵和氫鍵的占比降低;對比圖3中a、c和b、d發現,加入β-巰基乙醇后,電泳圖中出現了新的亞基(A3),11S的B亞基條帶明顯加深,且大分子聚集體條帶變淺,說明內酯豆腐中的部分11S和大分子聚集體通過二硫鍵結合。
a
b
c

d
2.5 紅外光譜測定結果
大豆蛋白質凝膠體系與其二級結構密切相關,通過傅里葉變換紅外光譜對豆腐中蛋白質的二級結構進行測定,能夠反映出GDL添加量對豆腐中蛋白質聚集狀態的影響[24]。紅外光譜圖上不同波峰對應不同的基團,例如3 250~3 400 cm-1是羥基基團,脂肪族氨基酸殘基分別在2 800~3 000 cm-1和1 440~1 465 cm-1附近歸屬于C-H拉伸和彎曲模式,蛋白質的紅外吸收帶主要有3個,其中酰胺Ⅰ帶(1 600~1 700 cm-1)對研究二級結構最重要,蛋白質的二級結構主要包括β-折疊、無規則卷曲、α-螺旋及β-轉角,分別對應1 600~1 640 cm-1、1 640~1 650 cm-1、1 650~1 660 cm-1和1 660~1 700 cm-1[25]。
內酯豆腐的紅外光譜圖見圖4。
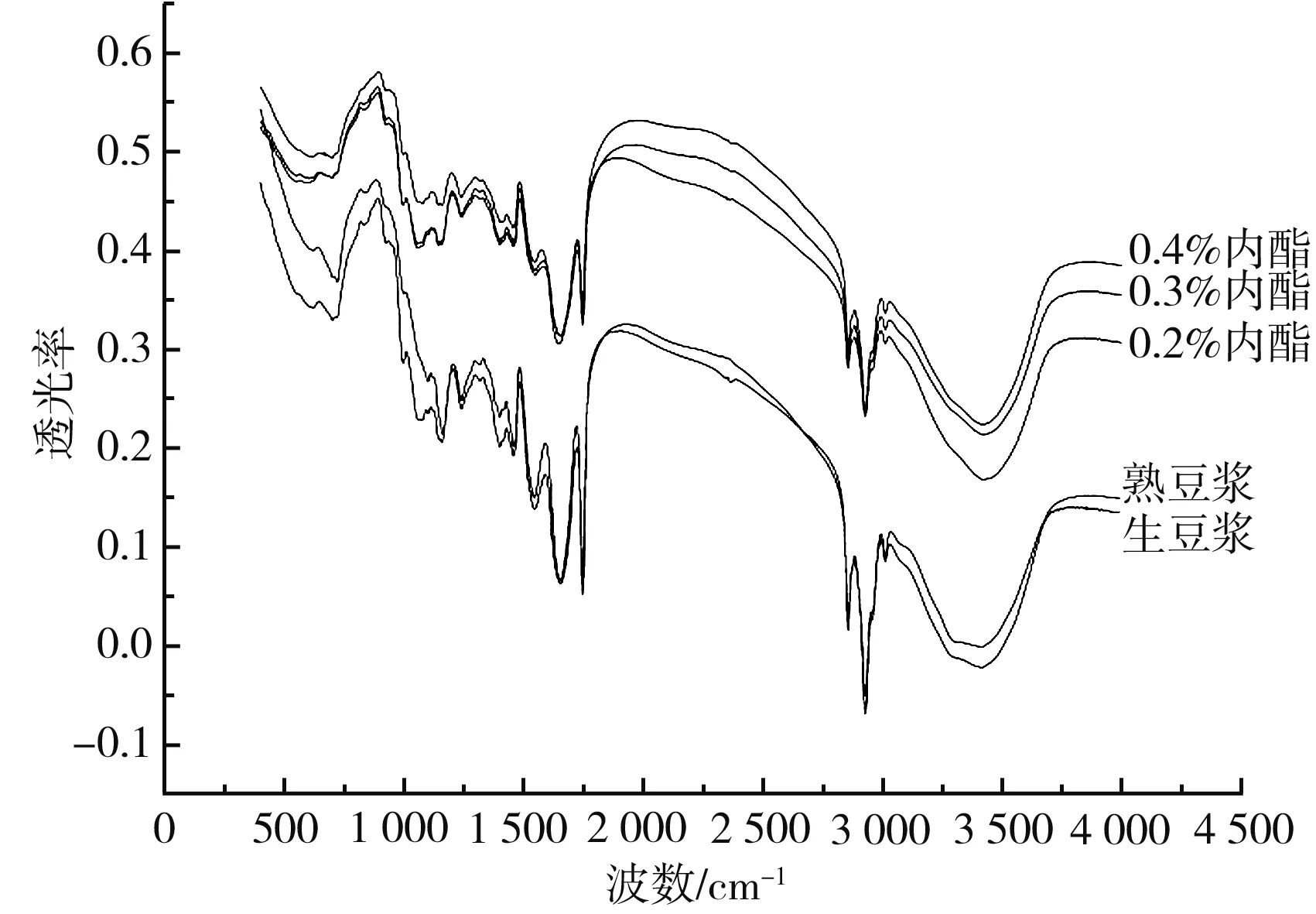
圖4 不同GDL添加量制備的內酯豆腐中蛋白質紅外光譜分析Fig.4 Infrared spectra analysis of protein in lactone tofu prepared with different GDL addition amount
隨著豆漿的加熱和GDL添加量的增加,3 250~3 400 cm-1處羥基基團吸收峰強度降低,氫鍵作用減弱,2 800~3 000 cm-1處C-H拉伸脂肪族氨基酸殘基對應的峰面積隨著內酯添加量的增加而增大,蛋白質聚集的趨勢增大。
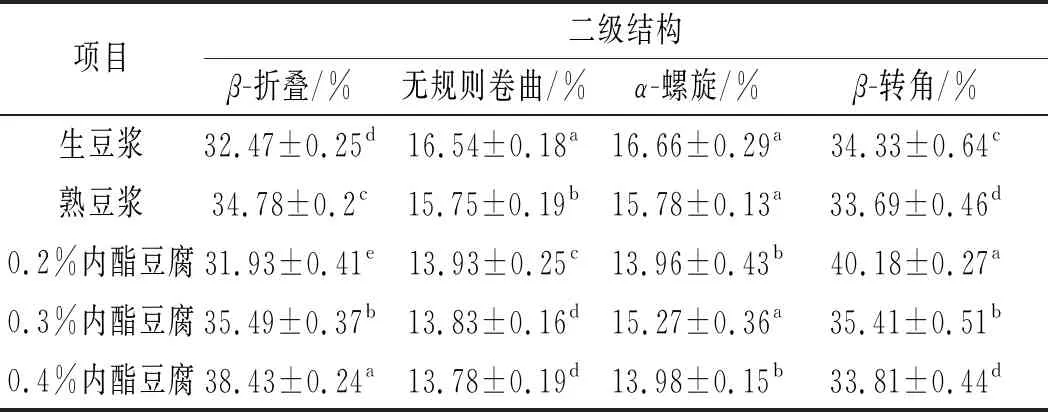
表2 GDL添加量對豆腐二級結構的影響Table 2 Effect of GDL addition amount on the secondary structure of tofu
由表2可知,內酯豆腐中蛋白質的二級結構主要由β-折疊和β-轉角構成,無規則卷曲和α-螺旋含量較少,隨著GDL添加量的增加,β-折疊含量由31.93%增加到38.43%,無規則卷曲含量由13.93%下降到13.78%,α-螺旋含量先升高后降低,由13.96%增加到15.27%又下降到13.98%,β-轉角含量由40.18%下降到33.81%。
天然大豆蛋白以α-螺旋結構含量最高,隨著加熱和豆腐凝膠的形成,蛋白由α-螺旋和β-轉角結構轉而形成更為有序的β-折疊,這也是豆腐凝膠網絡結構的有序形成所導致。
2.6 GDL添加量對豆腐微觀結構的影響
通過激光共聚焦掃描觀察GDL添加量不同時豆腐的微觀結構,圖5中淺色區域為蛋白質聚集體區域,而深色區域為網絡結構中的孔隙。有研究表明[26],酸化速率過低或過高均不利于均勻的凝膠結構的形成。圖5中A為熟豆乳的激光共聚焦掃描圖,圖中淺色區域均勻分布,孔徑小且密集,表明此時豆乳中蛋白質尚未發生聚集,主要以小分子蛋白形式存在,無凝膠網絡結構形成;圖5中B為GDL添加量0.2%時豆腐的激光共聚焦掃描圖,相比于圖A中深色區域增多,表明蛋白質在質子的作用下發生了一定程度的聚集,但由于聚集程度較低,只有極少部分蛋白參與了凝膠結構的形成;圖5中C為GDL添加量0.3%時豆腐的激光共聚焦掃描圖,圖中淺色區域呈連續均勻的蜂窩狀分布,形成了明顯的網絡結構,與圖5中B相比,蛋白質聚集體的分布更加均勻,凝膠網絡結構更加致密,說明蛋白質聚集程度大幅提高,并且此時酸化速率適宜,尚能形成有序的網絡結構;圖5中D為GDL添加量0.4%時豆腐的激光共聚焦掃描圖,與圖5中C相比,深色區域明顯增多且分布不均勻,說明由于酸化速率過快,蛋白質聚集沉淀速度過快,不利于形成有序的凝膠結構。豆腐中GDL添加量為0.3%時,其凝膠微觀結構最佳,凝膠中蛋白質的交聯反應更加充分均勻。

圖5 不同GDL添加量豆腐激光共聚焦掃描圖Fig.5 Confocal laser scanning diagram of tofu with different GDL addition amount
3 結論
通過對不同GDL添加量的豆腐特性進行研究發現,隨著GDL添加量的增加,內酯豆腐的硬度、彈性和聚集性逐漸提高,內聚性幾乎不變;內酯豆腐的含水量降低,保水性呈增大趨勢;內酯豆腐凝膠中離子鍵和二硫鍵先增加后減少,而氫鍵則先減少后增加,疏水作用增強,可溶性蛋白的亞基條帶逐漸減少,蛋白質逐漸向凝膠網絡轉化,蛋白質二級結構變得更加有序,β-折疊在內酯豆腐蛋白質結構中占比最高,隨著GDL添加量的增加,當GDL添加量為0.3%時,其凝膠微觀結構中的交聯反應最均勻。

