褐馬雞繁殖期和非繁殖期血液轉錄組的比較分析※
●任倩俐 蘇 凱 姚 麗 李金邦 張 敬 張麗霞※※
(1.太原動物園 山西 太原 030009;2.北京動物園管理處 北京 100044;3.北京動物園圈養野生動物技術北京市重點實驗室 北京 100044)
褐馬雞(Crossoptilon mantchuricum)是我國特有的瀕危珍稀雉類,全球現存約17 900只,被IUCN紅色名錄列為易危物種。目前僅分布于山西、北京、河北和陜西,其中山西是其主要分布省份[1]。為了保護這一珍稀鳥類,多年來學者們在形態學、繁殖生物學、生態學、保護生物學等領域對褐馬雞進行了廣泛的研究,但關于褐馬雞繁殖及生長發育的功能基因以及相關生物學現象的分子機制研究較少,轉錄組學的研究處于空白狀態,若想揭示、利用褐馬雞生長發育、應激生理、抗病免疫等作用機制,則需要了解其遺傳信息。由于褐馬雞為國家一級保護動物,采集組織器官對其進行轉錄組分析不現實,血液樣本的采集操作簡單,對動物的傷害較小,適用于褐馬雞繁育機制的研究。截至目前,血液轉錄組分析已經在多個哺乳動物中完成,如北極熊、棕熊[2]、人[3-4]、豬[5]、牛[6]和大熊貓[7]等。同時相關研究表明,禽類就巢期間,血液中PRL(催乳素)、FSH(促卵泡素)等激素的含量會增多[8],因此可以從血液轉錄本在褐馬雞繁殖期前后的變化發現其基因調控機制。本試驗以褐馬雞為研究對象,通過探究其在繁殖期和非繁殖期的基因表達模式和分子調控機制的變化,為褐馬雞季節性行為策略、瀕危機制、生態學研究及保護遺傳學的研究提供理論依據。
1 材料與方法
1.1 樣本采集及RNA測序
在太原動物園褐馬雞繁育基地選取健康的3齡成鳥2對,體重約5 kg,編號為7L195♀,7L181♂,7L346♀,7L297♂(以下簡稱 HC1、HX1、HC2、HX2)。在5月和10月分別采用翼下采血法提取褐馬雞的血液樣本,每份樣本采集2.5 mL全血至 EDTA 采血管中,加入7.5 mL TriZol裂解液混勻,立刻轉入耐-192℃低溫的螺紋口凍存管中,干冰用于RNA樣品制備、檢驗和測序(表1)。

表1 樣品名編號
1.2 差異表達基因的篩選
1.3 差異表達基因的GO分類、KEGG富集分析
在BlastGO軟件中將差異表達基因的序列與GO(Gene Ontology)數據庫進行注釋和富集分析;通過BlastX軟件將差異表達基因與KEGG數據庫比對,使用在線注釋工具KAAS對核酸和蛋白質序列進行功能注釋并分析基因代謝途徑[9]。
2 結果與分析
2.1 RNA測序質量控制
采用瓊脂糖凝膠電泳法對樣品進行檢測,結果表明,樣本總RNA的純度較高,符合轉錄測序cDNA 文庫構建對RNA質量的要求。統計了下機原始數據每個樣本的Reads 數以及總數據量(表2),各項數據符合要求,可用于生物信息學分析。組裝后褐馬雞全基因組測序共獲得 16.1 Gbp 數據,39 907 條 Unigenes,總長度為 39 002 861 bp,平均長度為 324 bp。

表2 轉錄組測序產量統計
2.2 差異表達基因的篩選
將8個樣本中的重復樣本混合后組合成3個對照組,即HC10 vs HC05(非繁殖期和繁殖期雌性)、HX10 vs HX05(非繁殖期和繁殖期雄性)、HC05 vs HX05(繁殖期雌性和雄性)。結果顯示,非繁殖期與繁殖期的雌雞進行比較,有4007條差異基因表達,上調基因數目為2567,下調基因數目為1440;非繁殖期與繁殖期的雄雞進行比較,差異基因數目為3529,上調基因數目為2313,下調基因數目為1216;繁殖期的雌雞和雄雞相比較,有336條差異基因表達,上調的基因數目為150,下調的基因數目為186(圖1)。

圖1 差異表達基因火山圖
經比較,HC10 vs HC05對照組中,非繁殖期雌性褐馬雞體內Mucl2、HBE1、Col1a1、Klk1b22、Col1a2基因表達量顯著高于繁殖期的雌性褐馬雞;HX10 vs HX05對照組中,非繁殖期雄性褐馬 雞 體 內MT-CO3、MT-ND4、EEF1A1、MTCO1基因表達量顯著高于繁殖期的雄性褐馬雞;HC05 vs HX05對照組中,繁殖期雌性褐馬雞體內HINT1、TXNL1、Txnl1、AVD、vcp基因表達量顯著高于雄性褐馬雞(表3)。這些基因是與褐馬雞生長發育、激素調控、性別決定、免疫、代謝、酶活性、線粒體等生命活動息息相關的基因,這些基因的表達與調控從分子水平上揭示了褐馬雞在性別之間、季節變化方面的不同行為。
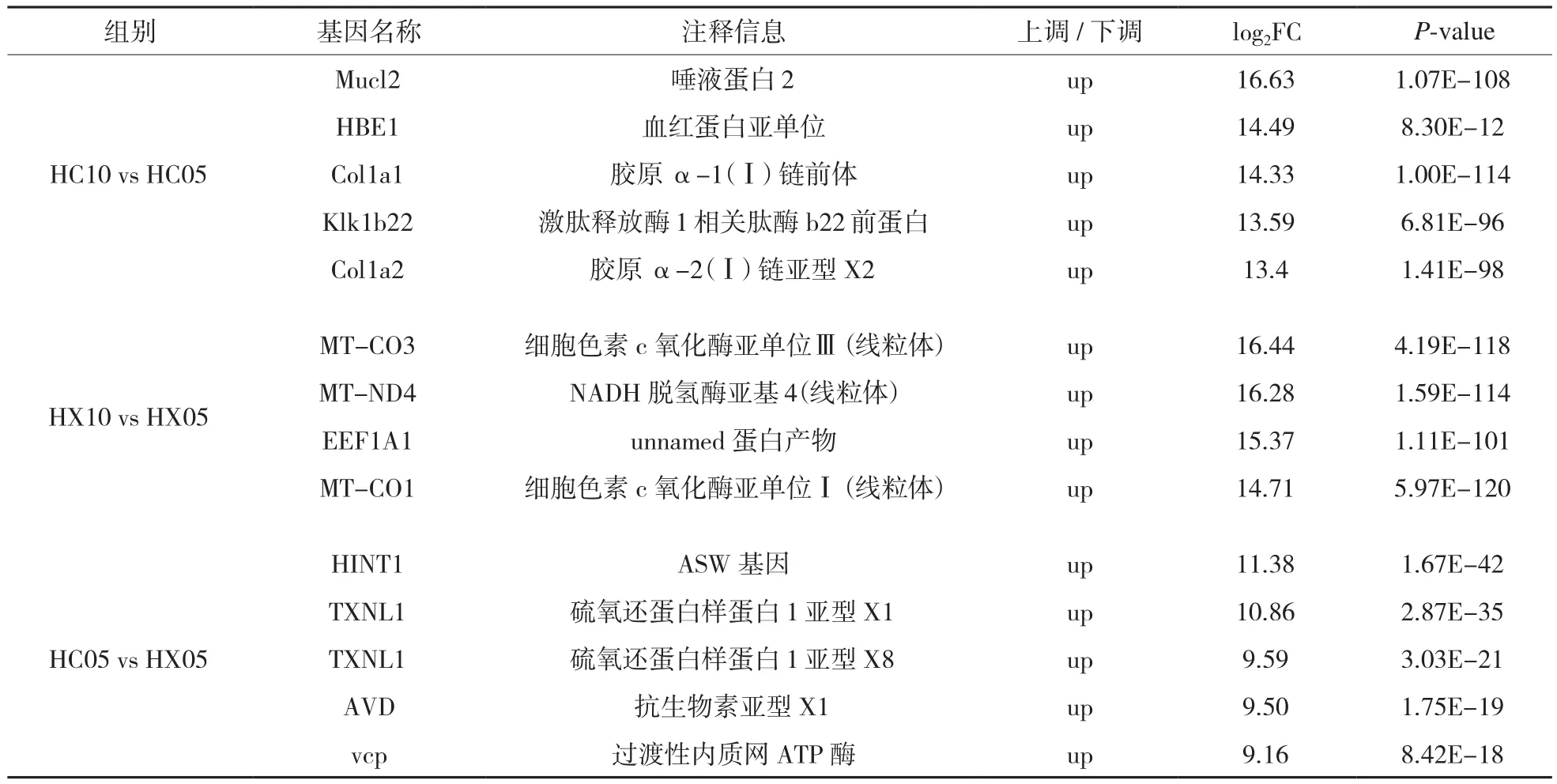
表3 比較組部分差異表達基因
2.3 差異基因的GO富集分析
對各個對照組的差異表達基因進行表達模式聚類分析,以了解其在生物過程中的功能分類,包括生物學過程、細胞組分和分子功能,即GO富集分析。結果表明,有174個與繁殖功能相關的基因比對到GO數據庫中,其中,非繁殖期與繁殖期的雌雞進行比較,4007個差異基因中有2762個得到注釋,15個基因參與繁殖調節相關的信號通路;非繁殖期和繁殖期的雄雞進行比較,3529個差異基因中有2526個得到注釋,143個基因參與繁殖調節相關的信號通路;繁殖期的雌雞和雄雞相比較,336個差異基因中有222個得到注釋,16個基因參與了繁殖調節相關的信號通路。將P-value值設置為小于0.05,所有的差異基因顯著富集到了10 147條GO terms中,占所有 terms的21.66%。
在生物學過程中,有305個基因注釋到翻譯(Translation)類別中,數量最多,其次為DNA模 板 轉 錄(Transcription,DNA-templated) 和DNA 模板的轉錄調控(Regulation of transcription,DNA-templated);在細胞組分中,有525個基因注釋到核(Nucleus),數量最多,其次為細胞質(Cytoplasm)和細胞外體(Extracellular exosome);在分子功能中,有527個基因注釋到蛋白質結合(Protein binding),其次為三磷酸腺苷結合(ATP binding)和核糖體的結構組成(Structural constituent of ribosome)。
HC10 vs HC05比較組中,在非繁殖期的高表達基因發現了TGFB1、ACVR1B和BCL2L1 3個基因涉及褐馬雞的繁殖調控機制。TGFB1(轉化生長因子β-1前蛋白前體)編碼的蛋白質參與到促卵泡素正調節、黃體生成素正調節、孕酮分泌、凋亡過程調控等過程;ACVR1B基因(激活素受體1B型亞型X1)編碼的蛋白與抑制素(INH)結合有關,抑制素在生物學功能上通過對促卵泡素(FSH)的負反饋調節,進而對雌性褐馬雞在非繁殖期的各類行為進行調控;BCL2L1基因(Bcl-2家族蛋白復合物)是B 細胞白血病淋巴瘤2p家族基因,是決定生殖細胞命運的重要基因,在雌性褐馬雞的非繁殖期參與到了細胞凋亡和生殖細胞、卵泡發育的調控。
2.4 差異基因的KEGG富集分析及代謝通路
KEGG通路分析結果顯示,HC10 vs HC05對照組中有2509個差異基因富集到311個信號通路上;HX10 vs HX05對照組中有2300個差異基因富集到309個信號通路中;HC05 vs HX05對照組中有210個差異基因富集到130個信號通路中。88個差異基因在KEGG代謝通路中均參與了與繁殖相關的信號通路中,有22個基因富集到卵母細胞減數分裂(Ocyte meiosis),29個基因富集到 GnRH 信號通路(GnRH signaling pathway,促性腺激素釋放激素)、19個基因富集到孕酮介導的卵母細胞成熟(Progesterone-mediated ocyte maturation)、13個基因富集到催產素(Oxytocin signaling pathway)、5個基因富集到雌激素代謝通路(Estrogen signaling pathway)。
3 討論與結論
動物隨季節變化產生的規律性活動,不僅受環境因素的影響,也與自身內源性節律調控有關,而參與繁殖調控的相關基因往往在年度周期中有著節律性的表達變化,并且在調節季節性活動變化中發揮重要功能。褐馬雞作為我國特有的瀕危珍禽,其種群數量少,分布范圍小,樣本采集困難,隨著保護生物學研究的不斷深入,筆者發現除了保護棲息地之外,更重要的是保護其遺傳多樣性。
隨著RNA-Seq 技術的發展應用,轉錄組測序以檢測范圍廣、測序通量高、檢測成本低、分辨率好和靈敏度高等特點,已被廣泛應用于非模式生物以及低豐度稀有轉錄本相關基因挖掘與研究。本研究通過高通測序技術,獲取了不同繁育階段、不同性別褐馬雞血液轉錄組信息,構建褐馬雞血液轉錄組文庫,共得到39 907條Unigenes,通過GO功能富集和KEGG分析,發現有174個與繁殖功能相關的基因比對到GO數據庫中,有88個基因在KEGG代謝通路中參與到了與繁殖相關的代謝通路。在差異基因的GO分析中,TGFB1、ACVR1B和BCL2L1 3個基因在非繁殖期雌性褐馬雞體內高表達,它們參與了促卵泡素、抑制素、孕酮的激素調控以及生殖細胞、卵泡的調控,從分子層面揭示了基因表達量的變化影響激素分泌進而影響褐馬雞季節性行為策略;雌性褐馬雞非繁殖期和繁殖期對照組中,在Biological process中找到了與繁殖相關的功能組,此結果與陳杰[10]鵝的產蛋性能的影響基因研究結果相似,說明繁殖性能與GO注解中的這幾個進程相關。本研究結果既豐富褐馬雞的轉錄組信息,也為今后開展褐馬雞遺傳學研究、分子調控機制以及瀕危動物的保護工作奠定了基礎。

