凍融胚胎移植后第14天血β-HCG水平與活產率的相關性及其預測價值
王濤,張會娜,吳中偉,劉子霞,陳潔
(中國人民解放軍聯勤保障部隊第九八八醫院生殖醫學中心,焦作 454000)
凍融胚胎移植(FET)是輔助生殖技術(ART)重要的衍生技術之一,是指采用玻璃化冷凍技術將取卵周期患者未移植的優質胚胎置于液氮中冷凍保存,在適宜情況下,再將冷凍的胚胎解凍復蘇進行胚胎移植的助孕技術[1]。在ART獲得的妊娠中,生化妊娠、異位妊娠、流產等不良妊娠結局的發生率高達22%[2],而活產率仍未達到理想要求,使得接受ART的患者仍承受著較大的經濟壓力和心理壓力,因此,早期預測活產率對患者的精神疏導及臨床決策都十分重要。本研究回顧性分析2016年1月至2021年6月在我中心行FET的1 741個周期的臨床資料,分析與FET活產率具有相關性的預測因子,探討其預測FET活產率的價值。
資料與方法
一、研究對象
回顧性分析2016年1月至2021年6月在我院生殖醫學中心行FET的1 741個周期的臨床資料,并根據臨床結局分為活產組(794個周期)及非活產組(947個周期)。所有患者在之前進行ART治療前均知曉并同意將結果用于臨床研究。納入標準:(1)卵巢儲備功能尚可,年齡≤50歲;(2)促排卵方案為激動劑方案、拮抗劑方案及微刺激方案;(3)夫妻雙方染色體核型均正常。排除標準:無隨訪結果或資料不全者。
二、研究方法
1.內膜準備:根據患者具體情況選擇不同的內膜準備方案,合并子宮肌瘤、子宮腺肌癥、子宮剖宮產瘢痕憩室及反復宮腔積液、反復移植失敗的患者采用降調節人工周期方案;存在排卵障礙、卵巢功能減退、高齡的患者采用人工周期方案。(1)降調節人工周期方案:患者月經來潮2~3 d,空腹抽血化驗性激素六項,彩超監測內膜、竇卵泡數目及大小,給予注射用醋酸曲普瑞林(3.75 mg/支,博福益普生,法國)3.75 mg肌肉注射,14 d后,根據內膜厚度給予戊酸雌二醇片(1 mg/片,拜耳,德國)2~4 mg,2次/d,或雌二醇片/雌二醇地屈孕酮片(雅培,荷蘭,1/10 mg×28片)2~4 mg,2次/d;當內膜厚度≥8 mm,進行內膜轉化[記為第0天(D0)],給予地屈孕酮片(10 mg/片,雅培,荷蘭)口服+雪諾酮(90 mg/支,默克雪蘭諾,英國)或安琪坦(0.1 mg/粒,CydeaPharma,法國)陰道給藥,用藥至移植50 d后,遵醫囑減量,D4移植第3天卵裂胚,D5~6移植囊胚。FET第14天抽血化驗β-HCG。(2)人工周期方案:患者月經來潮2~3 d,空腹抽血化驗性激素六項,彩超監測內膜及竇卵泡數目、大小,給予戊酸雌二醇片2~4 mg,2次/d,或雌二醇片/雌二醇地屈孕酮片2~4 mg,2次/d;當內膜厚度≥8 mm,即為D0轉換日,選擇地屈孕酮片口服+雪諾酮或安琪坦陰道給藥,用藥至移植50 d后,胚胎移植同降調節人工周期方案。
2.胚胎培養及冷凍、復蘇:取卵后,根據精液情況及上一周期受精情況行常規短時受精或卵胞漿內單精子注射(ICSI),對于常規短時受精4~6 h,第二極體排出率<30%者,行補救性ICSI(R-ICSI)。受精卵在卵裂胚培養液G-1TMPLUS(瑞利芙,瑞典)中培養到第3天,根據卵裂球數目、卵裂球均一度、胚胎碎片數量與分布、胚胎的色澤與胞漿形態、透明帶與卵周隙狀態等評估卵裂期胚胎質量。評級為Ⅰ級、Ⅱ級者為優質卵裂胚,Ⅰ級、Ⅱ級及Ⅲ級者為可用卵裂胚。將卵裂胚轉移至囊胚培養液G-2TMPLUS(瑞利芙,瑞典)中培養至第5~6天,采用Gardner評分標準進行囊胚質量評估,根據囊胚擴張程度、內細胞團及滋養層細胞質量進行分級。4期及以上、內細胞團或滋養層細胞達到B級及以上為可利用囊胚;4期及以上、內細胞團和滋養層細胞均達到B級及以上為優質囊胚。選擇Ⅰ~Ⅲ級卵裂胚或可利用囊胚嚴格按照玻璃化冷凍液套裝(加藤,日本)說明書及我中心的標準化作業程序(SOP)手冊進行胚胎冷凍后置于液氮中保存。FET前嚴格按照玻璃化解凍液套裝(加藤,日本)說明書及我中心SOP手冊進行胚胎解凍復蘇后置于囊胚培養液G-2TMPLUS中,均采用透明帶削薄法進行激光輔助孵化,繼續培養2 h后進行移植。
3.FET:結合患者情況及胚胎發育程度,選擇至少1枚Ⅰ~Ⅲ級卵裂胚或可利用囊胚進行移植。患者取膀胱截石位,生理鹽水沖洗外陰、陰道后,用卵母細胞及胚胎處理液G-MOPSTMPLUS(瑞利芙,瑞典)擦洗宮頸;在B超引導下,將胚胎移植管(CooperSurgical,英國)的末端輕緩插至距宮底1~1.5 cm處,緩慢注入胚胎后,緩慢拔出胚胎移植管,并在顯微鏡下確定胚胎移植管內無胚胎殘留。術后患者平臥20~30 min,留觀2~4 h無不適后即可離院。患者于FET后第14天抽血檢測β-HCG值。
4.觀察指標及判斷標準:收集患者的年齡、體質量指數(BMI)、促排卵方案(激動劑方案、拮抗劑方案及微刺激方案)、不孕年限、不孕類型(原發、繼發)、不孕因素(女方因素、男方因素、雙方因素、不明因素)、受精方式(IVF、ICSI、R-ICSI)、移植胚胎類型及數量、FET第14天血β-HCG水平及活產率等。
活產指胎兒與母體分離后(不論妊娠期的長短),具有生命現象(心跳、呼吸、臍帶搏動、隨意肌縮動)之一者。活產率=活產分娩周期數/FET周期數×100%。
三、統計學處理

結 果
一、一般資料比較
本研究共納入1 741個FET周期,活產794個周期,活產率為45.61%。活產組與非活產組患者的BMI、移植胚胎數量、不孕因素、受精方式、促排卵方案比較無顯著性差異(P>0.05)。活產組的年齡、不孕年限顯著低于非活產組(P<0.05),移植日子宮內膜厚度、FET第14天血β-HCG水平顯著高于非活產組(P<0.05)。兩組的不孕類型、移植胚胎類型比較亦有顯著性差異(P<0.05)(表1)。
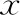
表1 兩組患者一般資料比較[(-±s),n(%)]
二、FET后活產率相關預測因子分析
單因素logistic回歸分析顯示,年齡、不孕類型(原發、繼發)、不孕年限、內膜厚度、移植胚胎類型(卵裂胚、囊胚)、FET第14天血β-HCG是FET活產率相關預測因子(P<0.05),詳見表2。
以是否活產作為因變量(是=1,否=0),將單因素logistic回歸分析中差異具有統計學意義的臨床參數(年齡、不孕類型、不孕年限、內膜厚度、移植胚胎類型、FET第14天血β-HCG)作為自變量進行多因素logistic回歸分析(條件法),結果顯示:年齡、FET第14天血β-HCG是FET活產率相關的獨立預測因子(P<0.05),即年齡每增加1歲,活產率變為原來的0.931倍;FET第14天血β-HCG每增加1 U/L,活產率變為原來的1.003倍,詳見表3。

表2 移植后活產率單因素logistic回歸分析

表3 多因素logistic回歸分析(條件法)
三、相關性分析
Spearman相關性分析顯示:FET活產率與年齡的等級相關系數為-0.246,二者呈負相關(P<0.01),即隨著年齡增加,FET活產率降低,但相關性較弱;FET活產率與FET第14天血β-HCG的等級相關系數為0.734,二者呈中度正相關(P<0.01)。
四、ROC曲線分析
ROC曲線分析表明,年齡的曲線下面積(AUC)為0.358,閾值為26.00歲,敏感度和特異性分別為100.00%、0.32%;FET第14天血β-HCG的AUC為0.926,閾值為198.91 U/L,敏感度和特異性分別為97.23%、80.25%;將年齡、FET第14天血β-HCG進行聯合檢測的AUC為0.922,敏感度和特異性分別為94.33%、82.05%(表4、圖1)。且FET第14天血β-HCG與聯合檢測的AUC(χ2=0.000,P=1.000)、敏感度(χ2=1.047,P=0.306)及特異性(χ2=0.005,P=0.944)比較均無顯著性差異,故認為單獨檢測FET第14天血β-HCG即可較好地預測FET活產率。

表4 ROC曲線分析

圖1 ROC曲線
討 論
對于新鮮周期不適宜移植或有剩余胚胎的患者,FET可避免再次促排、取卵、受精、胚胎培養等系列復雜過程,有效減少促排卵次數及卵巢過度刺激綜合征發生率,顯著增加取卵周期的累積成功率及剩余胚胎利用率,且臨床妊娠率及活產率與新鮮胚胎移植周期相當[3]。但也有文獻報道FET可能引起妊娠期高血壓、胎盤形成異常、過期產等風險,進而影響到妊娠結局[4],給接受FET的患者帶來一定的精神壓力。因此,早期預測FET的妊娠結局對緩解患者的精神壓力、指導臨床決策具有重要的意義。
有研究顯示,與自然周期相比,采用藥物干預的內膜準備方案,其FET后妊娠率、植入率、活產率及多胎率無顯著差異[5-6]。故本研究未區分內膜準備方案納入對象。本研究結果顯示:活產組平均年齡及不孕年限顯著低于非活產組,單因素logistic回歸分析顯示年齡、不孕年限是與FET活產率相關的預測因子;多因素logistic回歸分析亦證實年齡是影響FET活產率的獨立預測因子。這可能因為高齡與卵巢儲備功能下降、子宮內膜變薄、染色體非整倍性增加、紡錘體功能異常、卵母細胞中線粒體數量減少等密切相關,導致低植入率、低妊娠率及高流產率[7-8]。但本研究中ROC曲線提示年齡預測FET活產率的特異性較差。
如何提高活產率、降低多胎率及妊娠期并發癥發生率是ART追求的理想目標。囊胚培養可直接淘汰掉發育潛力差的胚胎,且胚胎所處階段更加符合胚胎著床的生理過程,可以提高種植率及妊娠率,降低多胎率及宮外孕率。但對于獲卵數較少的高齡女性,如果全部行囊胚培養,可能面臨無胚胎可用的臨床結局。因此,對于囊胚培養失敗風險較高的患者,可嘗試使用卵裂胚進行FET。因此臨床工作中應結合患者的個體情況選擇移植胚胎類型及數量。國內外關于FET中應用囊胚或卵裂胚移植后妊娠結局的研究結果不盡相同。部分研究結果顯示,使用囊胚和卵裂胚行FET的持續妊娠率、分娩孕周、妊娠期并發癥、早產和極早產風險及活產率均相似[9-11]。但也有學者認為,與卵裂胚FET相比,囊胚FET的圍產兒死亡率及早產率更高[12]。本研究結果顯示,活產組與非活產組FET的移植胚胎類型比較有顯著性差異(P<0.05),活產組的卵裂胚移植比例顯著低于非活產組,囊胚移植比例顯著高于非活產組(P<0.05),但多因素logistic回歸分析提示移植胚胎類型尚不能作為預測FET活產率的獨立預測因子。
B超監測子宮內膜厚度是臨床評價子宮內膜容受性的最直觀指標。有研究指出,厚度<8 mm的子宮內膜不利于胚胎著床,自然流產率高達50%[13]。一般認為子宮內膜厚度為8~14 mm最適宜胚胎植入,且植入率、妊娠率及活產率隨著內膜厚度的增加而升高[14]。但Richter等[15]研究發現內膜厚度為6或7 mm時,移植高質量囊胚,妊娠率依然高達50%。因此臨床工作中不能僅因為患者內膜薄的單個因素而放棄FET周期。內膜厚度是否能單獨作為活產率的預測因子尚存在爭議。本研究結果顯示,雖然活產組內膜厚度顯著高于非活產組(P<0.05),但其尚不是預測FET活產率的獨立預測因子。
本研究對患者的一般資料進行回顧性分析顯示,兩組患者中原發不孕和繼發不孕的分布存在明顯差異,非活產組的繼發不孕比例顯著高于活產組(P<0.05),但多因素logistic回歸分析提示不孕類型無明顯預測FET活產率的價值。
女性妊娠期間,樹突狀細胞因受體刺激會發生損傷胚胎的反應,而滋養層細胞分泌的HCG可保護胚胎不受此損傷[16],且最早于妊娠第6~8天即可在血清中檢測到β-HCG[17]。李玲等[2]研究表明,FET術后第14天,通過檢測患者血清β-HCG值可有效預測正常妊娠和異常妊娠(包括生化妊娠、異位妊娠、早期流產等)結局,其敏感度與特異度分別為74.97%、78.21%。邱佩嫦等[18]研究顯示,FET后第9天血清β-HCG>79.40 U/L時,單胎妊娠孕婦臨床活產率為99.0%;第9天血清β-HCG>103.00 U/L時,雙胎妊娠孕婦臨床活產率為83.6%,因此認為FET術后第9天測定血清β-HCG水平對預測單/雙胎妊娠活產有參考價值。本研究結果中,經Spearman相關分析,FET后第14天血清β-HCG水平與活產率的相關系數為0.734(P<0.01),二者呈中度正相關,活產率隨著血β-HCG升高呈上升趨勢;且FET第14天血β-HCG水平可用于預測活產率,其閾值為198.91 U/L,敏感度和特異性分別為97.23%、80.25%。但由于檢測方法敏感性差異、胚胎種植延遲等因素,導致胚胎移植術后測定血β-HCG預測FET活產率的時間點尚未統一,部分生殖中心檢測時間節點為FET后第9天[18-19],或根據移植胚胎類型選擇不同檢測時間節點,如移植卵裂胚時間節點選擇FET后第14天,移植囊胚時間節點選擇FET后第12天[20-21]。我中心則根據《臨床診療指南 輔助生殖技術與精子庫分冊》[22],將血β-HCG檢測時間節點統一為FET術后第14天。
綜上所述,FET第14天血β-HCG水平與活產率相關,活產率隨著血β-HCG水平升高呈上升趨勢;且FET第14天血β-HCG水平可用于預測活產率,其敏感度和特異性均較高。臨床工作中,生殖領域醫師可以根據移植后血β-HCG水平及時評估患者情況,對可能出現的危險因素采取個體化、針對性的干預措施,以期改善妊娠結局。

