FSHR剪切變異c.299+2T>G致卵巢抵抗綜合征的家系分析
閆慧,黃蕾,馬小紅,哈靈俠,趙君利,張倩,閆有圣,劉春蓮*
(1.寧夏醫科大學總醫院生殖醫學中心,銀川 750004;2.生育力保持教育部重點實驗室,銀川 750004;3.首都醫科大學附屬北京婦產醫院產前診斷中心,北京 100026)
卵巢抵抗綜合征(resistant ovary syndrome,ROS)又稱卵巢不敏感綜合征(insensitive ovary syndrome,IOS),即在40歲前患有高促性腺激素低雌激素性閉經,卵巢體積正常,有大量的始基卵泡及初級卵泡,抗苗勒管激素(AMH)值正常或偏高,對促性腺激素不反應,臨床癥狀可表現為原發或繼發閉經。該疾病需要與卵巢功能減退(premature ovarian insufficiency,POI)相鑒別。ROS病因不明,可能與促性腺激素受體如卵泡刺激素受體(FSHR)缺陷有關,目前已報道多種致病性FSHR變異,一些變異可能導致ROS[1-3]。本研究對寧夏醫科大學總醫院生殖醫學中心收治的1例確診為ROS的年輕原發性閉經患者的臨床特征及遺傳學資料進行回顧性分析,并對相關文獻進行整理和復習,以期為今后的臨床實踐提供參考。
資料與方法
一、研究對象
先證者來自寧夏醫科大學總醫院生殖醫學中心,在知情同意的前提下采集了患者及父母、兄長的外周靜脈血各5 ml,并獲取了先證者的臨床資料。該研究經寧夏醫科大學總醫院生殖醫學中心倫理委員會批準(編號2019-030)。
二、研究方法
1.外周血基因組DNA提取:采用肘靜脈血約5 ml,EDTA-2Na抗凝,用DNA提取試劑盒(TIANamp Blood DNA Kit,#DP348-03,北京天根生化科技)按照使用說明提取基因組DNA,測定DNA的濃度和純度,至少約有1.5 μg的基因組DNA用于建庫。
2.全外顯子組測序:使用上海翊圣生物DNA轉座酶法建庫試劑盒(Hieff NGSOnePot DNA Library Prep Kit for Illumina)進行DNA片段化、末端修復和接頭連接過程。用xGen Exome Research Panel v1.0試劑盒(Integrated DNA Technologies公司,美國)進行全外顯子組文庫捕獲文庫構建。使用PE150模式在Illumina HiSeq 2500(San Diego,加拿大)測序平臺上進行雙端測序。
3.測序數據分析:測序數據經過過濾與評估,過濾掉低質量reads(Q30<85% reads)數據。通過Burrows-Wheeler Aligner(BWA)軟件將數據與人類參考基因組(UCSC hg19,https://genome.ucsc.edu/)對比。使用Genome Analysis Toolkit(GATK)v3.70對測序結果與參考基因組進行比對,找出樣品中存在的變異信息,包括SNV、InDel等。使用dbSNP、1000Genome、Clinvar等數據庫以及SIFT、Polyphen-2、GERP等軟件對其進行注釋及功能預測。
4.家系成員變異位點的Sanger測序驗證:根據目標致病基因突變位點,從GenBank數據庫中獲取FSHR的基因組DNA序列,用軟件Primer5設計可特異性擴增該基因c.299+2T>G突變位點的外顯子上下游引物。上游引物:5’-GCAGGCAACAGGATGAGACT-3’,下游引物:5’-GAGCCACAGCCTTCGACTTA-3’。使用TC-XP-G PCR儀(杭州BIOER)對DNA樣本(包含目標基因變異位點的序列)進行擴增,擴增后電泳條帶清晰、特異,采用Life 3500 Dx測序儀(ABI,美國)進行Sanger測序。將所測出的FSHR序列與Nucleotide數據庫(https://www.ncbi.nlm.nih.gov/Nucleotide)中的FSHR序列進行對比分析以發現FSHR基因變異。利用Mutation Surveyor軟件進行分析,并結合文獻及1000Genome、ExAC、ESP、HGMD、ClinVar等多種數據庫進行基因變異致病性的判斷。
5.變異位點的致病性分析:參照美國醫學遺傳學和基因組學學會(American College of Medical Genetics and Genomics,ACMG)相關指南進行變異致病性分析。
結 果
一、臨床資料
1.基本情況:患者,女(先證者V2),24歲,因“未避孕未孕5年”于2022年1月就診于寧夏醫科大學總醫院生殖醫學中心,患者月經初潮16歲,需藥物行經,就診時臨床診斷原發性閉經,無結核病及外傷史,無盆腔手術史;經尿促性素粉針劑促排3個周期無優勢卵泡發育。經臨床資料與輔助檢查診斷為ROS。母親有正常月經史,絕經年齡為48歲;無特殊家族史。先證者母親的祖母與父親的祖父為親兄妹,家系圖譜詳見圖1。

圖1 病例家系圖譜
2.體格檢查:患者身高171 cm,體重55 kg,外觀發育未見異常,無腋毛,乳房發育不良,陰毛和外生殖器發育正常。
3.輔助檢查:B超顯示單側多囊卵巢改變,直徑2~3 mm卵泡數大于12個,子宮略小,ABO血型O型,RH(+),染色體核型正常為46,XX;既往甲狀腺激素水平正常,肝腎功能未見明顯異常,激素水平詳見表1。

表1 患者血清激素水平及參考值
二、全外顯子組測序及變異位點分析結果
原始數據經過全外顯子組測序,發現先證者存在FSHR經典剪切變異NM_000145.4 c.299+2T>G并為純合型(圖2),該變異在dbSNP和HGMD均未收錄,是尚未報道的新變異。根據ACMG解讀指南,該位點為致病性變異。
三、Sanger測序驗證
Sanger測序結果表明,先證者存在FSHR剪切變異c.299+2T>G,且兄長與先證者一致,父母(Ⅳ1、2)存在FSHR剪切變異c.299+2T>G并為雜合型(圖2)。Ⅳ1、2為四代近親結婚,根據家系圖譜及檢測結果,推測該新發位點可能源于I1或者I2。
討 論
卵泡刺激素(FSH)是由腺垂體分泌的糖蛋白,與FSHR相互作用參與調控卵泡發育和卵巢功能。FSHR長約190 kb,位于染色體2p21-p16[4],是膜受體的G蛋白偶聯受體(GPCR)超家族成員,其編碼區由10個69~1 234 bp的外顯子和9個108 bp~15 kb的內含子組成,人類FSHR蛋白由695個氨基酸殘基組成。FSHR具有廣泛的胞外結構域,與FSH結合,連接信號特異性亞域或鉸鏈區,而7個跨膜結構域參與受體的激活,并將激活過程傳遞到由氨基酸序列組成的細胞內環[5]。FSHR具有組織特異性,在女性顆粒細胞和男性支持細胞中高表達。

圖2 FSHR基因c.299+2T>G位點測序峰圖(圖中紅色框為變異位點堿基)
一、FSHR新發現剪切變異c.299+2T>G是導致ROS的關鍵因素
ROS病因尚不明確,可能是由于FSHR結構異常,導致下游信號通路受阻,雌激素合成障礙,從而影響卵泡發育,而FSHR的轉錄和翻譯受FSHR基因調控,故FSHR基因變異可能導致卵泡發育異常造成ROS[1]。目前Clinavar網站(https://www.ncbi.nlm.nih.gov/clinvar)統計的FSHR突變位點共計165個,其中致病性26個,可能致病14個,良性32個,可能良性24個,其他69個,各種類型包含的位點詳見表2。Khor等[2]報道FSHR致病性變異c.182T>A(p.Ile61Asn)和c.2062C>A(p.Pro688Thr)可引起ROS。本文發現的FSHR新剪切變異c.299+2T>G為經典剪切變異,可能導致>10%長度的蛋白改變[6],從而導致基因功能缺失。FSHR在維持正常生殖功能中發揮至關重要的作用。有文獻報道,FSHR突變影響患有子宮內膜異位癥的不孕癥患者的激素表達及輔助生殖技術助孕結局[7]。FSHRrs6166(N680S)位點攜帶者的激素敏感性更高,可用于預測輔助生殖技術中卵巢過度刺激綜合征(OHSS)的發生[8]及活產抱嬰率的情況[9]。一項納入16項研究的Meta分析發現FSHRrs6166多態性可能是亞洲人群POI的一種潛在的遺傳生物標志物[10]。亦有研究發現FSHR多態性可改變卵巢對外源性FSH的反應,增加多囊卵巢綜合征(PCOS)的發生風險,且影響其臨床特征和治療結果[11-12]。Dierich等[13]發現FSHR缺乏可能導致卵巢發育不全及某些男性特異性不孕。目前已報道的中國人群FSHR的致病性變異較少,李汶等[3]報道了FSHRc.419delA(p.Lys140Argfs*16)純合突變和c.1510C>T(p.Pro504Ser)純合突變可導致ROS的發生。

表2 FSHR突變位點臨床意義
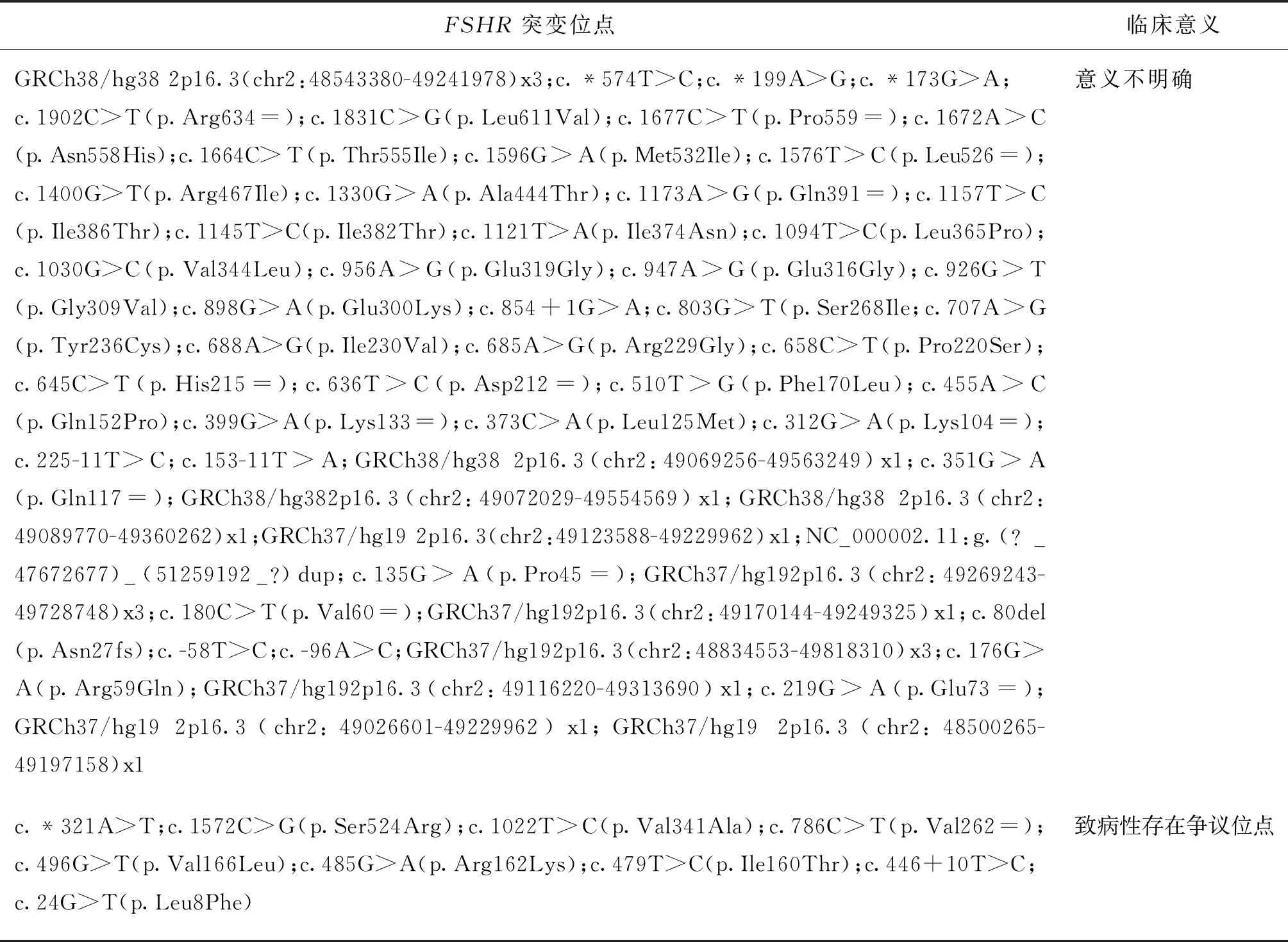
續表
二、家系臨床資料分析
不同突變位點會導致相應的臨床表現及癥狀[14],我們分析了患者的臨床數據及資料。陰式B超下顯示患者的單側卵巢呈現多囊卵巢樣改變,表明含有初級或次級卵母細胞期停止發育的卵泡,由于細胞膜上FSHR分子數量減少,卵泡發育成熟后期缺少FSH的作用,導致卵母細胞成熟障礙。本研究中先證者哥哥與其具有同樣的基因型,但遺憾的是,其哥哥因個人原因拒絕提供臨床資料及進行進一步檢查。先證者的AMH水平偏高為4.67 ng/ml,說明FSHR對于AMH的產生或竇前卵泡的發育不是必需的。Anagnostou等[15]研究發現攜帶Ser(Ser680Asn)等位基因的女性卵泡數量及卵母細胞較多,Asn/Asn女性血清和卵泡液中的AMH水平低,但無顯著性差異(P>0.05)。與其他FSHR突變導致FSH活性降低的患者類似,本病例可能初級或次級濾泡膜上的正常FSHR顯著降低,但可能在青春期合成了足夠的雌激素來刺激部分乳房發育。而因卵泡缺失而導致卵巢早衰的女性AMH值很低甚至檢測不到,這也成為與POI鑒別的關鍵要點[16]。抑制素B(Inhibin B)屬于轉化生長因子β(TGF-β)超家族,血清中高水平的抑制素B直接對垂體產生負反饋,導致FSH下降,因此其可作為預測卵巢反應的更為直接的標記物,是FSH分泌的負調控因子。先證者抑制素B水平正常(57.00 pg/ml),符合患者卵巢內大量初級或次級卵母細胞存在的體征[17]。
三、ROS患者臨床助孕管理策略
對于ROS患者的治療策略,常規可給予雌孕激素替代治療維持月經周期;不孕癥的處理常給予使用贈卵的建議。隨著測序技術的發展,FSHR的遺傳變異也是不斷發展的藥物遺傳學領域的研究熱點,可作為有價值的個體化治療方案的工具。有研究根據ROS患者的FSHR突變基因類型、位點突變的功能性以及閉經的類型,分析基因型與表型的關系,可用于推算攜帶不同FSHR突變位點的患者是否適合進行未成熟卵母細胞體外成熟培養(IVM)技術。Galv?o等[18]對9例ROS患者進行了24個IVM周期,平均獲卵數為(11.5±10.4)個,IVM培養后有(3.4±3.1)個卵母細胞成熟,活產5例(16.7%),因此認為IVM是ROS患者極具價值的助孕方式。Li等[19]報道了1例攜帶了4個良性變異位點c.-29G>A,c.299+33C>T,c.919G>A(p.Ala307Thr)和c.2039G>A(p.Ser680Asn)的ROS患者,通過IVM技術分娩了健康的嬰兒。Benammar等[20]對1名攜帶FSHRArg283Trp及Pro600Thr雜合突變的患者,經過3次失敗的常規IVF助孕后,行IVM培養,盡管只有不到50%(7/16)的卵母細胞發育成熟,但所有成熟卵母細胞均已受精,1枚胚胎成功獲得活產。結合其他成功的個案報道[21-22],我們掌握了更多關于FSHR基因型-表現型的相關性,為改善家庭遺傳咨詢提供了更多指導意見,并提高其生活質量,如激素替代治療促進乳房發育,或行卵母細胞冷凍保存為未來妊娠做準備。
鑒于不同的FSHR突變位點導致其相應的氨基酸改變,我們后續將進一步開展FSHR新發現剪切變異c.299+2T>G的功能學基礎研究,探尋效應子的耦合、與適配蛋白的相互作用以及下游細胞內信號通路機制,以期豐富FSHR的作用機理,為臨床治療提供參考。

