Candida glycerinogenes基因組大片段缺失菌的構建及表征
李沁,李海銘,陸信曜,宗紅,諸葛斌
(工業生物技術教育部重點實驗室(江南大學),工業微生物研究中心,江蘇 無錫,214122)
微生物基因組精簡是通過刪減非必需基因,簡化基因組組成,優化生化代謝網絡,提高對底物和能量的利用效率,獲得更適用的宿主菌株[1-2]。微生物基因組簡化一般選用模式菌株,主要因其具有明晰的遺傳背景和成熟的遺傳學工具。近年來隨著生物信息學技術的發展和分子操作平臺的開發,非模式菌的基因組簡化和底盤化改造受到重視[3-4]。
微生物基因組的大片段刪除手段包括同源重組技術、CRISPR技術和轉座重組技術[5]。在釀酒酵母和粟酒裂殖酵母中,通過線性DNA片段同源重組已獲得了一系列基因組精簡菌株[6-8]。CRISPR/Cas9介導的大片段刪除技術是利用成對sgRNA識別不同的靶位點,引導Cas9產生DNA雙鏈斷裂,進而刪除2個靶位點之間的序列[9],可作為基因組刪減的工具。
產甘油假絲酵母(Candidaglycerinogenes)具有多重抗逆、可高溫濃醪發酵等優點[10-11],有成為強健工業生物宿主的潛質。前期實驗室已完成全基因組測序和適合該菌的CRISPR/Cas9系統的構建[12-13]。基于其多種抗逆性,已成功改造應用于2-苯乙醇[14]和纖維素乙醇等的合成[15-16]。為使產甘油假絲酵母底盤化,本研究以大片段刪除的方式對其基因組進行精簡,在獲得幾個不同缺失程度的突變株后,基于耐受能力和發酵特性進行表征分析,以期為非模式菌底盤化相關研究提供借鑒。
1 材料與方法
1.1 菌株和質粒
本研究使用的菌株和質粒參見表1。

表1 本研究使用的菌株和質粒Table 1 Strains and plasmids used in this study

續表1
1.2 引物設計
本研究所用引物參見表2。


續表2
1.3 試劑與儀器
酵母膏、蛋白胨,Oxoid公司;實驗用各種限制性內切酶、ExTaqDNA聚合酶,TaKaRa公司;質粒小量抽提試劑盒、膠回收試劑盒、柱回收試劑盒和酵母DNA提取試劑盒,生工生物工程(上海)股份有限公司;引物,上海亦欣生物科技有限公司。
P680高效液相色譜儀,美國戴安公司;ALS1296 PCR儀、PowerPac Basic瓊脂糖凝膠電泳儀、Aminex HPX-87H液相色譜柱,美國Bio-Rad公司;AlphaImager凝膠成像儀,Alpha Innotech公司。
1.4 培養基與培養方法
LB培養基(g/L):酵母粉5.0,蛋白胨10.0,NaCl 10.0。氨芐青霉素抗性平板需額外添加100 μg/mL氨芐青霉素。
YPD培養基(g/L):酵母粉10.0,蛋白胨20.0,葡萄糖20.0。固體培養基加入瓊脂20.0 g/L。
玉米漿種子培養基(g/L):葡萄糖100.0,尿素2.0,玉米漿8.0。
玉米漿發酵培養基(g/L):葡萄糖300.0,尿素2.0,玉米漿8.0。
馬鈴薯葡萄糖肉湯培養基(potato dextrose broth,PDB)培養條件:挑取單菌落接種于10 mL YPD培養基,30 ℃,200 r/min培養,12 h后轉接50 mL YPD培養基培養,初始生物量控制為0.2,30 ℃,200 r/min培養48 h。
發酵條件:挑取單菌落接種于50 mL玉米漿種子培養基,于往復式搖床32 ℃、110 r/min培養,19 h后轉接50 mL玉米漿發酵培養基培養,初始生物量控制為0.5,于往復式搖床32 ℃、110 r/min培養。
1.5 pYM-sg的構建
根據文獻[12]和[13]設計C.glycerinogenes敲除靶向目的片段兩端所用的sgRNA。具體來說,通過使用sgRNAcas9 V2.0.10信息學軟件比對基因組序列分析潛在靶點,來設計sgRNA引導序列,通過sg-F/R和6 bp-F/R進行反向擴增模板質粒pMY-sgRNA,然后經測序驗證成功獲得所需質粒。
1.6 URA5回補片段的構建
質粒pMY-sgRNA上具有URA5基因表達框。
根據目的缺失片段設計帶有同源序列的引物Donor Le-F/R和Donor Ri-F/R,以C.glycerinogenesWT基因組為模板,經PCR獲得URA5回補片段左側同源臂Donor Le和Donor Ri。將Donor Le與經限制性核酸內切酶XhoI線性化的pMY-sgRNA連接,這一步獲得的質粒再經限制性核酸內切酶ClaI酶切線性化進一步與Donor Ri連接,即獲得含有目的片段同源區域的URA5回補片段。以Donor Le-F和Donor Ri- R為上下游引物、以構建出的質粒為模板,經PCR可獲得相應的URA5回補片段。
1.7 生物量測定
取1 mL發酵液適當稀釋,使用分光光度計于600 nm下測定吸光值(OD600)。
1.8 發酵液中殘糖、甘油和乙醇含量測定
離心(10 000×g,10 min)收集發酵上清液,用微孔水系濾膜(0.22 μm)過濾,最后利用HPLC測定濃度。具體條件設置參照嵇豪[17]的方法。以甘油含量(g/L)與生物量(OD600)的比值作為單位菌體甘油產量。
1.9 實時熒光定量分析
挑取C.glycerinogenes單菌落于玉米漿種子培養基,32 ℃、往復式搖床110 r/min條件下搖瓶培養,19 h后轉接玉米漿發酵培養基,32 ℃、110 r/min培養24 h。總RNA提取參考JI等[18]的方法。RT-qPCR反應體系與條件參見南京諾唯贊試劑盒說明書。引物序列見表1。相對轉錄水平的計算和分析參考LIVAK 等[19]的方法。
1.10 胞內輔酶Ⅱ NADP(H)的測定
酵母細胞收集后用液氮淬滅,隨后使用輔酶Ⅱ檢測試劑盒對NADP(H)進行提取、測定,具體操作按蘇州科銘試劑盒說明書進行。
2 結果與分析
2.1 成對sgRNA介導的大片段刪除菌株構建
本研究將不含必需基因的長片段確定為敲除區域[20]。其中,7.8 kb長片段為2段互為回文序列9 537 bp IRL1(0~9 537 nt)和9 538 bp IRR2(22 173~31 711 nt)之間的非編碼區序列(經NCBI BLAST后,未比對出基因,下同)(11 433~19 194 nt)(圖1-a)。50 kb片段組成為:一對基因組上的長重復區域9 537 bp IRL1(10 905~20 442 nt)和9 538 bp IRR2(33 078~50 093 bp)、一個含未知蛋白的10 905 bp DNA序列(1 650 bp假設蛋白C5L36_0A06700)、長重復序列間的非編碼區12 636 bp序列、另一個含未知蛋白的7 477 bp DNA序列(1 653 bp假設蛋白C5L36_0A06800)(圖1-b)。25 kb長片段是指含有非編碼區的1 296 bp DNA序列、一對長重復序列其中一支12.68 kb片段IRL2以及10 970 bp的非編碼區序列(圖1-c)。
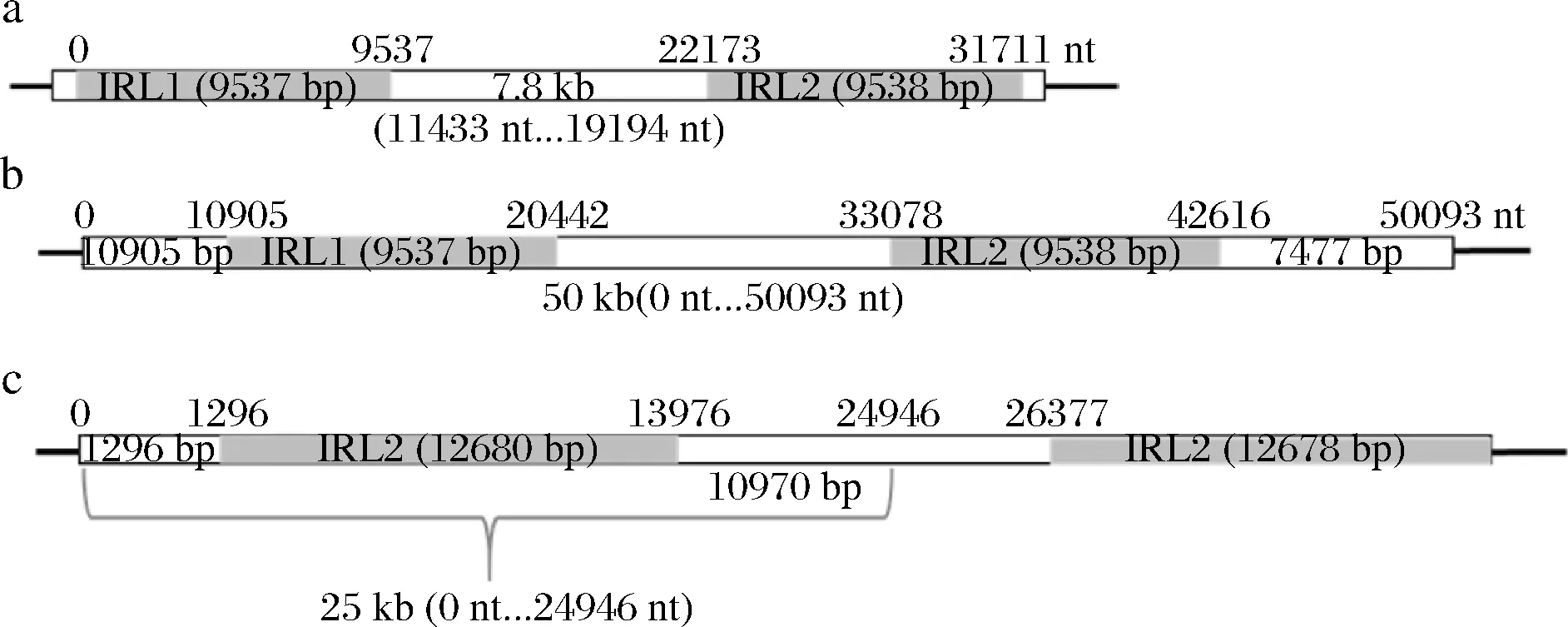
a-7.8 kb長片段;b-50 kb片段;c-25 kb長片段圖1 本研究選擇的敲除區域示意Fig.1 Deletion areas selected in this study
以前期構建的CRISPR/Cas9瞬時表達系統[12-13]為基礎,采用LiAc/SS carrier DNA/PEG的方法將敲除元件Cas9、若干成對的sgRNA和URA5回補片段轉化出發菌株C.glycerinogenesURA5(圖2)。
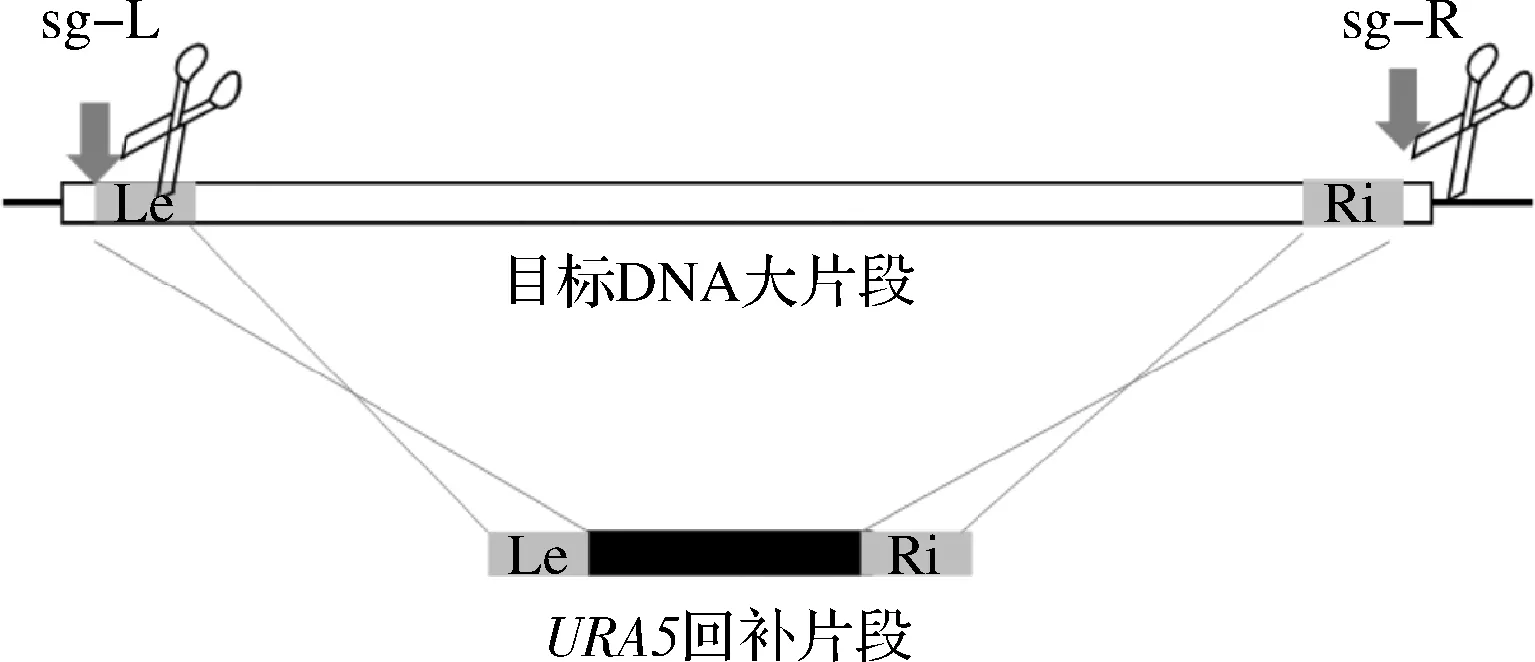
圖2 成對sgRNA介導的大片段敲除示意圖Fig.2 Large fragment deletion guided by pairs of sgRNA
進行7.8 kb長片段敲除鑒定選用的引物如圖3-a所示,PCR驗證結果如圖3-b所示。經類似過程,獲得25、50 kb片段的敲除菌(圖3)。
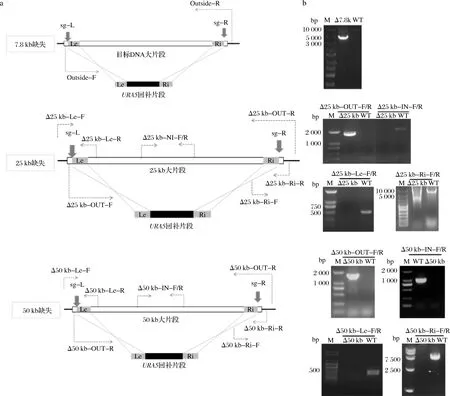
M-核酸分子標準;OUT-F/R-靶片段外部的PCR驗證引物;IN-F/R-靶片段內部的PCR驗證引物;Le-F/R-靶片段上游的PCR驗證引物;Ri-F/R-靶片段下游的PCR驗證引物a-驗證缺失選用引物示意圖;b-核酸電泳驗證圖3 C.glycerinogenes片段缺失菌的構建過程Fig.3 Construction of the genomic deletion C.glycerinogenes
2.2 缺失菌表型評價
表型分析發現,常規培養下Δ50 kb、Δ25 kb菌與野生菌的生物量相近,而Δ7.8 kb菌的最終生物量降低20%。42 ℃下,Δ50 kb菌的最終生物量相比對照無差異,Δ7.8 kb、Δ25 kb菌的生物量下降了20%左右(圖4-a)。Δ25 kb菌缺失了一段基因組上重復序列,真核生物基因組上的重復序列可能參與高溫脅迫下菌株的自我保護功能的發揮[21],因而造成Δ25 kb菌的耐高溫性能減弱。在多種脅迫下,C.glycerinogenes的各缺失菌株仍持有耐受能力(圖4-b),表明缺失的大片段DNA與上述脅迫下菌體抗逆能力無強關聯性。甘油發酵中(圖4-c),12 h時Δ7.8 kb菌的生物量較野生菌高出14.0%。在72 h時相較野生菌,各缺失菌生物量均降低20.0%左右。缺失菌穩定期生物量均低于對照,表明大片段缺失會導致最終生物量降低。發酵至108 h時,Δ7.8 kb菌殘糖約為野生菌的62.5%,糖耗增加39.8 g/L,其他菌的殘糖量則遠高于對照菌,表明該7.8 kb片段缺失促進了糖耗。Δ7.8 kb菌甘油產量與野生菌相似,而單位菌體甘油產量達4.57,提高了22%,表明基因缺失促進了菌體的甘油合成能力。乙醇的合成是此發酵過程葡萄糖另一主要去向,野生菌和Δ7.8 kb菌乙醇產量分別為22.2和36.1 g/L,反映出Δ7.8 kb菌進入糖酵解途徑的碳流有所增大,從而表現為糖耗增加。
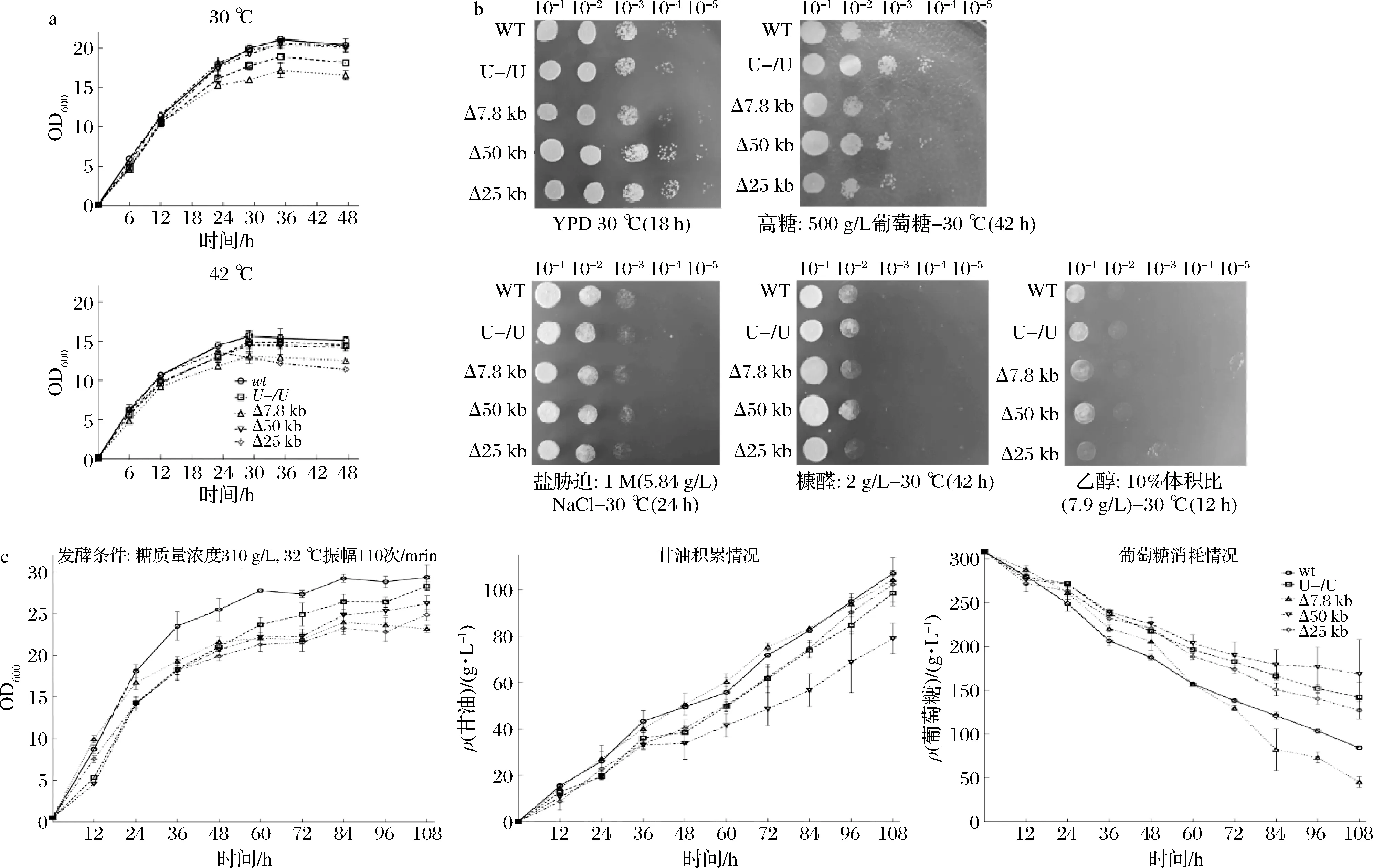
a-在30和42 ℃的YPD搖瓶生長曲線;b-在脅迫條件下進行點滴平板實驗;c-在高糖玉米漿發酵培養基中進行甘油發酵能力測定圖4 缺失菌表型Fig.4 Characterization of genomic deletion strains
2.3 缺失菌表型差異分析
為了考察上述表型的變化與基因調控的潛在關系,以發酵初期生物量最大、單位菌體甘油產量最大的Δ7.8 kb菌為對象,考察葡萄糖代謝相關基因(HXT4、GLK1、PFK-α、PFK-β、PYK1)、高糖脅迫應答相關基因(HOG1、RGT1、SKO1)、抗逆相關基因(OLE1、TPS1、FLO1)、甘油合成關鍵基因(GPD1)、還原力相關基因(G6PD、6PGDH)、競爭途徑乙醇合成關鍵基因(ALD1、ADH1)相對轉錄水平(圖5)。相比野生菌株,Δ7.8 kb菌的G6PD上調了10倍,6PGDH上調了29倍,而其他基因轉錄變化并不明顯,表明該菌的磷酸戊糖途徑更為活躍,主代謝途徑碳流可能受到了重新分配,使得菌株在發酵初期積累更高的生物量,同時能夠提供更多的還原力,強化了菌株的甘油合成能力。為明確Δ7.8 kb菌的磷酸戊糖途徑關鍵基因的過表達是否提高了該途徑的通量,本研究進一步分析了與該途徑密切相關的輔酶Ⅱ NADP(H)(表3),胞內NADPH水平明顯提高,且NADPH/NADP+比值提高了100%,反映磷酸戊糖途徑通量增加。C.glycerinogenes基因組片段的缺失可能對基因起到調控作用,改變了還原力水平,從而影響了生理特性。
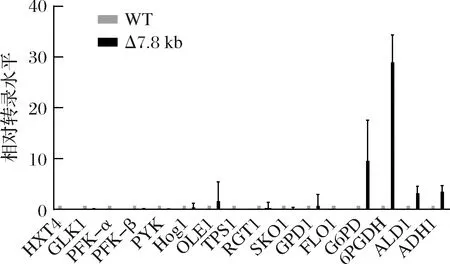
圖5 C.glycerinogenesΔ7.8 kb缺失菌甘油發酵過程中相關基因轉錄水平差異Fig.5 Expression levels of genes related to glycerol ermentation in C.glycerinogenes Δ7.8 kb and WT
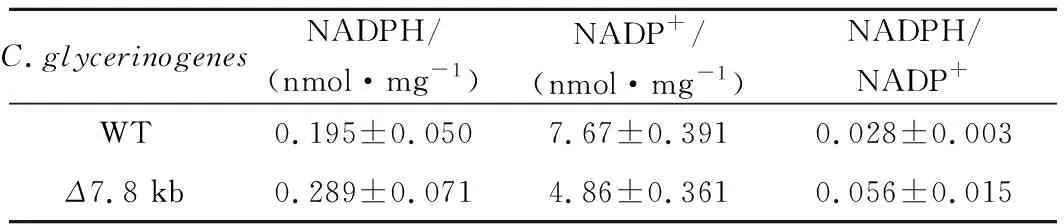
表3 野生型菌株與Δ7.8 kb菌胞內NADP(H)含量Table 3 Contents of NADP(H) in C.glycerinogenes WT and Δ7.8 kb
3 結論
C.glycerinogenes具有優良的抗逆性能和發酵性能,為了更好地適應合成生物學改造的需要,對其進行基因組精簡化的底盤化策略。不同于以往僅應用于靶點敲除,本研究發掘的CRISPR/Cas9系統在C.glycerinogenes基因組上可以進行長達50 kb大片段敲除,為非模式菌底盤化提供可行思路。常規、高溫條件下的培養中,大片段缺失的菌株出現菌體量積累能力減弱。在高糖、高鹽、糠醛、乙醇的環境脅迫下,本研究中基因組不同程度缺失菌株的耐受性能仍然良好。甘油發酵中,缺失菌生物量均下降。而其中Δ7.8 kb菌則出現單位菌體甘油產量增加、糖耗加速,且磷酸戊糖途徑活躍,表明該基因組大片段的缺失可能造成了戊糖磷酸途徑和糖酵解途徑碳流的重新分配,從而促進了菌體甘油合成效率。本研究表明CRISPR/Cas9系統可用于C.glycerinogenes大片段缺失、進行基因組簡化研究,為后續非模式二倍體酵母的底盤化研究提供借鑒。后續對上述大片段基因組功能的研究能夠進一步幫助理解該菌的甘油代謝合成調控機制。

