湘派鹵汁中10種真菌毒素液相色譜串聯質譜法的建立與評價
艾道迎,鄭奕柔,黃展銳*,趙良忠*,林麗丹,周衡平,周凱,周勁松,尹世鮮
1(邵陽學院 食品與化學工程學院,豆制品加工與安全控制湖南省重點實驗室,湖南 邵陽,422000) 2(深圳市通量檢測科技有限公司,廣東省高特異性生物快速檢測工程技術研究中心,廣東 深圳,518038) 3(平江縣勁仔食品有限公司,湖南 岳陽,414000)
鹵制品是我國的傳統食品,種類豐富、口味獨特、食用方便,深受人們喜愛,鹵汁是鹵制品最重要的載體。湘派鹵汁(下文均簡稱鹵汁)通常是在不人為添加防腐劑、護色劑等情況下,將數十種中藥材、菜籽油和動物骨架等熬煮成濃湯與調味料按比例混合熬制而成[1-2]。鹵汁成分復雜,含有脂肪、蛋白質、NaCl、氨基酸、有機酸、糖類及香料成分[3-4],在鹵制品的風味形成中起決定性作用。在業界普遍以“百年傳承,老鹵為珍”的理念下,鹵汁在實際生產過程中一般被反復循環使用,周期從十幾天到上百天不等,每次鹵制時鹵制品中的可溶性營養和風味物質會遷移到鹵汁中[5-7]。此外,鹵汁在生產加工、反復使用過程中,可能因操作管理不規范、儲存不當滋生霉菌,進而產生真菌毒素,增加鹵制品的食品安全風險[8-9]。
真菌毒素是產毒真菌在一定條件下產生的次生代謝產物[10],對人和動物的肝腎、生殖系統具有毒性損害作用,可以誘發人和動物產生各種急性或慢性疾病具有“三致效應”[11-12]。根據鹵汁的各種原料,如食用油、香辛料等中真菌毒素污染狀況調查發現[13-15],在種植、生產、儲存、加工和流通環節均可能因運輸條件不當或儲存環境不適而造成不同程度的真菌毒素污染[16]。一直以來,老鹵汁類產品的企業標準大部分都是按照GB 31644—2018《食品安全國家標準 復合調味料》制定[17],但其中沒有相關真菌毒素含量限定要求,為更好控制市場鹵制品質量,進一步提高鹵汁安全性,開發快速、靈敏、準確的多種真菌毒素同步檢測方法十分必要。
目前,常見的真菌毒素檢測手段有:薄層色譜(thin layer chromatography, TLC)、酶聯免疫吸附測定(enzyme-linked immunosorbent assay, ELISA)、高效液相色譜-熒光檢測(high performance liquid chromatography-fluorescence detection, HPLC-FLD)、液相色譜-串聯質譜(liquid chromatography-tandem mass spectrometry,LC-MS/MS)等[18]。其中,TLC法雖然樣品前處理快速方便,但靈敏度低、重現性較差;ELISA法一般用于定性篩查檢測,且假陽性率高,無法作為確證實驗[19];HPLC-FLD法常用于檢測具有類似化學性質或單一的真菌毒素[10],但定性能力不足,難以完成對多種真菌毒素同步檢測;相較而言,LC-MS/MS技術具有選擇性強、靈敏度高、定量定性分析能力強等優點,是多種毒素同步檢測的最佳方法[20-21]。鹵汁是一種十分復雜的油水混合物基質,其中存在大量脂肪、蛋白質、氨基酸等物質,以及可能存在的其他待測物之間相互干擾易造成基質效應,成為鹵汁中多種真菌毒素同步檢測的主要障礙。
本研究以鹵汁為研究對象,發現常規真菌毒素前處理過程相對繁瑣,易因步驟過多而造成目標毒素損失嚴重,從而回收率降低。通過優化樣品前處理提取和凈化方法,采用同位素內標法校正樣品基質干擾,建立黃曲霉毒素B1(aflatoxin B1, AFB1),黃曲霉毒素B2(aflatoxin B2, AFB2),黃曲霉毒素G1(aflatoxin G1, AFG1),黃曲霉毒素G2(aflatoxin G2, AFG2),伏馬毒素B1(fumonisin B1, FB1),T-2毒素(trichothecenes, T-2),HT-2毒素(系T-2毒素代謝產物),玉米赤霉烯酮(zearalenone, ZEN),赭曲霉毒素(ochratoxin A, OTA),脫氧雪腐鐮刀菌烯醇(deoxynivalenol, DON)等10種湘派鹵汁常見真菌毒素同步檢測的液相色譜-串聯質譜法。為休閑鹵制品行業中真菌毒素定量檢測及政府相關職能部門提供技術支持,保障居民食用健康、安全的鹵制品。
1 材料與方法
1.1 儀器與設備
LC-30AD高效液相色譜儀,日本島津公司;API4000QTRAP質譜儀,美國AB Sciex公司;SB-5200DTD超聲波清洗器,寧波新芝生物科技股份有限公司;VELOCITY18R型臺式冷凍離心機,澳大利亞Dynamica公司;HYQ-3110渦旋混勻器,蘇州捷美電子有限公司。
1.2 材料與試劑
甲醇、乙腈(均為色譜純),上海阿拉丁生化科技股份有限公司;乙酸(色譜純),天津市科密歐化學試劑有限公司;黃曲霉毒素標準品(AFB1、AFB2、AFG1、AFG2),嘔吐毒素標準品(DON),T-2毒素標準品(T-2),HT-2毒素標準品(HT-2),赭曲霉毒素標準品A(OTA),玉米赤霉烯酮標準品(ZEN),青島普瑞邦生物工程有限公司;10種真菌毒素同位素標準品,壇墨質檢科技股份有限公司;實驗用鹵汁樣品取自湖南本地鹵制品公司、小作坊或農貿市場,取樣后于低溫冰箱保存。
1.3 實驗條件
1.3.1 10種真菌毒素混合標準溶液和標準曲線制作
標準儲備液:分別準確稱取10種真菌毒素1 mg(精確至0.01 mg)于稱量瓶中,加入適量甲醇溶液溶解,轉移到10 mL容量瓶定容至刻度,配制成10種各為100 μg/mL真菌毒素標準儲備液,將溶液轉移至試劑瓶中,在-20 ℃下密封保存,有效期1年。
混合標準工作液:分別吸取100 μg/mL標準儲備液各1 mL于10 mL容量瓶中,稀釋配制成10 μg/mL的標準溶液,混勻,轉移至試劑瓶,避光密封儲存于-20 ℃冰箱中,有效期半年。
混合同位素內標工作液:準確吸取250 μL 10種同位素內標于同一容量瓶中,加甲醇定容至刻度,混勻,轉移至試劑瓶在-20 ℃下密封保存,有效期半年。
標準曲線工作溶液:準確移取適量混合標準工作溶液和混合同位素內標工作液,用甲醇配制成10、20、50、100、200 ng/mL的混合標準工作溶液,于4 ℃保存,有效期7 d。
1.3.2 樣品前處理
以鹵汁為例,取2 mL鹵汁試樣于15 mL離心管中,均加入100 μL內標混合工作液,分別加入10 mLV(乙腈)∶V(水)∶V(乙酸)=84∶15∶1提取液,渦旋振蕩3 min,超聲波提取25 min,4 ℃、8 000 r/min離心10 min,在-20 ℃下冷凍35 min,分離上清液,取上層清液1 mL于已提前加入1 mL水的5 mL離心管中稀釋凈化,渦旋混勻,高速離心10 min,取上清液過0.22 μm濾膜上機待測。
1.3.3 色譜條件
色譜柱:Venusil ASB-C18 (2.1 mm×100 mm×3 μm),進樣量3.0 μL,柱溫40 ℃,流速0.5 mL/min;流動相:A為純甲醇,B為一級水,梯度洗脫條件如表1所示。
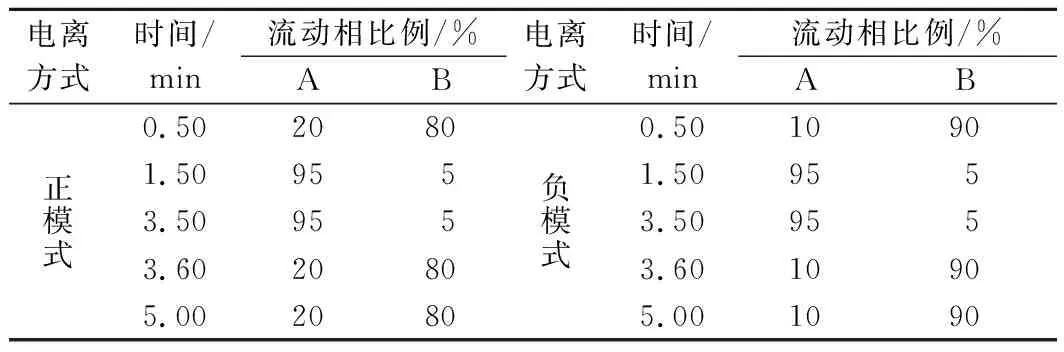
表1 梯度洗脫程序Table 1 Gradient elution procedure
1.3.4 質譜條件
電噴霧離子源(electron spray ionization,ESI),離子源溫度500 ℃;(正模式)氣簾氣:35 psi,氣體1:55 psi,氣體2:55 psi;離子噴霧電壓:(正模式)+5 500 V/(負模式)-4 500 V;(負模式)氣簾氣:35 psi,氣體1:65 psi,氣體2:65 psi;采用多反應監測(multiple reaction monitoring,MRM)模式進行檢測,其他質譜參數見表2。
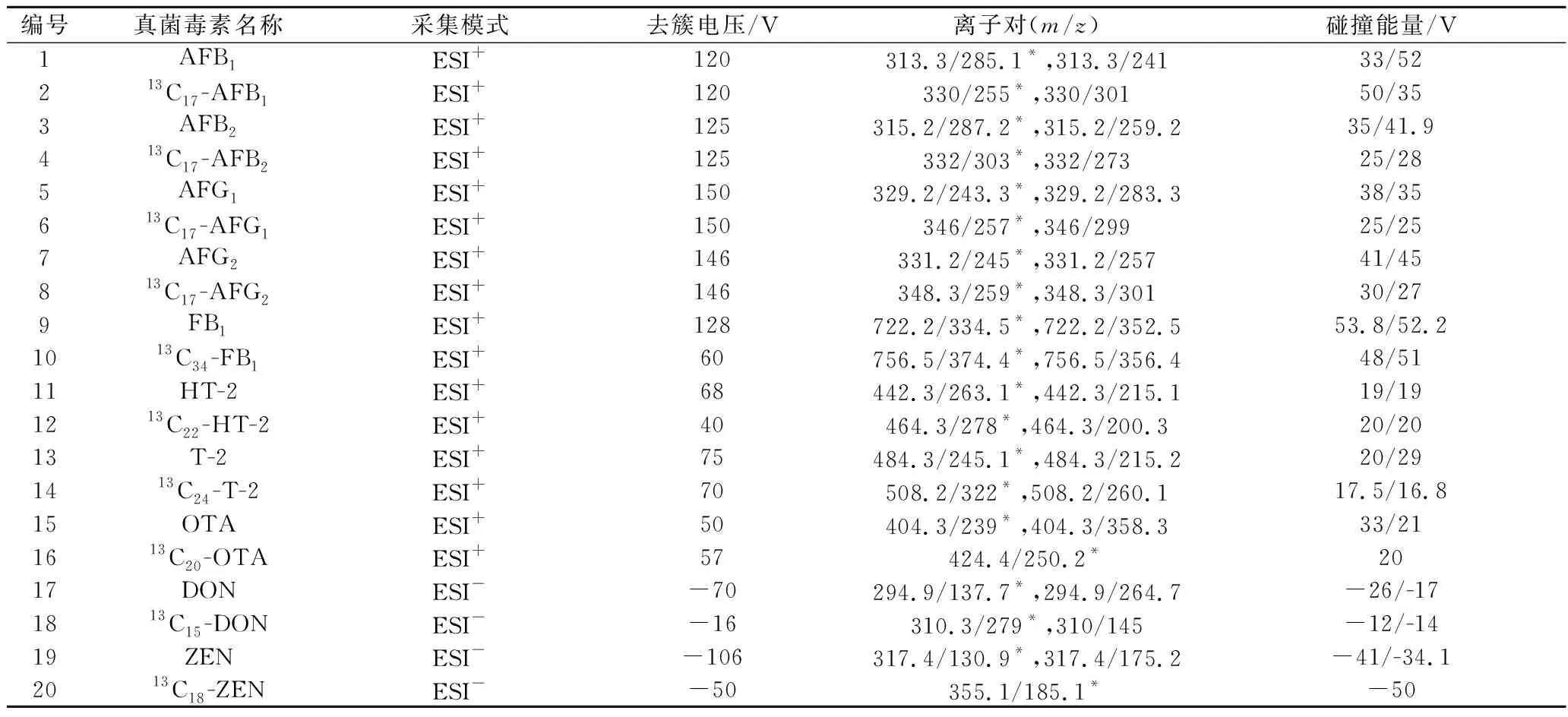
表2 質譜條件參數Table 2 Mass spectrometry condition parameters
2 結果與討論
2.1 真菌毒素的分離優化
本研究通過優化流動相洗脫梯度,優化質譜離子源以及各真菌毒素的碰撞能和去簇電壓等參數,可大幅減少鹵汁復雜基質在目標毒素檢測過程中其他物質的干擾,并以期獲得最佳的檢測靈敏度和分離效率。結合10種目標真菌毒素的結構性質差異,在正、負電離模式下進行母離子掃描,設置掃描范圍為200~800 u,在相同濃度條件的檢測中確定不同模式下化合物的響應值。優化結果表明,DON、ZEN在負模式下響應強度較明顯,其他化合物在正模式下靈敏度較高,MRM色譜圖如圖1和圖2所示。
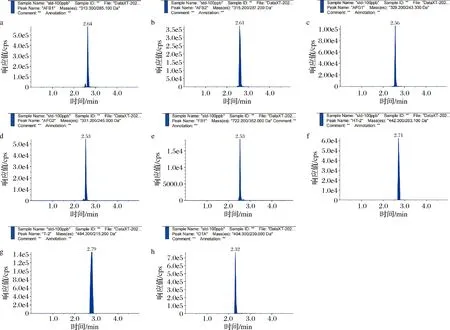
a-AFB1;b-AFB2;c-AFG1;d-AFG2;e-FB1;f-HT-2;g-T-2;h-OTA圖1 八種真菌毒素混標的正模式MRM色譜圖(100 ng/mL)Fig.1 Positive mode MRM chromatogram of eight mycotoxins mixed standards (100 ng/mL)

a-DON;b-ZEN圖2 兩種真菌毒素混標的負模式MRM色譜圖(100 ng/mL)Fig.2 Negative mode MRM chromatogram of two mycotoxins mixed standards (100 ng/mL)
2.2 前處理方法優化
為有效提高目標真菌毒素在鹵汁和菜籽油基質中的提取效率,在流動相一定的基礎上綜合考量10種真菌毒素的極性差異,使用不同有機相及不同比例的提取液進行提取。以鹵汁基質為例,分別考察常用10 mL甲醇、10 mL乙腈、10 mLV(甲醇)∶V(水)=98∶2、10 mLV(乙腈)∶V(水)=98∶2和10 mLV(乙腈)∶V(水)∶V(乙酸)=84∶15∶1提取液進行提取,發現在本實驗中,用甲醇、乙腈、V(甲醇)∶V(水)=98∶2和V(乙腈)∶V(水)=98∶2等4種提取液處理時,基質中大量除目標待測物外的物質被提取液中高比例的有機溶劑提取出,造成檢測靈敏度降低;其次,大部分真菌毒素的回收率也無法滿足要求。經過優化,使用V(乙腈)∶V(水)∶V(乙酸)=84∶15∶1提取液時,對非極性較大的化合物(如赭曲霉毒素、黃曲霉毒素等)和對極性較大的化合物(如伏馬毒素等)提取效果均較好,同時各目標真菌毒素的加標回收率為78.6%~107.3%。綜合考慮,在鹵汁、菜籽油基質中以V(乙腈)∶V(水)∶V(乙酸)=84∶15∶1為前處理提取液,10種真菌毒素均具有良好的提取效果。
2.3 基質效應
基質效應能直接影響檢測結果的準確度,在高效液相色譜-串聯質譜分析時是必須考察的因素[22]。本研究采用溶劑標準曲線和基質標準曲線斜率考察目標毒素在鹵汁和菜籽油中的信號增強或抑制的程度。基質效應按公式(1)計算:
(1)
式中:SSE,基質效應;K1,空白基質配制的標準曲線的斜率;K2,純溶劑標準曲線斜率。
SSE<0.8,表現為基質抑制效應;0.8
2.4 方法學驗證
按1.3.1配制的系列混合標準工作液進行分析,除空白對照組實驗結果,以目標分析物峰面積與相應內標物峰面積的比值為縱坐標(Y)、相應目標分析物的質量濃度(μg/L)為橫坐標(X)繪制標準曲線。線性范圍、回歸方程和相關系系數(R2)見表3。通過目標物在3倍信噪比(S/N=3)和10倍信噪比(S/N=10)下對應的峰面積計算濃度,并確定各目標物的方法檢出限(limit of detection,LOD)和定量限(limit of quantification,LOQ),結果表明10種真菌毒素在線性范圍內線性關系良好,R2>0.998 5。
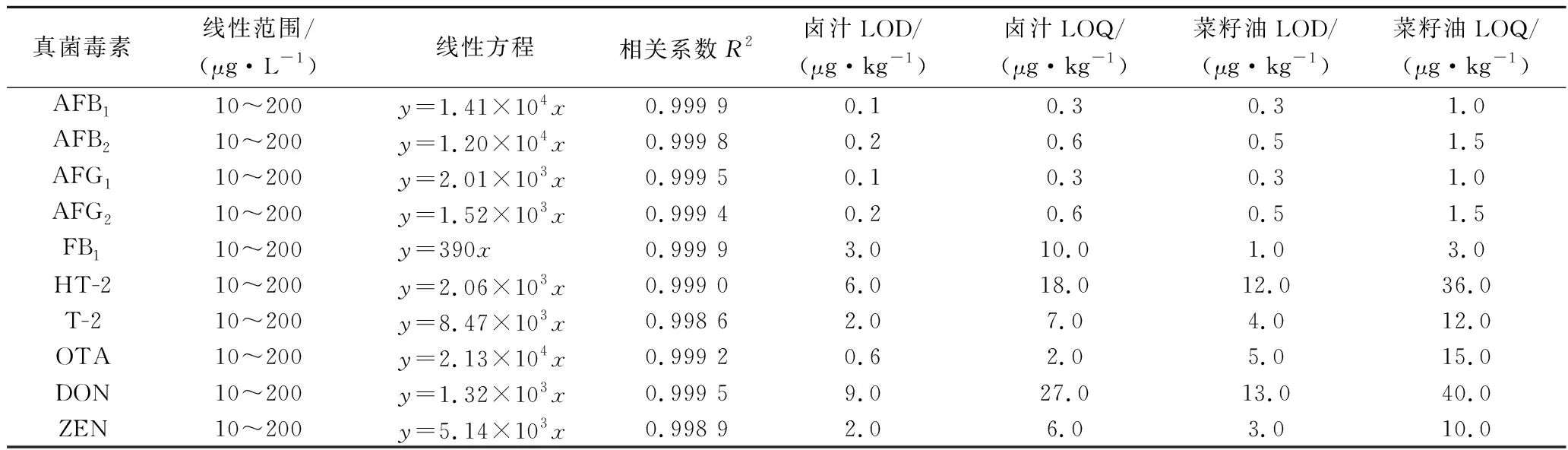
表3 十種真菌毒素的線性關系、檢出限、定量限Table 3 Linear relationships, LOD, and LOQ of the ten mycotoxins
選取鹵汁、菜籽油2類空白基質樣品,進行低、中、高3個濃度水平加標實驗,按1.3.2處理樣品,每個加標水平平行測定6次,計算6次加標實驗的平均回收率以及相對標準偏差(relative standard deviation,RSD)。由表4可以看出,本方法回收率和精密度結果良好,回收率為78.6%~107.3%,RSD<15%,符合GB/T 27404—2008《實驗室質量控制規范 食品理化檢測》的要求,適用于鹵汁中10種真菌毒素的日常檢測。

表4 十種真菌毒素加標回收率及精密度(n=6)Table 4 The spiked recoveries and precision of 10 mycotoxins (n=6)
2.5 實際樣品測定
應用建立的方法,對選取的20份實際樣品連續進樣檢測,結果如表5,其中鹵汁中有1份AFB1檢出,檢出率為7.14%,含量為0.46 μg/kg,3種真菌毒素AFB1、OTA和ZEN在菜籽油中分別有2、1、2份檢出,檢出率分別為33.3%、16.7%、33.3%,含量范圍分別為0.36~0.47 μg/kg、0.59 μg/kg、4.28~5.06 μg/kg,其他毒素均未檢出。菜籽油中有多種真菌毒素檢出但都尚屬較低劑量,這與其他研究結論大致一致,出現此現象原因可能是檢測的多數樣本來自小作坊式土法壓榨,其加工工藝粗糙、衛生安全意識淡薄;此外南方地區高溫潮濕,在菜籽油原料收割、加工和儲存過程中易導致霉菌生長繁殖,受真菌毒素污染風險高[25-26]。在湘派鹵汁中首次檢測出AFB1,這與陳浩等[2]研究結果不一致,分析原因可能是鹵汁熬完后在反復鹵制使用過程中一般溫度控制在90 ℃上下[1],AFB1耐高溫、性質穩定、不易裂解;另外導致該現象的原因可能是熬制鹵汁的原材料(如菜籽油、香辛料等)的加入,由于許多香辛料隸屬于中藥材,和菜籽油一樣從原料種植、采收到貯藏極易受到真菌毒素的侵害發生霉變不便察覺[27],在中藥材中現已有多種真菌毒素被檢出[28-29]。因此為確保休閑鹵制品的安全,保障消費者健康,對鹵汁生產加工和貯藏過程進行真菌毒素的檢測和監管顯得尤為重要。
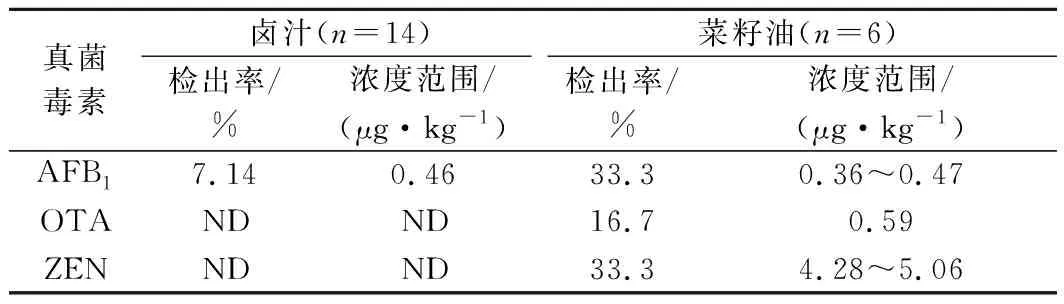
表5 鹵汁、菜籽油實際樣品檢測結果Table 5 The actual sample test results of brine and canola oil
3 結論
本研究通過優化前處理提取液和直接提取稀釋凈化的快速前處理方法,并采用LC-MS/MS檢測和同位素內標定量分析,建立了鹵汁中10種真菌毒素同步檢測方法。經方法學驗證及實際樣品檢測,回收率、靈敏度、檢出限等均滿足方法學要求;該方法前處理簡單、靈敏度好、回收率高且檢測成本低,適用于鹵汁中多種真菌毒素的快速檢測和精準定量。

