例析有機氧化還原反應方程式的配平方法
李明亮 卜慶軍
(1.山東省濰坊第一中學 2.山東省濰坊市教育科學研究院)
高中化學教材對于有機物的氧化還原反應僅做了簡單介紹,未曾涉及復雜反應.近幾年高考題中出現了與有機化合物有關的新型燃料電池,這就對有機物的氧化還原反應方程式配平提出了更高的要求,筆者總結出如下配平方法.
1 平均價態法
平均價態法又稱平均氧化數法,這種方法主要是針對反應物和生成物組成相對簡單且價態明確的氧化還原反應.具體方法是將分子式中的H、O 元素按照常見化合價規定為+1、-2價,根據代數和為0的原則求出C元素的平均化合價,再依據化合價升降總數相等配平氧化還原反應方程式.
例如,乙烯使酸性高錳酸鉀溶液褪色:
先用分子式表示有機物的組成(C2H4),根據乙烯中H 元素的化合價為+1,C 元素的平均化合價為-2,生成物CO2中C 為+4價,故化合價升高12,KMnO4被還原為MnSO4化合價降了5,即系數之比為5∶12,根據原子守恒配平方程式:
2 零價法
零價法是將有機物各元素的化合價人為規定為0價,各元素的化合價變化完全由生成物中各元素的價態決定,從而計算出有機化合物得失電子的數目,進一步配平反應方程式.
有機燃料電池產物中C 元素一般為+4價,在酸性介質中C元素轉換為CO2,堿性介質中一般轉換為,H 元素一般變為+1價氫.
若烴的分子式為CxHy,則在燃料電池中化合價總體升高(4x+y),即1 mol CxHy可以失去(4x+y)mole-.
若是烴的含氧衍生物燃料電池,則O 元素化合價一般是由0→-2,故分子式為CxHyOz的烴的含氧衍生物,在燃料電池中化合價升高(4x+y-2z),1molCxHyOz可以失去(4x+y-2z)mole-.
肼類化合物同樣也是一種常見液體火箭燃料,其燃燒產物一般為CO2、N2和H2O,依據零價法,生成物中N 元素化合價未變化,C 元素升高4價,H 元素升高1價,O 元素降低2價.分子式為CxHyOzNw肼類燃料的化合價升高(4x+y-2z).若燃料為偏二甲肼[(CH3)2NNH2],則1 mol (CH3)2NNH2失去16mole-.
依據零價法得出有機物在燃料電池中化合價升高數目(失電子數)規律:碳4氫1氧減2,生成氮氣氮為0.
例(2021年山東卷,改編)以KOH 溶液為離子導體,分別組成CH3OH-O2、N2H4-O2、(CH3)2NNH2-O2清潔燃料電池,判斷消耗等質量燃料時,哪種燃料電池的理論放電量最大.
分析依據總結的規律,1 molCH3OH 失去6mole-,1 mol N2H4失去4 mol e-,1 mol(CH3)2NNH2失去16mole-,理論放電量與燃料的物質的量和轉移的電子數有關.設消耗燃料的質量均為mg,則CH3OH、N2H4和(CH3)2NNH2放電量分別是16,通過比較可知(CH3)2NNH2理論放電量最大.
3 得失氫氧法
有機物的氧化還原反應還可以從得失氫氧的角度定義,即可以根據定義和得失H、O 原子的個數判斷化合價的升高與降低.
氧化反應:失去1個H 原子對應失去1個電子,化合價升高1;得到1個O 原子對應失去2個電子,化合價升高2.
還原反應:得到1個H 原子對應得到1個電子,化合價降低1;失去1個O 原子對應得到2個電子,化合價降低2.
根據得失氫氧法,該過程中失去2個H 原子,得到2個O 原子,化合價升高6,屬于氧化反應,1 mol間硝基甲苯共失去6 mole-,1 mol轉換為2molCr3+,得到6mole-,其系數之比為1∶1,溶液為酸性,故配平后該方程式為
4 基團示蹤標注法
部分有機反應的特點是分子中個別基團發生了改變(被氧化或者被還原),其余部分固定不變,用平均價態法或者零價法配平,計算量太大,在此種情況下可追蹤反應前后發生改變的部分原子或者原子團,進而可以得出有機化合物得失電子的數目.具體方法就是將發生改變的基團整體定義為0價,然后根據電負性判斷發生變化的基團中反應前后各元素的化合價的變化,判斷轉移電子的數目.
例如,實驗室在水相中用鐵粉還原硝基苯制備苯胺,Fe被氧化為Fe3O4,反應為
根據基團示蹤標注法,追蹤在該過程中發生變化的基團:—NO2→—NH2,依據各元素的電負性,—NO2中的O 為-2 價,N 為+4 價,產物苯胺的—NH2中H 為+1價,N 為-2價,化合價降低6,故1molC6H5—NO2得6 mole-,而Fe被氧化為Fe3O4,化合價平均升高,故苯胺與Fe的系數之比為4∶9,該反應的方程式為
5 聚合物得失電子要乘n
有機高分子聚合物在參加氧化還原反應時,由于其化學式中存在表示鏈節數的n,故在化合價升降過程中要乘以n,在判斷其得失電子數時也要注意乘以n.例如,一種全有機質子二次電池放電原理如圖1所示,電極材料中的P、PO、PR 均為有機高分子化合物.
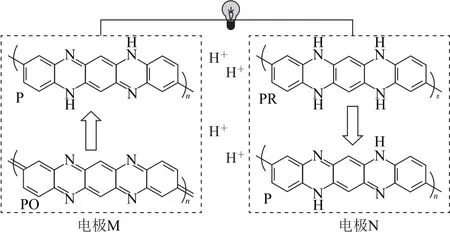
圖1
根據得失氫氧法,放電時,電極M,從結構上看PO→P,得到了2n個H,其化合價降低2n,1molPO得到2nmole-,發生還原反應,為正極,電極反應式為PO+2ne-+2nH+=P;電極N,從結構上看PR→P,失去2n個H,其化合價升高2n,1 molPR 失去2nmole-,發生氧化反應,為負極,電極反應式為
綜上所述,以上幾種方法皆可以判斷出有機物在氧化還原反應中轉移的電子數,而且可以得出正確的結論,因此要具體情況具體分析.
(完)

