豬瘟病毒非結構蛋白NS5A與Beclin1相互作用并促進病毒增殖
張成成,孫嘉豪,王秀玲,張小榮,吳艷濤
(揚州大學獸醫學院,江蘇高校動物重要疫病與人獸共患病防控協同創新中心,揚州 225009)
豬瘟(classical swine fever,CSF)是由豬瘟病毒(classical swine fever virus,CSFV)引起的一種傳染性極強且臨床以高熱、出血和免疫抑制為表征的烈性傳染病,給養豬業造成巨大的經濟損失[1]。CSFV屬于黃病毒科、瘟病毒屬,其直徑為40~60 nm,基因組大小約為12.5 kb[2]。CSFV編碼產生4個結構蛋白(Core、Erns、E1和E2)和8個非結構蛋白(Npro、p7、NS2、NS3、NS4A、NS4B、NS5A和NS5B)[3]。CSFV NS5A是一種多功能的磷酸化蛋白,包括497個氨基酸,定位于細胞的內質網,具有參與病毒復制和調節宿主細胞信號通路的作用,包括細胞周期、細胞內新陳代謝、細胞內mRNA翻譯、蛋白質穩定表達、血管生成和通透性以及胞內蛋白折疊等[4-5]。NS5A與鳥苷酸結合蛋白1互作抑制GTPase活性,進而影響豬瘟病毒的早期復制[6]。Rab1A作為CSFV組裝所必須的蛋白與NS5A存在協同作用,促進病毒粒子的組裝;缺失則導致CSFV的毒力下降[7]。NS5A在細胞內的分布經由Rab18的調節,其復合物參與CSFV RNA復制和病毒粒子組裝[8]。NS5A一方面與熱休克蛋白Hsp27相互作用進而負調控病毒復制[9];另一方面與熱休克蛋白HSP70共定位于細胞質中,其N端氨基酸(29~240)與HSP70結合形成的復合物促進CSFV的復制[10]。此外,HSP90AB1/HSPCB與NS5A也存在相互作用[11]。GRP78與NS5A相互作用,在激活細胞未折疊蛋白反應中扮演重要角色,促進豬瘟病毒的復制[12]。NS5A能與ARFGAP互作促進CSFV復制,另一方面NS5A誘導的內質網應激可經由ARFGAP降低[13]。
研究表明,豬瘟病毒通過激活宿主細胞自噬促進其增殖[14-15]。自噬作為細胞程序性死亡的一種方式,表現為將宿主細胞中受損蛋白質及損傷、衰老的細胞器進行批量降解,而后循環利用細胞內營養物質,參與調節代謝平衡、維持細胞內環境穩態,促進生物體正常生長發育和分化[16-17]。自噬相關蛋白Beclin1、P62/SQSTM1及LC3等,在試驗中經常被用作自噬的標記物[18]。這些基因通常介導自噬小體的形成,并與溶酶體結合[19]。自噬相關基因按其功能分類可分為誘導自噬,囊泡成核、延伸、形成和再循環的自噬過程,以及針對修飾蛋白或受損細胞器的選擇性自噬降解[20]。Beclin1因其24.4%的氨基酸序列與酵母自噬蛋白Atg6相同,成為第一個被證實的正向調節自噬的哺乳動物基因之一[21]。Beclin1在PI3K激酶ClassⅢ復合物中扮演核心角色,該復合物由Vps34、Vps15、Beclin1三個主要亞基組成,作為自噬起始的復合物,其在自噬小體的形成中不可或缺[22]。目前已知Beclin1參與調節多個信號通路,包括PI3K-AKT-mTOR、AMPK、JNK及MAPK等通路[23]。研究表明,Beclin1在宿主感染丙型肝炎病毒(hepatitis C virus,HCV)引起的慢性肝炎病例中起到抑制病毒增殖作用[24]。在Fu等[25]的研究中,Beclin1等自噬相關基因表達增加可通過調節自噬促進病毒增殖。經研究HCV NS5A通過活化蛋白C激酶1受體受體與III類PI3K復合物相互作用[26]。
但Beclin1蛋白在CSFV誘發宿主細胞發生自噬的過程中是否發揮作用及其作用機制,還未見研究報道。本研究旨在探究宿主蛋白Beclin1在CSFV NS5A激活細胞自噬反應過程中所發揮的影響。研究結果表明,Beclin1蛋白促進CSFV增殖的機制是通過與CSFV NS5A的相互作用調控PI3K/Akt通路來實現,為豬瘟的有效防控提供理論依據。
1 材料與方法
1.1 材料
1.1.1 生物材料 豬瘟病毒CSFV Shimen株,豬腎細胞系(ST)和非洲綠猴腎細胞(Vero)由本實驗室保存。真核表達載體pDsRed1-N1購自Clontech公司,pcDNATM3.1(+)購自Invitrogen公司。
1.1.2 主要試劑 DMEM培養基、TMB顯色液、T4 DNA連接酶均購自Thermo Fisher Scientific公司;HRP標記羊抗鼠IgG和HRP標記羊抗兔IgG購自Sigma公司;胎牛血清(FBS)購自LONSERA公司;限制性內切酶BamHⅠ、EcoRⅠ和XhoⅠ購自NEB公司;超純RNA提取試劑盒購自江蘇康為世紀生物科技有限公司;AxyPrep DNA凝膠回收試劑盒及AxyPrep質粒DNA小量提取試劑盒均購自康寧生命科學(吳江)有限公司;Trans1-T1感受態細胞、反轉錄試劑盒、EasyTaq?DNAPolymerase、瓊脂糖等均購自北京全式金生物技術有限公司;AceQ qPCR Probe Master Mix購自南京諾唯贊生物科技股份有限公司;DL2000 Marker,DL10000 Marker均購自TaKaRa公司;青霉素/鏈霉素/兩性霉素B溶液(無菌)購自生工生物工程(上海)有限公司。
1.1.3 主要儀器設備 PCR擴增儀及實時熒光定量PCR儀,杭州博日科技有限公司;電泳儀、泳凝膠成像系統,上海天能科技有限公司;CO2恒溫培養箱,Thermo Fisher Scientific公司;倒置熒光光顯微鏡,Olympus Corporation公司;倒置光學顯微鏡,Leica儀器有限公司;超凈工作臺,蘇州凈化設備有限公司。
1.2 方法
1.2.1 細胞培養 在無菌離心管中加入5 mL DMEM培養液備用,從液氮罐中取出凍存的ST細胞迅速放入37 ℃水浴中溶化至冰水混合狀態,輕輕吹打數次轉入準備好的離心管中,1 000 r·min-1室溫離心2 min,將沉淀轉入含有10%FBS的DMEM中,37 ℃、5% CO2培養24~48 h,顯微鏡下觀察細胞生長狀況,在細胞呈現單層生長時傳代。棄去培養液,PBS緩慢清洗2~3次,加入胰蛋白酶消化2~3 min,當細胞呈現大部分脫落后加入血清終止消化,反復吹打至細胞成單個,加入培養液繼續培養。
1.2.2 熒光定量PCR檢測方法 將處于對數生長期的豬源細胞,在其匯集度在70%左右時更換DMEM基礎培養基;接種1個moi量的CSFV,吸附1 h后,更換含有10%FBS的DMEM培養基作用6、12、24、36、48 h后收集細胞。參照江蘇康為世紀生物科技有限公司生產的試劑盒的說明書的步驟提取總RNA,提取完成后將之反轉錄為cDNA。反轉錄體系:5×TranScript?RT Buffer 2 μL,TranScript?RT 0.5 μL,RI 0.25 μL,dNTPs 2 μL,6 nt 1 μL,Total mRNA 4.25 μL。反轉錄條件:25 ℃ 5 min,42 ℃ 30 min,85 ℃ 5 min。反轉錄產物-20 ℃保存備用。
參照GenBank數據庫中公布的Susscrofa的Beclin1、Vps34、Vps15、ATG14L、UVRAG的基因序列進行綜合分析,設計設計PCR擴增的上、下游引物,送交南京金斯瑞生物科技有限公司合成。引物序列見表1。

表1 PCR引物序列
將反轉錄得到的cDNA稀釋為100 ng·μL-1,按照SYBR Green PCR MasterMix操作說明,利用上述合成的熒光定量引物分別對CSFV感染細胞中Beclin1、Vps34、Vps15、ATG14L、UVRAGmRNA水平進行相對熒光定量,RT-PCR反應體系:2×AceQ?qPCR SYBR GREEN Master Mix 10 μL,cDNA 2 μL,Forward Primer 0.5 μL,Reverse Primer 0.5 μL,dd H2O 補齊至20 μL。每個樣品重復3次。反應程序:50 ℃ 2 min,95 ℃ 2 min;98 ℃ 15 s,58 ℃ 15 s,72 ℃ 1 min,40個循環。
1.2.3 重組表達載體的構建 取獲得的ST細胞的cDNA,使用設計的特異性引物擴增帶有不同酶切位點的Beclin1基因的片段。通過BamHⅠ、EcoRⅠ和XhoⅠ等酶作用進行雙酶切后與相應載體連接分別克隆至對應載體用于后續試驗。
1.2.4 Western blot 細胞質、細胞核蛋白的提取參照上海生工生物工程技術服務有限公司生產的試劑盒說明書的步驟進行:收集CSFV感染6、12、24、36、48 h的ST細胞,用預冷的PBS洗后,用細胞刮刀收集細胞,1 000 r·min-1離心2~3 min,棄上清留沉淀備用。將新鮮配制的200 μL RIPA(含2 μL 100×PMSF)裂解液裂解蛋白,冰上裂解10~15 min,將充分裂解的蛋白于4 ℃、12 000 r·min-1離心15 min,讓細胞碎片沉入EP管底,吸取含有蛋白的上清至新的預冷的EP管里,抽取適量的上清利用BCA法測定蛋白濃度。剩余的上清蛋白液中加入一定量的5×SDS PAGE Loading buffer,金屬浴100 ℃10 min使蛋白質變性。依據所測目的蛋白大小配制對應濃度的SDS-PAGE膠,電泳恒壓120 V 90 min,完畢后冰上轉印至PVDV膜上,電泳恒流120 mA 90 min,然后采用5%脫脂奶粉室溫封閉2 h;TBST緩沖液洗膜2~3次,每次5 min;4 ℃過夜孵育一抗;TBST緩沖液漂洗3次,每次5 min;加入二抗室溫孵育2 h,TBST緩沖液漂洗3次,每次15 min。將清洗干凈的PVDV膜置于ECL發光成像儀中顯影照相,分析結果并保存。
1.2.5 免疫共沉淀 將NS5A-Flag和Beclin1-Myc重組載體共轉染ST細胞48 h后,收集細胞,用RIPA(含1% 100×PMSF)裂解液裂解蛋白,冰上裂解10~15 min。根據Thermo ScientificTMPierceTMc-Myc Tag co-IP說明書,將裂解所獲蛋白液與抗c-Myc或抗Flag瓊脂糖親和凝膠進行免疫共沉淀試驗。簡要步驟如下:將200 μL細胞裂解液與10 μL瓊脂糖漿混合,并使用150 μL TBS(25 mmol·L-1Tris鹽酸,0.15 mol·L-1氯化鈉,pH7.2)稀釋的50 μL陽性對照作為陽性對照,在4 ℃下孵育過夜。免疫沉淀用TBST洗滌3次,并在2×非還原樣品緩沖液中重懸。煮沸5 min后,在樣品中加入2 μL的2-ME,用特異性抗體進行免疫印跡分析。
1.2.6 GST-pulldown 按照GST-Pulldown說明書,IPTG誘導BL21原核表達pEGX-6p-1-Beclin1和pEGX-6p-1空載體;用預冷的200 μL TBS重懸菌體,離心后加入200 μL Pulldown裂解液,冰上裂解30 min,離心收集上清;將上清液與GST瓊脂糖珠孵育2 h,離心收集GST-p17-瓊脂糖復合沉淀物;收集已在真核細胞中表達的NS5A-Flag細胞蛋白,加入適量pulldown裂解液,冰上裂解30 min,離心收集上清(含NS5A-Flag蛋白);將收集的NS5A-Flag上清液和GST-Beclin1瓊脂糖復合物中孵育過夜;離心棄上清,得到Beclin1-NS5A結合復合在此復合物中加入EB洗液(含谷胱甘肽),離心吸取40 μL上清,加入10 μL 5×蛋白上樣緩沖液,通過Western blot檢測目的蛋白。
1.2.7 激光共聚焦顯微鏡方法 將細胞爬片置于75%乙醇中消毒15 min后放入24孔板中,在24孔板內接種ST細胞,當細胞密度達到70%~90%時,將重組質粒Beclin1-Myc和NS5A-Flag共同轉染至ST細胞。轉染48 h后,棄去培養基后PBS清洗3次,每次5 min。預冷的無水甲醛固定15 min,棄掉固定液,PBS清洗3次,每次5 min;5%脫脂奶封閉1 h;吸棄封閉液,孵育一抗(兔抗Myc單抗和鼠抗Flag單抗);孵育二抗(FITC標記的羊抗兔IgG、Cy3標記的羊抗鼠IgG);避光加入DAPI(1∶2 000稀釋)染色15~20 min;利用倒置熒光顯微鏡觀察結果;指甲油封片后滴一滴10%甘油,用激光共聚焦顯微鏡DIPA、FITC、Cy3激發光激發熒光,觀察Beclin1與NS5A位置分布。
2 結 果
2.1 真核表達載體構建
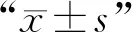
Beclin1基因的PCR擴增:收取ST細胞RNA樣后,加入Trizon后提取RNA并反轉錄成cDNA,用EasyTaq?DNAPolymerase酶PCR擴增Beclin1全長,取部分產物進行電泳;由圖1A所示條帶大小和預期相符。
重組質粒雙酶切鑒定:將Beclin1全長產物與pDsRedN1空載體雙酶切后,22 ℃連接1 h并進行轉化,將菌液PCR鑒定為陽性的菌液擴大培養,提取質粒后采用對應酶進行雙酶切并進行電泳鑒定。結果見圖1B,條帶大小與預期一致。
M1. DL2000 DNA相對分子質量標準;1.Beclin1基因PCR擴增;M2.DL5000 DNA相對分子質量標準;2.重組載體雙酶切鑒定
2.2 豬瘟病毒及NS5A蛋白上調Beclin1蛋白表達
ST細胞在感染CSFV及轉染表達NS5A蛋白后,于不同時間點分別收取RNA及蛋白樣品,利用qRT-PCR及Western blot分別檢測Beclin1轉錄及蛋白水平變化,結果如圖2顯示,CSFV感染及NS5A蛋白均能顯著上調Beclin1的表達水平。
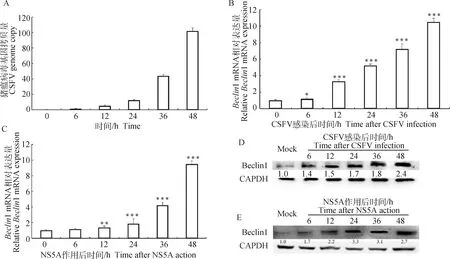
A. qRT-PCR檢測CSFV增殖量;B. qRT-PCR檢測CSFV對Beclin1表達影響;C. qRT-PCR檢測NS5A對Beclin1表達影響;D. Western blot檢測CSFV對Beclin1表達影響;D. Western blot檢測NS5A對Beclin1表達影響。與對照組相比,*.P<0.05;**.P<0.01;***.P<0.001
2.3 Beclin1蛋白對CSFV增殖影響
將Beclin1-RedN1真核表達載體轉入ST細胞,實現對Beclin1蛋白的過表達,同時,設置空載體轉染組作為對照;之后感染CSFV,于不同時間點收取細胞樣品,結果如圖3所示,CSFV復制水平顯著提高。相反,利用si-RNA敲低Beclin1表達后,CSFV增殖受到顯著抑制。

A.過表達Beclin1后qRT-PCR檢測Beclin1表達水平;B.過表達Beclin1后qRT-PCR檢測CSFV增殖水平;C.敲低Beclin1后qRT-PCR檢測Beclin1表達水平;D.敲低Beclin1后Western blot檢測Beclin1表達水平;E. qRT-PCR檢測CSFV增殖水平;**.P<0.01;***.P<0.001
2.4 Beclin1與CSFV NS5A相互作用研究
進行免疫共沉淀試驗驗證Beclin1蛋白是否與NS5A相互作用。將Beclin1-Myc和NS5A-Flag質粒共轉染ST細胞24 h,細胞裂解液與抗Flag親和凝膠免疫共沉淀。最后,用蛋白印跡法檢測復合物中的蛋白。結果顯示,Beclin1-Myc和NS5A-Flag蛋白相互作用(圖4)。
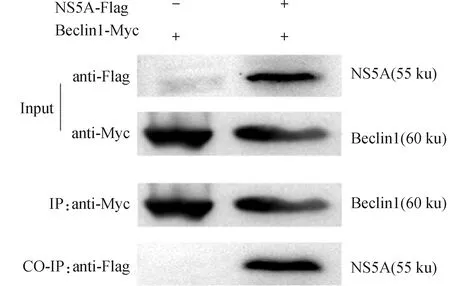
用NS5A-Flag和Beclin1-Myc質粒共轉染ST細胞48 h后收取蛋白樣。樣品經抗Flag的抗體免疫沉淀,然后進行免疫印跡分析
采用GST-pulldown試驗,進一步證實Beclin1與NS5A之間的相互作用在體外條件下是否成立。重組全長Beclin1-GST融合蛋白和GST蛋白分別在大腸桿菌BL21(DE3)菌株中誘導表達,并將NS5A-Flag轉染到ST細胞中。采用GST-pulldown法檢測Beclin1與NS5A之間的關系。如圖所示,在Beclin1-GST復合物中檢測到NS5A-Flag(圖5)。該結果說明Beclin1在體外可以與NS5A相互作用。
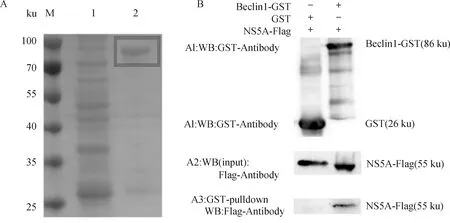
A. GST空載體及Beclin1-GST重組質粒原核誘導表達;B. GST-pulldown試驗驗證蛋白互作
利用激光共聚焦顯微鏡觀察Beclin1與NS5A在ST細胞中的亞細胞定位,在ST細胞中共轉染Beclin1-RedN1和NS5A-GFPC1真核表達載體。36 h后制備細胞爬片,利用多聚甲醛固定后試驗DAPI對細胞核進行染色,最后在激光共聚焦顯微鏡下進行觀察。如圖所示,在共轉染Beclin1-RedN1和NS5A-GFPC1的細胞(黃色斑點)中,NS5A與細胞Beclin1有明顯的共定位(圖6)。
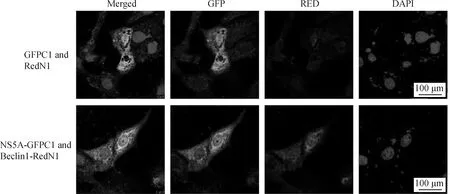
用Beclin1-RedN1和NS5A-GFPC1共轉染ST細胞,同時設置空白載體RedN1與GFPC1作為對照
2.5 CSFV對PI3K/Akt通路相關因子表達影響
收取感染CSFV不同時間點ST細胞樣品,利用qRT-PCR方法檢測PI3K/Akt通路相關因子VPS34、VPS15、ATG14L與UVRAG等基因表達情況。結果如圖7所示,PI3K/Akt通路相關因子都呈現出不同程度的升高趨勢,其中VPS34表達變化水平最高。當利用siRNA敲低Beclin1表達水平后,感染CSFV,收取不同時間點細胞樣品,利用qRT-PCR檢測PI3K/Akt通路相關因子VPS34、VPS15、ATG14L與UVRAG等基因表達情況。結果如圖8所示,VPS34、VPS15、ATG14L與UVRAG基因上調表達受到明顯抑制。
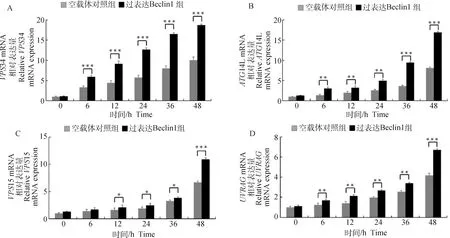
A. qRT-PCR檢測VPS34表達;B. qRT-PCR檢測ATG14L表達;C. qRT-PCR檢測VPS15表達;D. qRT-PCR檢測UVRAG表達。*.P<0.05;**.P<0.01;***.P<0.001
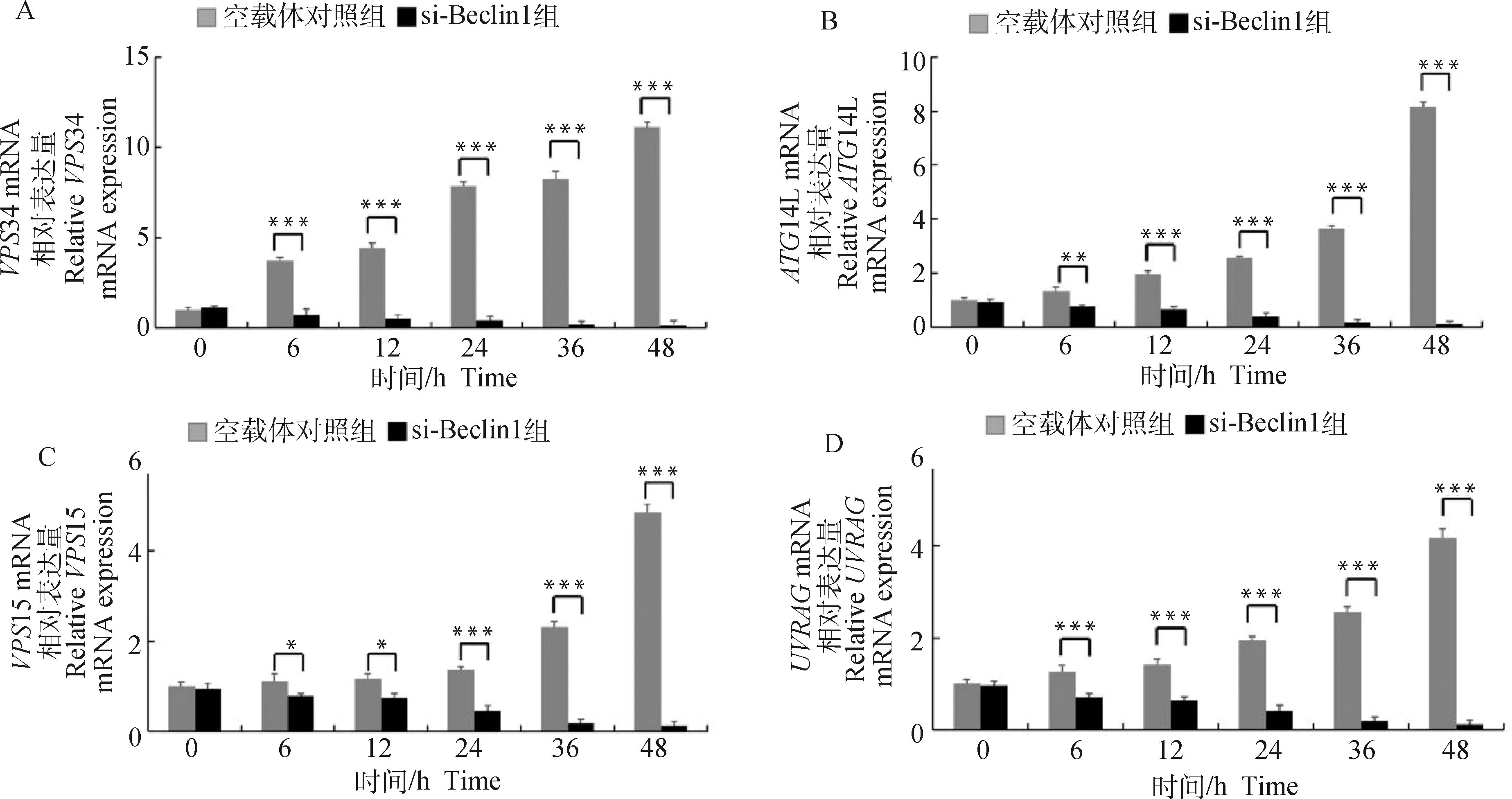
A. qRT-PCR檢測VPS34表達;B. qRT-PCR檢測ATG14L表達;C. qRT-PCR檢測VPS15表達;D. qRT-PCR檢測UVRAG表達;**.P<0.01;***.P<0.001
3 討 論
CSFV感染可以誘導宿主細胞發生完全自噬,自噬體的激活有助于病毒的復制及其病毒顆粒的成熟[14,27]。CSFV通過調控多種信號通路來完成感染與復制。PI3K/Akt信號通路在細胞的眾多病理生理過程中扮演重要角色[28]。當前研究證實,與CSFV同屬于黃病毒科的丙型肝炎病毒(HCV)可通過活化PI3K/Akt通路來影響其自身復制[29]。研究發現,CSFV感染可通過活化PI3K/Akt通路來促進CSFV復制[30]。CSFV NS5A蛋白定位于宿主細胞的內質網,對CSFV的生長和病毒RNA的合成具有重要意義[4]。LC3作為主要的自噬標記物常用于評估自噬溶酶體的形成,其作為PI3K/Akt通路上的自噬相關蛋白,與CSFV NS5A蛋白存在相互作用并可誘導完全自噬[15]。本文所研究的Beclin1蛋白,在PI3K激酶ClassⅢ(Class Ⅲ phosphatidylinositol 3-Kinase)復合物中扮演核心角色,該復合物由Vps34、Vps15、Beclin1三個主要亞基組成,作為自噬起始的復合物,在自噬小體的形成中不可或缺[22]。Twu等[31]研究證實,Beclin1敲低細胞系中,HCV和SARS-CoV-2的復制減少。PI3K復合物中的ATG14L的敲低/敲除可抑制HCV復制[32]。另一研究表明,Beclin1作為VPS34活性調控的關鍵因子,兩者的降低均減少HCV復制[33]。有研究表明,HCV NS5A通過活化蛋白C激酶1(RACK1)受體與Ⅲ類PI3K復合物相互作用[26]。
本研究證實,ST細胞感染CSFV或轉染表達NS5A蛋白后,Beclin1在轉錄及蛋白水平上表達均顯著上升。通過免疫共沉淀及GST-pulldown等試驗證實Beclin1與NS5A存在相互作用。當過表達Beclin1時,CSFV的復制水平顯著增強;作為另一佐證,ST細胞干擾Beclin1表達后CSFV復制量顯著減少。
此外,Funderburk等[34]研究證實Beclin1及其相關蛋白VPS34、VPS15、UVRAG結合,誘導自噬小體的形成。UVRAG的表達與VPS34酶活性的增加相關,提示Beclin1-UVRAG-VPS34-VPS15復合物在自噬調節中發揮了作用。與此同時,細胞內Atg14L的存在主要依賴于Beclin1蛋白,Beclin1的缺失會大大降低Atg14L蛋白水平,這對自噬小體的形成至關重要[34]。本研究采用RT-PCR初步證實Beclin1的過表達及敲低影響VPS34、VPS15、ATG14L及UVRAG等級聯因子的表達,結果呈正相關。VPS34基因的mRNA表達在感染后6 h呈現明顯的持續上升趨勢,差異極其顯著(P<0.001)(圖7);相反,當ST細胞轉染si-Beclin1后感染CSFV,VPS34基因的mRNA表達水平呈現下降趨勢(圖8)。VPS15作為自噬早期復合體的關鍵調控因子的另一基因,當ST細胞過表達Beclin1后感染CSFV,其mRNA表達水平相較于轉染空載體接毒組上調較為緩慢;VPS15基因的mRNA表達在感染后12 h呈現明顯的持續上升趨勢,差異顯著(P<0.05);相反,當ST細胞轉染si-Beclin1后感染CSFV,VPS15基因的mRNA表達水平呈現輕度下降趨勢。ATG14L作為另一自噬早期復合體結合蛋白,當ST細胞過表達Beclin1后感染CSFV,其mRNA表達水平相較于轉染空載體接毒組上調顯著;ATG14L基因的mRNA表達在感染后6 h呈現較明顯的持續上升趨勢(圖7)。相反,當ST細胞轉染si-Beclin1后感染CSFV,ATG14L基因的mRNA表達水平下降趨勢較明顯(圖8)。UVRAG與Beclin-1/PI3KC3復合體相關,其能促進PI3KC3酶促活性和自噬。當ST細胞過表達Beclin1后感染CSFV,其mRNA表達水平相較于轉染空載體接毒組上調趨勢并不顯著;UVRAG基因的mRNA表達在感染后24 h呈現較明顯的持續上升趨勢,差異顯著(P<0.05)(圖7)。相反,當ST細胞轉染si-Beclin1后感染CSFV,UVRAG基因的mRNA表達水平下降趨勢顯著(圖8)。上述結果證實,Beclin1等自噬相關因子通過形成PI3K自噬復合體促進豬瘟病毒復制。
綜上所述,本研究證實Beclin1蛋白可通過活化PI3K/Akt信號通路并與CSFV NS5A蛋白互作來促進CSFV復制,為豬瘟的有效防控提供理論依據。
4 結 論
本研究證實了ST細胞感染CSFV或轉染表達NS5A蛋白后,均可上調細胞Beclin1及PI3K/Akt通路相關因子表達水平。此外,作者發現Beclin1蛋白對CSFV復制起到明顯促進作用;且Beclin1蛋白能夠與CSFV NS5A發生相互作用。提示作為自噬體的重要起始蛋白Beclin1蛋白,通過調控PI3K/Akt通路中的相關蛋白促進病毒的增殖。

