豬流行性腹瀉病毒TaqMan檢測方法的建立及基于S基因的遺傳變異分析
翟 剛,顧文源,劉 濤,劉 瑩,張 帥,范京惠*,左玉柱*
(1.河北農業大學動物醫學院,保定 071001; 2.河北省獸醫生物技術創新中心,保定 071001;3.河北省動物疫病預防控制中心,石家莊 050000; 4.瑞普(保定)生物藥業有限公司,保定 071001)
豬流行性腹瀉(porcine epidemic diarrhea, PED)是由豬流行性腹瀉病毒(porcine epidemic diarrhea virus, PEDV)引起的一種急性、傳染性強的腸道疾病[1-2]。可導致豬產生腹瀉、嘔吐、厭食和脫水等臨床癥狀,仔豬感染該病后的死亡率極高[3-4];此外,該病具有接觸傳播的特性,可以通過污染的水、飼料等途徑進行傳播,這就限制了豬以及副產品的進出口貿易[3,5-6]。因此,該病毒嚴重影響了養豬業的健康發展,研發快速、靈敏的檢測技術,制定正確的防控策略是極為重要的。PED最早于1971年出現在英國,隨后于1978年首次分離該病毒株,并命名為CV777[7-8]。此后在日本、韓國和泰國等國家相繼發現PEDV,在2010年以前,PEDV呈零星分布。2010年至今,PEDV變異毒株呈現出致病性更強、流行范圍更廣的特點,這就給PEDV的防控帶來了更大的壓力[3,9-10]。
PEDV為帶囊膜的單股正鏈RNA病毒,屬于甲型冠狀病毒屬,其基因組全長約為28 kb,共含有7個開發閱讀框,分別編碼ORF1a、ORF1b、Spike(S)、ORF3、envelope(E)、membrane(M)、nucleoprotein(N)[9,11-13]。其中,S蛋白為PEDV的纖突蛋白,是病毒表面的最大結構蛋白,含有多個中和表位,是其主要的抗原蛋白,在病毒入侵宿主細胞和誘導機體產生中和抗體等方面發揮著重要的作用。編碼S蛋白的S基因是PEDV的重要毒力基因,該基因的堿基突變、插入和缺失會造成PEDV毒力的增強或減弱。該基因還是PEDV分型的重要依據。因此,深入研究S基因的結構以及生物特性有助于掌握PEDV的遺傳變異規律。目前有多種PEDV的檢測方法,狄亞心等[14]建立了RT-LAMP檢測方法,李飛等[15]建立了SYBR Green Ⅰ qPCR檢測方法,但均存在耗時長、敏感性差等問題。因此,在PEDV的防控方面,建立一種特異性強、敏感性高、耗時短的TaqMan qPCR檢測方法,優先對豬場進行PEDV的快速全面篩查,再對陽性樣品進行S基因擴增分析,可以實現對豬場不同流行毒株的檢測,在PEDV病原診斷和基因結構分析等方面具有更廣闊的應用前景。
本研究根據GenBank登錄的PEDV毒株AJ1102的M基因保守序列設計了一對熒光引物和探針,建立了一種敏感性高、特異性強、操作簡便的TaqMan qPCR檢測方法,并對檢測為陽性的樣品進行S基因擴增。本研究不僅可以實現對PEDV不同毒株的檢測和病毒拷貝數準確定量、還為豬場預防和控制PED的發生及傳播提供理論依據。
1 材料與方法
1.1 病料的采集與處理
2021—2022年,自河北省規模化養豬場采集疑似PED腹瀉樣品(糞便或小腸內容物)。豬圓環病毒2型(PCV2)、傳染型胃腸炎病毒(TGEV)、豬繁殖與呼吸綜合征病毒(PRRSV)、偽狂犬病毒(PRV)、豬瘟病毒(CSFV)以及豬丁型冠狀病毒(PDCoV)均由河北農業大學動物醫學院預防獸醫學實驗室保存。
1.2 主要試劑
反轉錄試劑盒購自北京聚合美生物科技有限公司;DH5α感受態細胞由本實驗室制備;Fast TaqMan Mixture購自北京康為世紀生物科技有限公司;DNA純化試劑盒、質粒小提試劑盒購自杭州倍沃醫學科技有限公司;豬流行性腹瀉病毒通用型實時熒光RT-PCR檢測試劑盒購自國測生物;pMD19-T載體、DL2000 DNA Marker購自寶生物工程(大連)有限公司。
1.3 引物設計
參考GenBank上登錄的PEDV毒株AJ1102的M基因保守序列應用Primer Premier 5.0軟件設計特異性熒光引物PEDV-F/R和探針PEDV-P以及PEDVS全基因擴增引物PEDVS-F/R(表1),引物由生工生物工程(上海)股份有限公司合成。

表1 PEDV的引物及探針
1.4 qPCR標準品的制備及檢測方法的建立
用PEDV引物PEDV-M-F和PEDV-M-R擴增從PEDV樣品中提取RNA,并反轉錄成cDNA,PCR產物經瓊脂糖凝膠電泳檢測為陽性后,對其進行回收純化,隨后將產物與pMD19-T載體經連接轉化、菌液PCR鑒定為陽性的樣品送至上海生工生物技術有限公司進行測序鑒定。提取鑒定為PEDV陽性菌質粒作為qPCR標準品,通過Nanodrop 2000測定質粒濃度,換算為質粒拷貝數。
對反應條件的不同變量進行優化;將標準品進行10倍的倍比稀釋,選取9個不同的濃度(1.09×109~1.09×101拷貝·μL-1)作為模板在最優反應條件下進行qPCR擴增,以Cq值為縱坐標,模板濃度的對數為橫坐標建立標準曲線。對擴增結果利用Bio-Rad軟件分析后建立標準曲線。
1.5 特異性試驗
用DNA/RNA提取試劑盒提取PCV2、PRV樣品的DNA,TGEV、PRRSV、CSFV及PDCoV樣品提取RNA并反轉錄成cDNA作為模板,采用上述優化好的方法進行qPCR,檢驗該方法的特異性。
1.6 敏感性試驗
將標準品進行10倍倍比稀釋作為模板在最優反應條件下進行qPCR擴增,同時利用普通PCR方法進行擴增,對兩種檢測方法得到的結果進行對比來驗證本方法的敏感性。
1.7 重復性試驗
選取經10倍倍比稀釋的標準品作為模板,應用建立的方法進行組內試驗,每個濃度重復3次;在不同的時間對上述選取的質粒標準品進行組間試驗,每個濃度重復3次,根據每個濃度的Cq值計算組內和組間的變異系數(CV)。
1.8 臨床樣品檢測
將本實驗室采集的54份仔豬腹瀉疑似樣品提取RNA,并反轉錄成cDNA,采用建立的qPCR檢測方法進行擴增,同時采用豬流行性腹瀉病毒通用型實時熒光RT-PCR檢測試劑盒進行檢驗,比較二者的檢測結果。
1.9 S全基因的擴增及序列分析
將通過qPCR檢測為PEDV陽性的樣品進行普通PCR擴增,PCR產物經瓊脂糖凝膠電泳檢測為陽性后,對其進行回收純化,隨后將產物與pMD19-T載體經連接轉化、菌液PCR鑒定為陽性的樣品送上海生工生物技術有限公司進行測序鑒定。
從NCBI GenBank上選取具有代表性的毒株35條,用MEGA7.0軟件構建遺傳進化樹,用DNAStar7.0軟件進行氨基酸序列分析。
2 結 果
2.1 PEDV標準品的構建及qPCR檢測方法的建立
將構建的重組質粒pMD19T-PEDV作為模板,用合成的PEDV-F/PEDV-R進行普通PCR擴增,得到目的條帶大小為124 bp,膠回收送生工生物工程(上海)股份有限公司測序,結果均與預期一致,表明正確構建了重組質粒pMD19T-PEDV標準品。通過Nanodrop 2000測定標準品的濃度,換算成拷貝數為1.09×1010拷貝·μL-1。
經過優化后最終確定qPCR反應體系為25 μL,含引物各1 μL,探針0.5 μL,2×Fast Probe Mixture 12.5 μL,RNase-Free ddH2O 7 μL及模板3 μL。反應程序:95 ℃ 30 s,95 ℃ 10 s;53 ℃ 25 s,40個循環,每個循環結束收集熒光信號。
采用優化后的qPCR方法對重組質粒pMD19T-PEDV標準品進行qPCR擴增,結果顯示,標準品稀釋度在1.09×109~1.09×101拷貝·μL-1時呈現良好的線性關系,回歸方程式為y=-3.8x+40.23,擴增效率R2為99.8%,結果成立,可以對樣品進行定量分析。
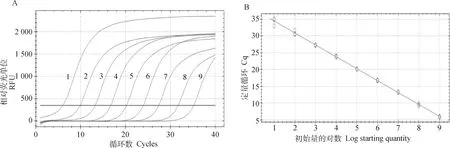
1~9.不同稀釋度的重組質粒pMD19T-PEDV(1.09×109~1.09×101拷貝·μL-1)
2.2 特異性試驗
利用qPCR方法對PEDV、PCV2、PCV3、TGEV、PRV、PRRSV、PDcoV及CSFV的核酸進行檢測,同時設置陰陽對照。結果顯示,僅PEDV為陽性,而其它病原均為陰性,表明本方法具有良好的特異性。
2.3 敏感性試驗
利用qPCR方法對10倍倍比稀釋的標準品進行檢測,同時用普通PCR方法擴增檢驗其敏感性。結果顯示,該方法對PEDV檢測出的最低拷貝數為1.09×101拷貝·μL-1,而普通PCR方法的最低拷貝數為1.09×103拷貝·μL-1,表明本研究建立的TaqMan qPCR檢測方法具有較高的敏感性。
2.4 重復性試驗
將PEDV的標準品pMD19T-PEDV(1.09×107、1.09×104、1.09×102拷貝·μL-1)作為模板,采用建立的qPCR方法進行組內及組間的重復性試驗,組內和組間的變異系數均小于1%,表明該方法具有良好的重復性。
2.5 臨床樣品檢測
應用本研究建立的qPCR對來自河北省不同地區采集的54份疑似PED樣品進行檢測,結果顯示,陽性率為27.8%(15/54),與豬流行性腹瀉病毒通用型實時熒光RT-PCR檢測試劑盒的檢測結果一致,符合率為100%,并隨機挑取3份陽性樣品,經測序鑒定后,證實為PEDV,表明此次建立的方法可用于PEDV的流行病學調查。
2.6 PEDV S全基因擴增
將檢測為PEDV的樣品應用普通PCR方法對其進行S全基因的分段擴增,PCR產物經瓊脂糖凝膠鑒定,結果顯示,出現與預期片段大小符合的條帶,隨后測序及拼接。將獲得的S基因上傳至NCBI GenBank中,登錄號為OL870433~OL870436、OL841533~OL841538。
2.7 PEDV S基因遺傳進化分析及序列分析
為了解本研究的9株PEDV的遺傳特性,利用MegAlign軟件,將從NCBI公布的典型序列中選取35株PEDV毒株基因組序列與本研究得到的S基因進行比對。結果顯示,本試驗獲取的9株毒株序列之間的核苷酸相似性為96.6%~99.1%,氨基酸的相似性為94.6%~98.7%;與參考株的核苷酸相似性為92.6%~99.3%,其中,與CHGD-01及BJ2011-1的親緣關系較近,核苷酸相似性為98.3%~99.3%,氨基酸相似性為95.6%~98.9%。與CV777等經典毒株的親緣關系較遠,核苷酸相似性為92.6%~94.4%,氨基酸相似性為91.3%~93.8%;與近幾年我國的流行毒株核苷酸的相似性為96.5%~99.3%。
應用Mega 7.0軟件,將本研究分離得到的9條S全基因序列及從NCBI上參考的35條S全基因進行分析建立系統進化樹,結果顯示,進化樹分為GⅠ和GⅡ大群,GⅠ和GⅡ分別分為GⅠa、GⅠb、GⅡa及GⅡb(圖2)。結果顯示,分離得到的9株PEDV毒株全部位于GⅡ群上。其中,CH/HB/BD01、CH/HB/BD02、CH/HB/BD03、CH/HB/CZ02、CH/HB/XT01、CH/HB/HD01、CH/HB/HD02與CHGDGZ和CHGD-01、GJL位于同一分支,屬于GⅡa亞群;CH/HB/ZJK01和CH/HB/ZJK02分別與BJ2011-1、AH2012處于同一分支,屬于GⅡb亞群。因此可以得出,本研究得到9條S基因的毒株為變異毒株,表明目前主要的流行毒株為變異毒株。
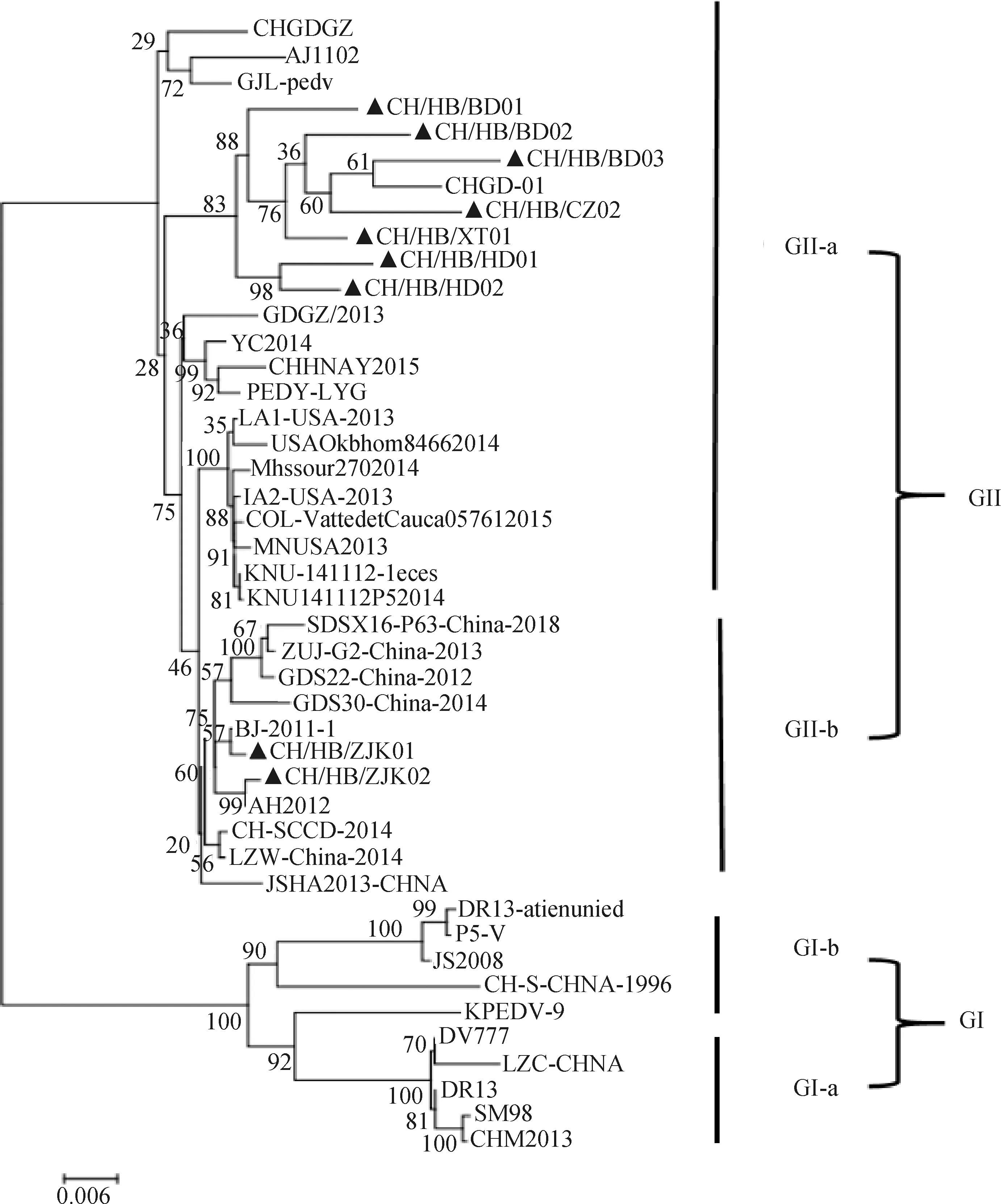
圖2 PEDV S基因核苷酸序列遺傳進化樹
利用MegAlign軟件,將得到的S基因與PEDV變異毒株BJ-2011-1進行序列比對,結果發現,9株S基因序列存在多處突變,處于GⅡb分支上的突變位點較多,為21~24處;分布于GⅡa分支上的毒株與CV777相似突變位點較多,共有11個。其中,CHHBBD02、CHHBBD03、CHHBCZ02、CHHBHD02、CHHBZJK01及CHHBZJK02存在1個氨基酸的插入。
3 討 論
PED是養豬業常見的疾病之一,給養豬業造成了巨大的經濟損失[16]。為了降低PED的發病率,人們通過接種疫苗的方法來防控PEDV,取得了一定的成效。然而,由于PEDV不斷的變異,從而導致原有疫苗的保護力逐漸降低甚至失效,使得防控的難度逐漸加重[17-18]。在臨床上,由于PEDV與PDCoV、TGEV等病毒引起的癥狀和病理變化相似性高,臨床不能通過臨床癥狀和病理變化作出準確的診斷。因此,建立一種快速、精準及敏感性高的診斷方法是極為重要的。目前,已有多種常規實驗室診斷方法應用于PEDV的臨床檢測。但是,ELISA相較于TaqMan qPCR的方法具有靈敏度較低、成本高等缺點[19];普通PCR具有檢測時間長、靈敏度相對較低的缺點[20];IFA、免疫組化及電鏡等檢測技術,對于儀器及人員的要求較高[21-22],且無法滿足大批量的臨床診斷。相較于以上幾種方法,qPCR不僅具有操作簡便、成本低的優點,而且檢測時間短,可適用于基層的臨床檢測。在PEDV的分子研究機制上,監測PEDV毒力基因的變化對PED的防控可提供重要的理論依據。
本研究建立了一種快速、靈敏、準確的TaqMan qPCR檢測方法。可實現在臨床中對PEDV 的全面篩查。S蛋白是PEDV的關鍵毒力蛋白,其氨基酸的序列決定了蛋白的可塑性,該蛋白含有多個B細胞表位和抗體結合域,對病毒與抗體和免疫細胞的結合發揮著重要作用,其基因結構的改變可以對PEDV的毒力等生物特性產生巨大的影響[23-24]。依據本方法對本實驗室從河北省在2021―2022年不同地區收集的腹瀉樣品進行篩查,將篩查出來的陽性樣品進行S全基因的克隆,并進行S基因的遺傳進化分析,從而了解當前流行毒株的基因結構,掌握其遺傳變異規律。結果顯示,克隆的9條S基因均位于GⅡ群的不同分支,與疫苗株CV777的親緣關系較遠。其中,CHHBBD01、CHHBBD02、CHHBBD03、CHHBHD01、CHHBHD02、CHHBCZ02和CHHBXT01與CHGD-01氨基酸序列的相似性最高為93.5%~97.6%,位于GⅡ-a分支;而CHHBZJK01和CHHBZJK02則與BJ-2011-1氨基酸的相似性最高為97.9%~98.9%,位于GⅡ-b分支。結果表明,目前,河北省PEDV的流行毒株與常規疫苗具有較大的差異。PEDV的S蛋白含有4個主要的中和表位區(499―639、748―755、764―771及1 368―1 374 aa),其中,499―639 aa為COE抗原區,該區的突變會對PEDV的毒力及抗原性產生很大的改變[25]。本研究通過對得到的9株PEDV S蛋白的氨基酸序列進行分析,結果顯示,9株序列的氨基酸相似性為94.6%~98.7%,S蛋白氨基酸與國內流行毒株相比,均發生多處突變,并且部分突變與疫苗株CV777相同。此外,將9株S蛋白的氨基酸與GenBank登錄的35條序列進行比對,結果發現,擴增的9株S蛋白均含有多處特異性突變,這些突變與PEDV的毒力的關系暫未研究。結果表明,在河北省部分地區毒株的抗原性等生物學功能可能已經產生變化。
4 結 論
建立了一種快速檢測豬流行性腹瀉病毒(PEDV)的通用型TaqMan qPCR檢測方法,并對2021―2022年河北省不同地區采集的54份疑似PED樣本進行檢測,對檢測出PEDV的樣品進行S基因的擴增和測序,從序列的相似性分析和遺傳進化研究兩個方面得出河北省PEDV流行毒株分布在GⅡ群中的兩個進化分支,且氨基酸序列發生多處特異性突變。

