miR-223、TLR2在新生兒感染性肺炎治療中的變化與應用*
蔣斐斐,孫麗芃,李亞楠
安徽省亳州市人民醫院兒科,安徽亳州 236800
新生兒感染性肺炎是指新生兒在宮內、分娩過程中或出生后吸入胎糞、羊水、胃內容物等,或是娩出后感染細菌、病毒等病原體,導致的肺部炎癥病理改變[1]。臨床上,根據新生兒感染性肺炎病因可分為吸入性肺炎與感染性肺炎兩種[1],且不同類型肺炎發病機制、臨床表現差異不明顯,導致臨床診療難度較大。臨床上以新生兒感染性肺炎更為常見[2-3],故本研究選擇新生兒感染性肺炎進行研究。病原學檢查是新生兒感染性肺炎常用的診斷“金標準”,能指導臨床治療,但是該診斷方法所需時間長[4-5]。微小RNA(miRNA)是一類高度保守的非編碼核苷酸,與機體免疫功能存在明顯的差異性。外周血miR-223在肺炎患兒中呈高表達,能作為肺炎早期診斷指標之一,用于評估患兒病情嚴重程度[6]。Toll樣受體2(TLR2)是Toll家族成員之一,在人體中具有廣泛的作用,可識別不同類型病原微生物抗原成分,但是該指標在新生兒感染性肺炎中的應用研究較少[7]。因此,本研究將新生兒感染性肺炎患兒納入研究,旨在探討miR-223、TLR2在新生兒感染性肺炎中的表達情況及對臨床診斷的價值,現報道如下。
1 資料與方法
1.1一般資料 將2018年5月至2021年3月本院收治的67例新生兒感染性肺炎患兒作為觀察組,男34例、女33例,日齡0~32 d,平均(13.58±4.51)d,孕周38~42周、平均(40.13±1.75)周,母親分娩次數1~3次、平均(1.65±0.51)次,分娩方式:順產39例、剖宮產28例。另外,將本院同期健康新生兒51例作為對照組,男32例、女19例,日齡4~33 d、平均(13.62±4.56)d,孕周37~42周、平均(40.06±1.71)周,分娩方式:順產40例、剖宮產11例。本研究獲得本院倫理委員會批準。受試者家屬均簽署知情同意書。兩組一般資料比較差異無統計學意義(P>0.05)。納入標準:(1)觀察組患兒符合新生兒感染性肺炎診斷標準[8],經血常規、臨床表現、影像學檢查確診;(2)均能配合完成miR-223、TLR2檢查;(3)單胎。排除標準:(1)有先天畸形、一般情況較差或器質性疾病;(2)伴有其他感染性疾病及嚴重肝、腎功能異常;(3)研究期間死亡或轉上一級醫院;(4)有藥物過敏史、禁忌證。
1.2儀器與試劑 FSCS Vantage流式細胞儀購自美國BD公司;PCR擴增儀購自Biometra公司;MX3000PTM熒光定量PCR儀購自Stratagene公司;白細胞介素-6(IL-6)酶聯免疫吸附法(ELISA)檢測試劑盒購自南京博湃生物技術有限公司;反轉錄試劑盒購自美國Sigma公司。酶免檢測儀購自美國Beckman公司;VIDAs全自動熒光免疫分析儀購自法國梅里埃公司;RNA提取Trizol試劑購自美國Sigma公司;TLR2相關抗體購自美國Abcam公司;降鈣素原(PCT)檢測試劑盒均購自法國梅里埃公司。
1.3方法
1.3.1標本采集及保存 根據患兒病原學檢查結果和病情,對其進行相應的治療,分別于治療前、后抽取靜脈血3 mL。對照組采集臍帶血3 mL,以2 000 r/min離心10 min,分離得到血清,于-80 ℃冰箱內保存,待測。
1.3.2miR-223檢測 采用實時熒光定量PCR法測定miR-223水平,利用Trizol法提取血液標本的總RNA,利用酶標儀測定其濃度。將總RNA按反轉錄試劑盒說明書逆轉為cDNA。反轉錄條件:30 ℃ 20 min,35 ℃ 30 min,75 ℃ 10 min。實時熒光定量PCR反應體系:cDNA模板8 μL、SYBRP Green 10 μL、PCR Primer mix 2 μL;反應條件:95 ℃預變性10 min,95 ℃變性15 s、60 ℃退火30 s、72 ℃延伸30 s,連續完成40個循環。以β-actin作為內參,采用2-ΔΔCt法計算血液標本中miR-223的相對表達水平。引物設計見表1。

表1 引物設計
1.3.3治療方案 觀察組均給予常規對癥支持治療,具體方法如下:給予抗感染、平喘及退熱等治療,7 d治療后評估效果[9-10]。觀察組治療后記錄為觀察組-T。
1.3.4指標的測定 采用流式細胞儀測定TLR2的表達水平(檢測抗體購自美國Abcam公司),取血液標本100 μL于流式細胞管,加入FITC-抗TLR2抗體10 μL,快速震蕩混勻,室溫下避光孵育15 min。將流式細胞管以2 000 r/min離心5 min后棄上清,用流式細胞儀進行檢測。采用ELISA測定IL-6水平;采用全自動熒光免疫分析儀測定降鈣素原(PCT)水平[11]。
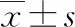
2 結 果
2.1血清miR-223、TLR2、IL-6及PCT水平比較 治療前觀察組的miR-223、TLR2、IL-6及PCT水平均高于對照組(P<0.05);觀察組治療7 d后miR-223、TLR2、IL-6及PCT水平均低于治療前(P<0.05),與對照組比較差異無統計學意義(P>0.05)。見表2。
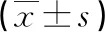
表2 血清miR-223、TLR2、IL-6、PCT水平的比較
2.2檢測指標間的相關性分析 Pearson相關分析顯示:血清miR-223與TLR2、IL-6、PCT水平均呈正相關(r=0.492、0.489、0.503,P<0.05),TLR2與IL-6、PCT水平亦呈正相關(r=0.465、0.542,P<0.05)。
2.3miR-223、TLR2對新生兒感染性肺炎的診斷價值 ROC曲線分析顯示:用于新生兒感染性肺炎的診斷,miR-223的最佳截斷值為9.12,曲線下面積(AUC)為0.715,TLR2的最佳截斷值為2.11,AUC為0.753。miR-223、TLR2聯合診斷新生兒感染性肺炎的AUC為0.894,明顯高于miR-223、TLR2單項診斷的AUC(P<0.05)。見表3、圖1。
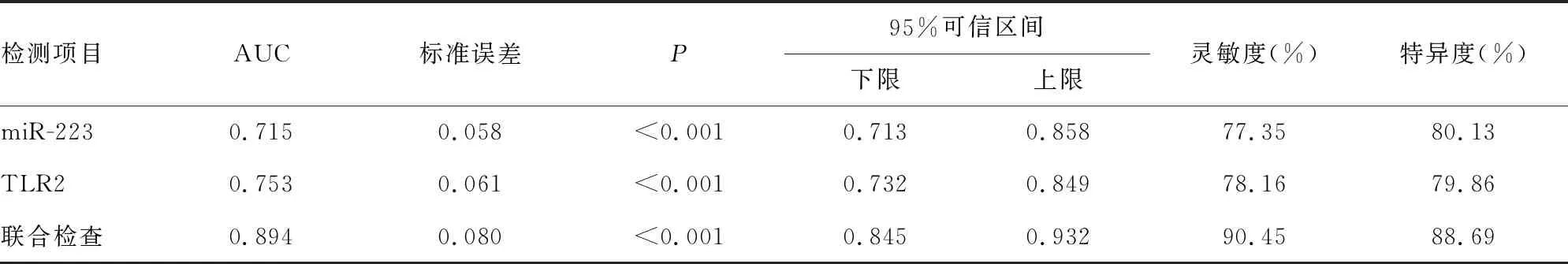
表3 miR-223、TLR2單項及聯合檢測對新生兒感染性肺炎的診斷價值分析
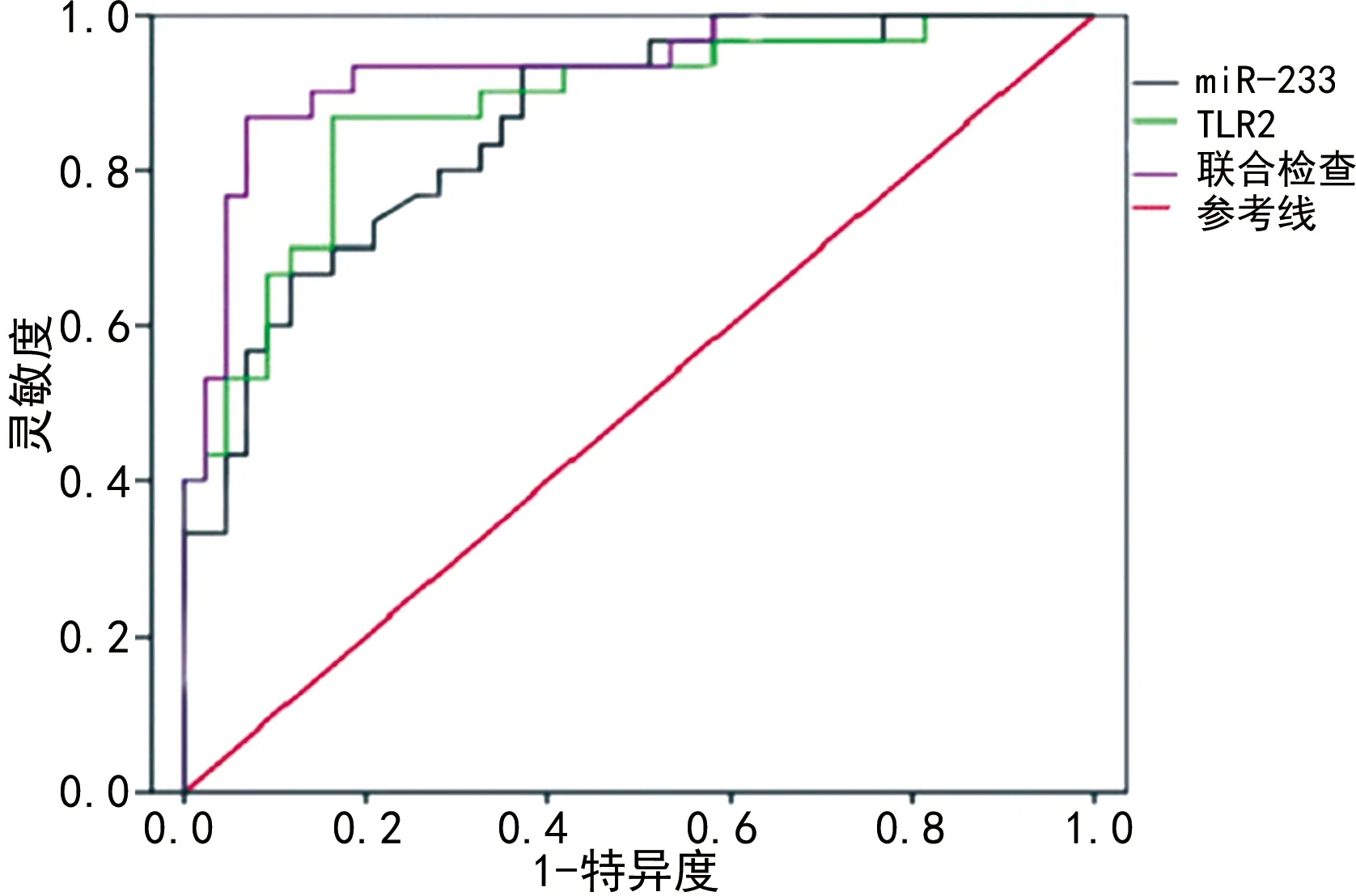
圖1 miR-223、TLR2單項及聯合檢測用于新生兒感染性肺炎的診斷的ROC曲線
3 討 論
新生兒感染性肺炎是兒科常見病、多發病,由于多數患兒發病早期臨床癥狀缺乏典型性,導致患兒診療難度較大[12]。同時,新生兒特殊的生理與免疫狀態,導致新生兒感染性肺炎發生率較高,隨著病程延長,將會增加窒息、呼吸衰竭的發生率。目前新生兒感染性肺炎診療難度大,本研究旨在探討新生兒感染性肺炎新的診斷標志物。
miR-223屬于miRNA的一種[13]。miR-223在人體中具有廣泛的生物學作用,如參與免疫細胞譜系的發生、分化調控,維持免疫穩態等[14]。miR-223在膿毒癥患兒和小兒肺炎支原體感染患者中均呈高表達[15-16],而且與T淋巴細胞亞群、炎癥因子密切相關[17]。由此可見,miR-223異常表達可能與新生兒感染性肺炎存在緊密聯系[18]。本研究顯示:觀察組miR-223、IL-6及PCT水平均高于對照組(P<0.05),miR-223在新生兒感染性肺炎患者中高表達。
TLR2是新發現的先天性免疫的病原模式識別受體,可介導跨膜信號,激活機體免疫反應。Toll受體與相應的配體結合后,能激活機體炎性反應,并產生瀑布聯級反應,可清除機體內的病原體[19]。重癥肺炎患者外周血TLR2、TLR4表達水平升高,與炎癥反應緊密相關[20]。本研究結果顯示:觀察組TLR2、IL-6及PCT水平高于對照組(P<0.05),說明TLR2在新生兒感染性肺炎患者中高表達。
目前臨床上對于新生兒感染性肺炎以對癥支持治療為主。本研究對新生兒感染性肺炎患兒均給予對癥支持治療。觀察組治療7 d后miR-223、TLR2、IL-6及PCT水平均低于治療前(P<0.05),觀察組治療后miR-223、TLR2及IL-6、PCT述評均明顯降低(P<0.05),而且觀察組治療后miR-223、TLR2、IL-6及PCT水平與對照組比較差異無統計學意義(P>0.05)。miR-223、TLR2在新生兒感染性肺炎治療后水平降低,能較好反映患兒肺炎治療的效果。本研究進一步分析了miR-223、TLR2在新生兒感染性肺炎診斷中的價值。miR-223、TLR2聯合檢測用于診斷的靈敏度與特異度均高于miR-223、TLR2單項檢測。血清miR-223與TLR2、IL-6及PCT水平呈正相關,并且TLR2與IL-6及PCT水平也呈正相關。提示血清miR-223和TLR2與IL-6及PCT一樣具有早期診斷新生兒感染性肺炎的能力。因此,臨床上對于疑似新生兒感染性肺炎者,應加強miR-223、TLR2水平測定,從而輔助診斷。
綜上所述,miR-223、TLR2在新生兒感染性肺炎中呈高表達,而且二者聯合測定具有較高的靈敏度與特異度,能為新生兒感染性肺炎的診療提供參考依據。但是,本研究中亦存在諸多局限性與不足,研究中納入病例數較少,需進一步加大樣本量進行研究。

