甲酸微生物轉化研究進展
趙同心,趙磊,2,張延平,李寅
(1 中國科學院微生物生理與代謝工程重點實驗室,微生物資源前期開發國家重點實驗室,中國科學院微生物研究所,北京 100101;2 中國科學院大學,北京 100049)
二氧化碳(CO2)中的碳是正四價,為最高氧化價態,分子結構十分穩定。CO2的生物固定主要是利用合適的能量和還原力將CO2的碳氧雙鍵打開,使之加成到其他底物上實現四價碳的還原和碳鏈延長,轉化為有機化合物。自然界中的生物固碳過程主要由包含固碳酶的多酶催化體系協調完成,已經發現了6條天然的固碳途徑,其中包含9種固碳酶[1]。天然固碳途徑固碳效率普遍較低,用于生產目標產品存在諸多問題。隨著合成生物學的發展,效率更高的人工生物固碳途徑也被開發出來,如CETCH 循環[2]、人工合成淀粉的ASAP 途徑[3]、最簡酶促碳固定循環POAP循環[4]等。
CO2接受電子,依次能夠還原為甲酸、甲醛、甲醇等一碳化合物。這些一碳化合物同化路徑的研發,也為CO2的生物利用提供更多的可能,如利用體外多酶途徑將甲醇轉化為淀粉[3]。隨著電催化技術的發展,CO2生產甲酸技術日益成熟。甲酸的碳原子活化度更高、在水中溶解度更大,因此近年來甲酸生物轉化成為了生物固碳研究的熱點方向,在甲酸生物轉化途徑、甲酸途徑能量驅動方面取得了較多研究進展,有研究者已經初步實現了大腸桿菌利用甲酸自養生長。本文從以上幾個方面總結該研究方向的最新研究進展,分析現有甲酸生物轉化的現狀、存在問題,并討論了甲酸生物轉化未來努力的方向。
1 甲酸生物轉化途徑
本文作者前期對6條天然固碳途徑的熱力學性質、固碳酶特性等進行過系統分析和比較[5]。在6條固碳途徑中,每摩爾碳原子被還原降低一個化合價所需的NAD(P)H 均為0.5mol,而所需ATP 的量為0.125~0.7mol,其中最節能的是Wood?Ljungdahl(WL)途徑。該途徑除可以轉化CO2和CO 外,還可以轉化甲酸。其中,CO2和CO 生物轉化的關鍵酶為甲酸脫氫酶和一氧化碳脫氫酶/乙酰輔酶A(CODH/ACS)合酶,后者蛋白結構復雜,對氧非常敏感。因此,該途徑僅在厭氧菌丙酮丁酸梭菌(Clostridium acetobutylicum)中實現了異源重構,通過13C 標記分析可以檢測到微量13C?乙酰輔酶A的生成[6]。WL 途徑能將甲酸轉化為一碳供體——亞甲基四氫葉酸,隨后一碳供體能夠通過宿主菌本身的代謝網絡或者重構的代謝途徑進入中心代謝,從而為生物體利用甲酸提供更多可能。基于WL途徑中的甲酸轉化模塊具有較高普適性的特點,研究人員先后已嘗試在大腸桿菌、酵母等常用底盤細胞中將其進行途徑重構。
為了便于理解,本文將甲酸生物途徑分為上游甲酸同化模塊(甲酸→亞甲基四氫葉酸)和下游亞甲基四氫葉酸代謝途徑(亞甲基四氫葉酸進一步生物代謝)兩部分進行介紹。
1.1 上游甲酸同化模塊
如圖1所示,甲酸生成亞甲基四氫葉酸的過程是目前甲酸生物利用體系共有的模塊。該模塊包含的三步反應依次被甲酸四氫葉酸連接酶、甲酰四氫葉酸水合酶和亞甲基四氫葉酸脫氫酶催化。甲基扭桿 菌(Methylobacterium extorquensAM1) 和 梭 菌(Clostridium ljungdahlii)中,這三個酶分別有三個基因編碼[7?8];而在其他菌株中后兩個酶大多由同一基因編碼,如大腸桿菌中存在由folD基因編碼的雙功能蛋白酶,該蛋白催化的是可逆反應,生理狀態下,催化亞甲基四氫葉酸生成甲酰四氫葉酸方向。在大腸桿菌中,為了實現甲酸生成亞甲基四氫葉酸,研究者嘗試引入了fhs/ftl、fchA、folD/mtdA三基因編碼的途徑[9?11]和fhs/ftl、folD兩基因編碼的途徑[12],結果表明三基因編碼的途徑能較快提供亞甲基四氫葉酸。
1.2 下游亞甲基四氫葉酸代謝途徑
目前,利用內源或者重構的亞甲基四氫葉酸下游代謝途徑主要有三條(圖1中用不同顏色標示):一條是線性途徑(圖1 中藍色途徑)[9?11],另外兩條是循環途徑(圖1中紅色和黃色途徑)[12?13]。
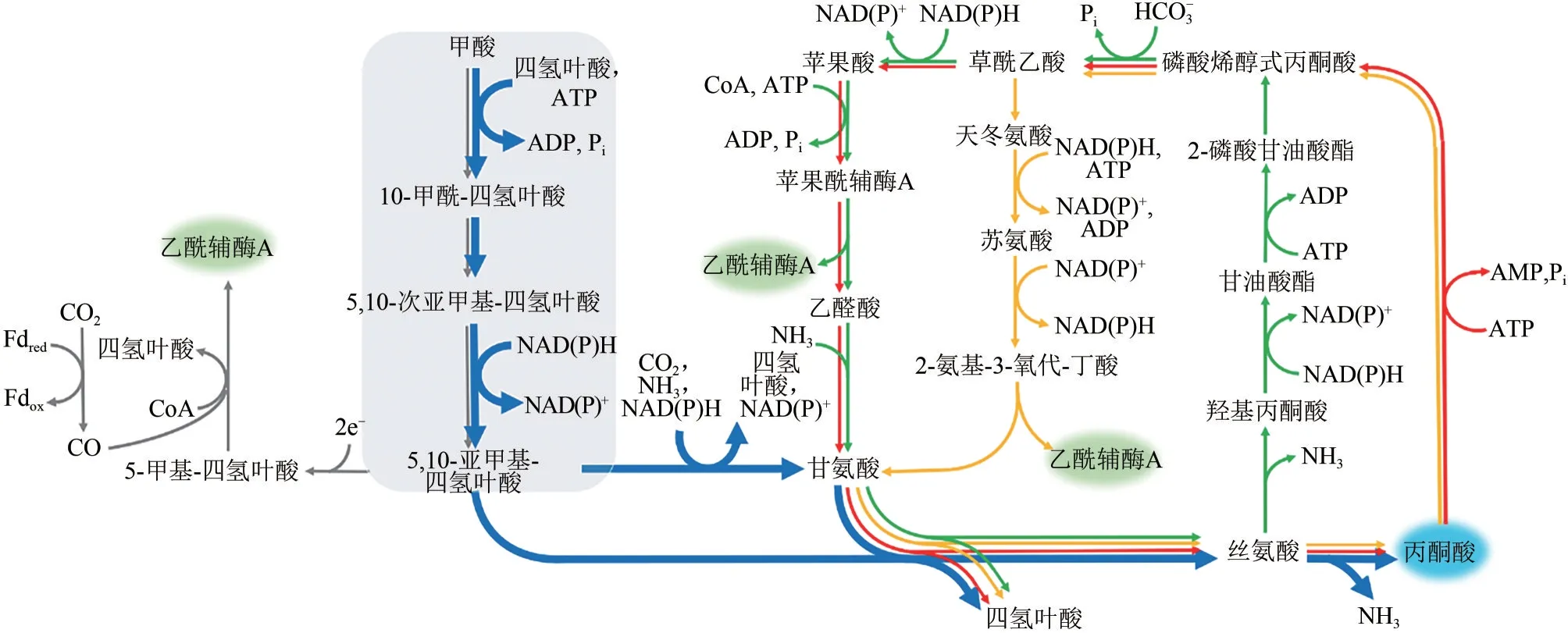
圖1 甲酸同化途徑
上游甲酸同化模塊內中間產物不穩定或缺乏標準品,很難通過測定酶活性的方式篩選相關酶,因此研究人員多采用生長缺陷菌株依賴的生長評價的方式進行表征。研究人員首先構建甘氨酸或絲氨酸生長缺陷菌株,然后導入“甲酸→亞甲基四氫葉酸→甘氨酸/絲氨酸”途徑相關基因,通過生長回補的方式來評價甲酸同化進而生成甘氨酸、絲氨酸的能力[9?10]。
下游亞甲基四氫葉酸代謝途徑中,“甲酸→亞甲基四氫葉酸→甘氨酸/絲氨酸→丙酮酸”途徑已逐步在大腸桿菌構建成功[9?11]。最初,研究人員在大腸桿菌中引入上游甲酸同化模塊后,利用菌株自身的甘氨酸切割系統,并不能使甘氨酸生長缺陷的菌株恢復生長;通過過表達大腸桿菌自身的甘氨酸切割系統的基因gcvTHP,在10%CO2情況下,甘氨酸缺陷型菌株的生長得以回補;繼而以葡萄糖和13C 標記CO2及甲酸鈉為碳源,證實13C 標記CO2及甲酸鈉能通過甲酸同化途徑合成甘氨酸以滿足生長需求[10?11]。利用大腸桿菌體內glyA編碼的絲氨酸羥甲基轉移酶和絲氨酸脫氨酶,可以依次催化甘氨酸和亞甲基四氫葉酸生成絲氨酸,并進一步生成丙酮酸。通過上述改造,在葡萄糖、甲酸和CO2共培養條件下,甲酸線性途徑可以貢獻丙酮酸合成代謝流的10%左右[9?10]。
在循環途徑中,甲基扭脫桿菌中天然存在“亞甲基四氫葉酸→絲氨酸”循環,但該菌株生長較慢[14]。為了克服其菌株缺點,Liao 課題組[13]結合大腸桿菌的內源代謝途徑,構建了改良版絲氨酸循環途徑:用“絲氨酸→丙酮酸”途徑替代原來的“絲氨酸→2?P?glycerate”途徑,解決羥基丙酮酸還原酶底物非特異性問題,乙醛酸和丙氨酸轉氨反應替代絲氨酸供給氨基反應,補給充足氨基供體,保證乙醛酸生成甘氨酸反應順利進行。研究人員通過“甘氨酸→草酰乙酸”“絲氨酸→丙酮酸”兩個模塊疊加的方式,在大腸桿菌中證實了改良的絲氨酸循環能夠工作。
Bar?Even 課題組[12]則探索了“亞甲基四氫葉酸→絲氨酸/蘇氨酸”循環途徑,通過生長缺陷型菌株和13C 標記的方式,在大腸桿菌內證實該途徑能夠工作。上述兩種循環途徑轉化甲酸的代謝流情況,目前尚未見報道。
2 甲酸再生NAD(P)H 和甲酸自養菌株構建
由于CO2及甲酸中的碳處于較氧化狀態,其固定轉化為生物質或丙酮酸等化合物均需要凈輸入還原力NAD(P)H及能量ATP。目前用于生物固碳的還原力及能量供給研究主要集中在光能、電能或化學能利用。天然自養微生物利用光能驅動的較多,為了提高天然生物光系統的光捕獲能力,研究人員縮短藍藻吸光天線的尺寸,可將太陽光吸收效率提高57%[15]。光能轉化為生物能是一個有前景的能量供給方式,吸收光能的光敏材料也引起人們的關注。研究者[16]創建熱醋穆爾氏菌?硫化鎘(M. thermoacetica?CdS)雜合體系,利用CdS 將光子轉化為電子,提供給含有WL途徑的熱醋穆爾氏菌,利用該電子驅動固碳途徑生成乙酸。江南大學研究團隊利用自組裝CdS 納米捕光系統,實現光驅動大腸桿菌封存CO2生產有機酸[17]。電子除來自光能之外,也可以直接來自電極,該想法已得到初步證實。乙酸梭菌能夠利用從電極上得到的電子,將CO2還原成乙酸和甲烷[18]。目前利用光能和電能提供能量的方式主要集中在天然固碳的宿主菌,在模式生物中提供電子,用于生物固碳還需要很多努力。
在微生物體系中,甲酸是一種常見的電子供體,可以利用甲酸脫氫酶將其分解為CO2和水,同時再生NADH 或者NADPH,從而為生物體提供還原力。目前,已發現來自假絲酵母的甲酸脫氫酶具有較強的NADH 再生活性,因此該甲酸/甲酸脫氫酶的NADH再生系統被廣泛應用于科學研究[19]和工業生產[20]。研究者將來自假絲酵母的甲酸脫氫酶進行突變,還得到了可再生NADPH 的突變體[21]。另外,自然界中也存在再生NADPH的甲酸脫氫酶,例如Burkholderia stabilis15516來源的甲酸脫氫酶[22]。
目前,已有很多研究將甲酸/甲酸脫氫酶NAD(P)H再生系統用于生物固碳。一種情況是甲酸只作為電子供體,比如真養產堿桿菌(Ralstonia eutrophaH16),其能夠利用甲酸脫氫酶這一功能將甲酸轉化為還原力,驅動內生的固碳途徑——卡爾文循環[23]。這一思路也被用于大腸桿菌或酵母菌株的改造,在導入固碳途徑卡爾文循環(CBB循環)的大腸桿菌[24]和酵母菌[25],利用甲酸/甲酸脫氫酶提供還原力NADH,在有氧的情況下,NADH經氧化磷酸化生成ATP,從而實現甲酸提供固碳途徑所需要的還原力和ATP。
另一種情況是甲酸既作為電子供體又作為代謝的碳源。隨著甲酸生物轉化途徑深入研究,研究人員將甲酸再生NAD(P)H 模塊和甲酸生物轉化途徑相結合,嘗試構建甲酸自養型的工程菌株。近期,Liao 課題組[9]將甲酸脫氫酶引入到含有甲酸線性轉化途徑的大腸桿菌中,當葡萄糖耗盡后,通過補加甲酸實現維持菌株的OD值的穩定。隨后,該課題組通過加強固碳模塊并強化NADH氧化磷酸化生成ATP的效率,以甲酸和CO2為碳源,在發酵罐中培養工程菌株450h,最終獲得OD值可由1.02提高到7.38 的菌株[26]。類似地,Bar?Even 課題組[27]將甲酸線性轉化途徑和甲酸脫氫酶引入大腸桿菌,得到了生長代時為70h的工程菌株,并通過進化工程提高了菌株以甲酸和CO2為碳源進行生長的性能,將代時縮短到7.7h。
3 問題與討論
甲酸作為生物可利用的碳源和能源,是一種極具潛力的一碳化合物資源。目前甲酸生物轉化途徑方面,主要以甲酸生成亞甲基四氫葉酸的共有途徑為主要切入口,通過線性或循環途徑進行生物轉化合成Cn(n≥2)化合物。目前雖然用生長缺陷型菌株和13C 標記的方式驗證甲酸生物轉化途徑已打通(表1),但其代謝通量還很低,處于“概念驗證”階段,其技術指標遠未達到規模化生物制造的需求。
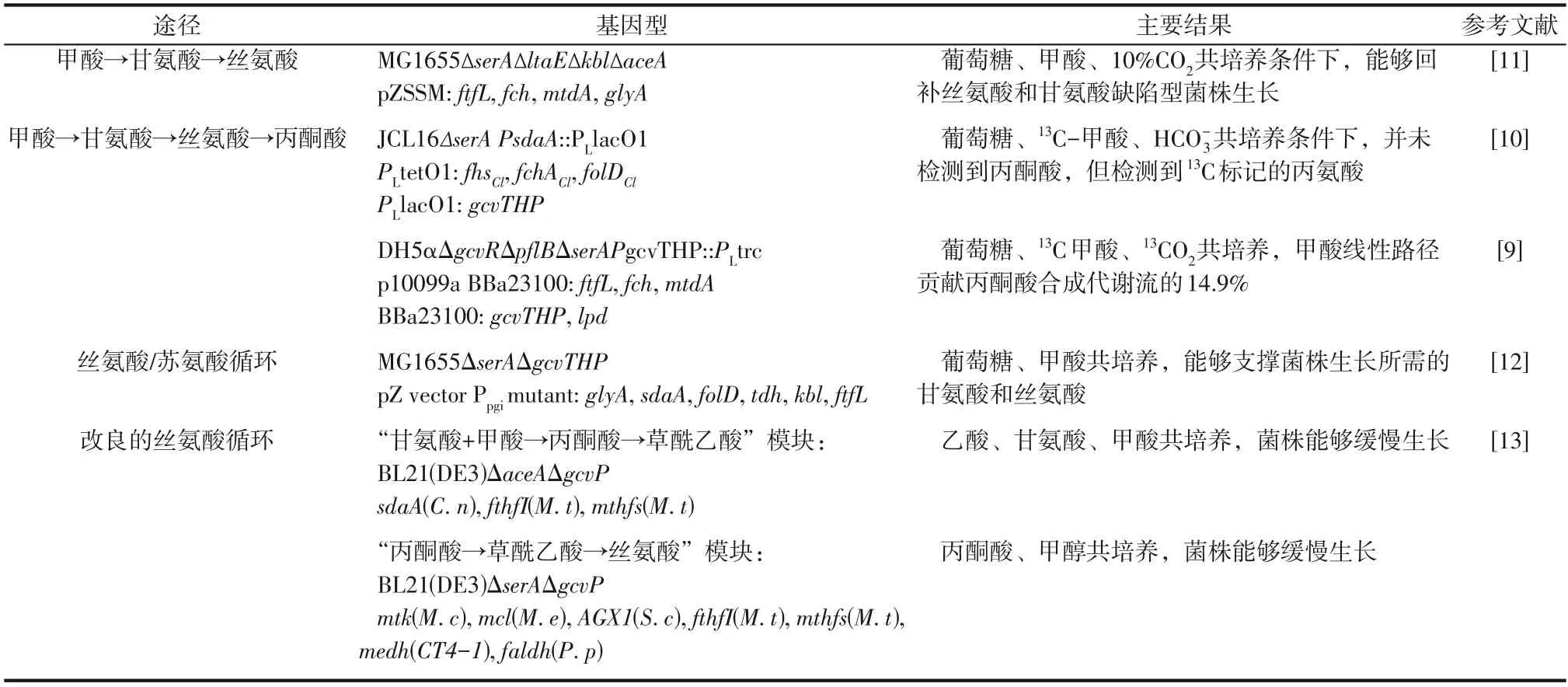
表1 關于甲酸生物轉化的大腸桿菌分子改造研究進展
為了提高甲酸生物轉化合成化學品效率,必須加強在該領域的研究部署。一方面需對現有甲酸生物轉化途徑進行系統研究,找出并突破限速步驟。目前的研究主要依賴營養缺陷菌株偶聯生長或者13C 標記的形式來進行路徑表征,很少能夠測定具體酶活,這就不能確定一個代謝模塊內部各個酶催化反應的活性,不能明確具體的限速步驟和分子機制,限制了代謝路徑通量的提高。針對這種現狀,尋找新方法/技術研究單個關鍵酶或者某個模塊的能力可能成為努力的方向。另一方面,天然甲酸生物轉化途徑在大多數宿主細胞中非中心代謝途徑,所涉及的酶活性有限,需通過大數據挖掘和計算設計分析,構建更加高效的新途徑。
除代謝途徑本身,本文作者認為充足的能量和還原力供給對驅動甲酸生物轉化至關重要。目前的研究發現,當供給充足甲酸和氧氣條件下,具有甲酸轉化模塊和甲酸供給還原力模塊的大腸桿菌和酵母工程菌也很難實現菌株生長,說明現有的甲酸轉化模塊和能量模塊匹配性還不夠,仍需要更多理性的探索。如Liao課題組改造氧化呼吸鏈,提高菌株生長,但具體NADH經呼吸鏈供給ATP能力有待深入研究。已知甲酸能夠提供能量,那么在甲酸、CO2自養供給體系中,ATP 生成能力、NADH 及NADPH 之間的供給能力、還原力供給與路徑需求之間是否匹配等諸多科學問題亟需解決。
4 結語
二氧化碳的高效減排、捕集和利用,已經成為科研界和產業界共同關注的重大課題。目前已發現6條天然的生物固碳途徑,隨著二氧化碳化學轉化為甲酸技術的日漸成熟,以甲酸為底物的微生物轉化成為生物固碳領域的熱點研究方向,包括甲酸生物轉化途徑改造和重構、與之匹配的還原力供給方式以及甲酸自養型菌株構建等方面。近年來微生物利用甲酸的研究較多,但仍存在諸多挑戰。針對目前微生物利用甲酸能力有限的現狀,找出甲酸固碳路徑、能量供給等方面的限速步驟成為新的突破口。

