貝萊斯芽孢桿菌1-3產表面活性素的純化、鑒定及表征
張 軍,張 良,湯 偉,3,孫曉雯,唐 濤,3,喬曉妮,梁 萌,何增國
(1.中國海洋大學醫藥學院,山東 青島 266000;2.青島百奧安泰生物科技有限公司,山東 青島 266000;3.青島海洋生物醫藥研究院股份有限公司,山東 青島 266000;4.山東省飼料獸藥質量檢驗中心,山東 濟南 250000)
傳統抗菌藥物在醫療衛生、食品加工和畜牧養殖業中長期不規范應用導致了耐藥性病原菌的產生和蔓延,對人類健康、食品安全和畜牧生產帶來了不利影響。因此,發掘綠色、安全的天然抗菌活性產物一直是醫療、食品和養殖業研究熱點。世界衛生組織(World Health Organization,WHO)也將新型抗菌物質的開發視為解決耐藥性病原菌的希望[1]。自然界中存在種類和數量眾多的微生物,在激烈的生存競爭過程中,進化出了諸多抑制其他微生物生長的手段,對這些具有抑菌作用代謝產物的發掘和研究,可以為對治耐藥性病原菌提供新的資源[2]。
芽孢桿菌是自然界中廣泛存在的一類微生物,由于所處環境多樣且復雜,常蘊含豐富的具有抑菌活性的代謝產物,如脂肽、細菌素等,具有潛在的應用價值[3]。有報道顯示,芽孢桿菌產生具有拮抗作用的代謝產物占總基因組的比例高達5%~8%[4]。貝萊斯芽孢桿菌(Bacillus velezensis)是近年來廣受關注的一種芽孢桿菌。2005 年B.velezensis首次分離于西班牙南部馬拉加貝萊斯河流域,因此命名為B.velezensis[5]。之后研究發現,其與解淀粉芽孢桿菌(B.amyloliquefaciens)在理化性質上具有一定的相似性,在分類學上曾一度將其歸于B.amyloliquefaciens,之后其命名幾經反復,最終在2016年通過全基因組比較,確立其為一個獨立的種[6-8]。B.velezensis來源廣泛,在土壤、動植物體內、池塘、海洋中均有發現[9]。B.velezensis蘊含了多種具有抑菌作用的代謝產物基因,包括脂肽類、聚酮類、環肽類和抗生素類[10]。因此,B.velezensis作為新型抑菌物質的來源,具有巨大的應用潛力。目前B.velezensis較多作為生防菌應用于種植業[4,7],而在醫療衛生、食品加工、畜牧生產和環境修復中的應用較少,可能與大多數B.velezensis來源于土壤環境相關[11]。因此,為擴大B.velezensis的應用范圍,一方面需要豐富其來源,從不同環境中篩選具有生物活性的菌株;另一方面需要深入研究其功能性代謝產物的種類和作用機制。
本研究從口腔樣品中分離得到1 株具有抑菌活性的B.velezensis,通過對其發酵液中抑菌活性物質的分離純化,鑒定其結構,并通過抑菌譜、抑菌活性、溶血性等對活性產物的特性進行研究,進而為其在醫療衛生、食品加工、畜牧生產和環境修復領域的應用提供理論基礎。
1 材料與方法
1.1 材料與試劑
1.1.1 樣品與菌株
分離樣品采集自中國人民解放軍戰略支援部隊醫院口腔科的離體牙樣品,置于無菌生理鹽水中。
綠膿桿菌(Pseudomonas aeruginosa)、金黃色葡萄球菌(Staphylococcus aureus)、霍亂弧菌(Vibrio cholerae)、溶藻弧菌(Vibrio alginolyticus)、嗜水氣單胞菌(Aeromonas hydrophila)、白色念珠菌(Candida albicans)、無乳鏈球菌(Streptococcus agalactiae)、蠟樣芽孢桿菌(Bacillus cereus)、大腸桿菌(Escherichia coli)均由本研究室分離和保存;副溶血性弧菌(Vibrio parahaemolyticus)ATCC17802、單核細胞性李斯特菌(Listeria monocytogenes)ATCC 19115、糞腸球菌(Enterococcus faecalis)CICC21605分別購自廣東微生物菌種保藏中心、寧波明舟生物科技有限公司和中國工業微生物菌種保藏管理中心。
1.1.2 培養基與試劑
胰酪胨大豆酵母浸膏肉湯(tryptic soy-yeast extract broth,TSB-YE)培養基:TSB培養基30 g,酵母提取物6 g,加水至1 L,121 ℃滅菌15 min;酵母浸出粉胨葡萄糖(yeast extract peptone dextrose,YPD)培養基:酵母粉10 g,蛋白胨20 g,葡萄糖20 g,加水至1 L,115 ℃滅菌20 min;LB(Luria-Bertani)培養基、TSB培養基、MH(Mueller-Hinton)培養基和MSR(de Man,Rogosa and Sharpe)培養基購自青島海博科技有限公司。
葡聚糖凝膠G-50 西安藍曉科技新材料股份有限公司;其他試劑均為國產分析純。
1.2 儀器與設備
Epoch酶標儀 美國BioTek公司;CR21N冷凍離心機 日本日立公司;ALPHA 1-2Ldplus真空冷凍干燥機 德國Marin Christ公司;HA99-1蛋白純化系統 上海滬西分析儀器廠有限公司。
1.3 方法
1.3.1 菌種篩選
將采集的離體牙樣品充分振蕩混勻,在TSB-YE培養基中37 ℃富集12 h。之后,進行10 倍梯度稀釋,選取合適的稀釋度,涂布TSB-YE固體平板,37 ℃培養至長出單菌落。以L.monocytogenesATCC 19115為指示菌(下同),采用Over-lay法進行菌落篩選[12],選擇抑菌圈最大的菌株(編號為1-3),在LB培養基上劃線純培養3 次,保藏于-80 ℃。
1.3.2 菌株分類鑒定
在LB固體平板上對保存的菌株1-3劃線,37 ℃培養12 h,觀察其菌落形態特征。采用革蘭氏染色法,在顯微鏡下觀察其菌體形態特征。對培養的菌株1-3進行需氧性實驗、氧化酶實驗、觸酶實驗以及糖發酵實驗,測定其生理生化性質。
挑取LB平板上的菌株1-3單菌落,采用通用引物27F(5’-AGAGTTTGATCCTGGCTCAG-3’)和1492R(5’-GGTTACCTTGTTACGACTT-3’)進行菌落聚合酶鏈式反應(polymerase chain reaction,PCR)擴增菌株1-3的16S rRNA基因序列。之后,將PCR產物送生工生物工程(上海)股份有限公司測序。測得的序列在NCBI網站進行比對,在LPSN(List of Prokaryotic names with Standing in Nomenclature)網站(https://lpsn.dsmz.de/)選擇相應模式菌株的16S rRNA基因序列,使用MEGA7.0軟件,采用鄰接法進行系統發育樹構建,判定菌株1-3的種屬類型。將菌株1-3在LB培養基中培養至對數中期,菌液離心后,棄上清液,菌體用生理鹽水漂洗2 次,將菌體送生工生物工程(上海)股份有限公司進行轉錄組測序。在測得序列中,隨即抽取9636 條序列在NCBI數據庫中進行BLAST比對,進一步確定其種屬信息。
1.3.3 發酵培養及抑菌活性物質的分離純化
取保存的菌株1-3甘油管50 μL,接種到5 mL的TSBYE培養基中,37 ℃、180 r/min搖培過夜。1%的接種量轉接到100 mL的TSB-YE培養基中,37 ℃、180 r/min搖培24 h,每4 h取樣1 mL,12000 r/min離心10 min,取上清液。在含有指示菌的平板上,采用瓊脂擴散法檢測發酵液中的抑菌活性,并測定不同取樣時間的pH值。
采用硫酸銨沉淀法分離目標產物。培養24 h的菌株1-3發酵液離心取上清液,加入飽和度30%的硫酸銨在4 ℃條件下沉淀過夜。10000 r/min、4 ℃離心30 min,沉淀用pH 7.0的磷酸鹽緩沖液復溶。上清液繼續補加硫酸銨至飽和度60%,10000 r/min、4 ℃離心30 min,沉淀用pH 7.0的磷酸鹽緩沖液復溶。同樣的操作得到90%硫酸銨的沉淀。在含有指示菌的平板上,采用牛津杯法檢測各組抑菌活性。
將硫酸銨沉淀活性最強的組分,用葡聚糖凝膠G-50進一步純化。用去離子水洗脫,流速0.5 mL/min,檢測波長280 nm。收集不同洗脫時間的組分進行真空凍干,復溶于磷酸鹽緩沖液(pH 7.0)中,采用牛津杯法檢測不同保留時間組分的抑菌活性,并將該組分作為脂肽粗品進行表征。
1.3.4 抑菌活性物質的鑒定
采用排油方法鑒定產物的表面活性劑成分。在潔凈的培養皿中加入無菌水,在水中加入200 μL食用油,使之在水面形成油膜,然后在油膜中心加入10 μL脂肽樣品,觀察油膜是否被擠向四周形成圓環。
將G-50 純化的樣品用薄層色譜(thinlayer chromatography,TLC)層析分離并用生物自顯影方法確定抑菌活性物質的位置。具體方法為:將G-50層析收集的脂肽凍干樣品,復溶于含有50%甲醇的磷酸鹽緩沖液(pH 7.0)中,點于預制硅膠板上,用三氯甲烷-甲醇-水64∶25∶4的展開劑層析,用波長為254 nm的紫外燈檢測層析結果。展開結束后,將硅膠板放在碘缸中熏蒸,觀察層析板上是否有黃色的脂質斑點出現。在同時層析的另一塊硅膠板晾干后,倒扣于含有指示菌的平板上,4 ℃冰箱中放置2 h,使產物充分擴散于瓊脂中。之后將平板轉移至37 ℃培養箱中,培養12 h,觀察培養皿中是否有抑菌圈出現。計算碘缸熏蒸和生物自顯影的遷移率。
采用高效液相色譜分離脂肽粗品,采用C18柱,流動相分別為乙腈和水,洗脫條件為:0~3 min,乙腈20%;3~10 min,乙腈20%~40%;10~15 min,乙腈40%~50%;15~30 min,乙腈50%~100%;30~40 min,乙腈100%。流速0.5 mL/min,檢測波長280 nm。收集不同洗脫時間的樣品,進行抑菌實驗,將有抑菌活性的組分進行基質輔助激光解析電離-飛行時間質譜(matrix-assisted laser desorption ionizer-time of flight-mass spectrometry,MALDI-TOF-MS)檢測,對目標峰進行二級質譜檢測,并解析脂肽的結構。
1.3.5 抑菌活性物質的表征
1.3.5.1 抑菌譜
將各保存的受試菌株甘油管按照1%的接種量,接到相應的培養基中培養。其中,P.aeruginosa、S.aureus、V.parahaemolyticusATCC17802、V.cholerae、B.cereus、E.coli用MH培養基37 ℃、180 r/min培養12 h。C.albicans用YPD培養基在28 ℃條件下靜置培養12 h。E.faecalisCICC21605用MRS培養基在 37 ℃靜置培養12 h。L.monocytogenesATCC 19115用TSB-YE培養基37 ℃,180 r/min培養12 h。之后,將各菌種對應的固體培養基融化,待降溫到40 ℃左右,按照1%的接種量接入相應的菌種,迅速混勻,倒入平板。采用牛津杯法進行抑菌實驗,每孔加入20 μL的樣品,分別在各菌株對應的溫度下培養12 h,觀察是否出現抑菌圈,并測量抑菌圈直徑。
1.3.5.2 抑菌活性
純化樣品對L.monocytogenesATCC 19115的最小抑菌濃度(minimum inhibitory concentration,MIC)測定參考Zhang Jun等[13]方法進行。將樣品用無菌水配制成2560 μg/mL樣液,用無菌水進行2 倍梯度稀釋,共稀釋12 管至質量濃度0.125 μg/mL。挑取指示菌平板上的單菌落至5 mL的TSB-YE培養基中,37 ℃、180 r/min培養過夜。按照1%的接種量,將過夜培養的指示菌轉接到30 mL的TSB-YE培養基中,同樣條件培養至OD600nm為0.4,用TSB-YE培養基稀釋1000 倍備用。在96 孔板中,分別加入90 μL稀釋好的菌液和10 μL各稀釋樣品,每個稀釋度做3 個平行。氨芐青霉素(ampicillin,Amp)和無菌水分別為陽性和陰性對照。之后將96 孔板密封,37 ℃、50 r/min搖培12 h,使用酶標儀檢測OD600nm。以96 孔板內完全抑制指示菌生長質量濃度為相應的MIC值。
1.3.5.3 pH值穩定性和熱穩定性
用無菌水配制2 mg/mL的樣品溶液,分別加入等體積0.1 mol/L的Gly-HCl緩沖液(pH 2.0)、醋酸-醋酸鈉緩沖液(pH 4.0)、磷酸鹽緩沖液(pH 6.0和pH 8.0)和Gly-NaOH緩沖液(pH 10.0),將各處理組在37 ℃條件下水浴1 h。熱穩定性實驗,用pH 6.0磷酸緩沖液配制1 mg/mL樣品溶液,分別在20、40、60、80 ℃條件下水浴1 h,100 ℃水浴30 min。不同處理的樣品采用牛津杯法,測定樣品對指示菌的抑菌活性。
1.3.5.4 溶血性
采用心臟采血法對Sprague Dawley(SD)大鼠進行心臟取血,加入肝素管中。取500 μL血液加入2.5 mL生理鹽水,8000 r/min離心4 min,棄上清液,沉淀的血細胞用生理鹽水重復洗滌2 次至上清液無色。取200 μL血細胞加入9.8 mL生理鹽水制成2%紅細胞懸液。取450 μL細胞懸液加入到9 個1.5 mL的EP管中,分別加入50 μL樣品稀釋液(終質量濃度分別為256、128、64、32、16、8、4、2、1 μg/mL)。以相同體積生理鹽水和2%曲拉通-100為陰性和陽性對照。各處理組在37 ℃條件下孵育1 h,之后各樣品取100 μL至96 孔板中,在540 nm波長處檢測吸光度,每個處理組做3 個平行。各處理組溶血性按下式計算:
式中:A樣品為各處理組的吸光度;A0為生理鹽水處理組的吸光度;A100為曲拉通-100處理組的吸光度。
1.4 統計分析
2 結果與分析
2.1 菌株的篩選鑒定
以L.monocytogenesATCC 19115為指示菌,采用Overlay的方法從離體牙樣品中篩選得到1 株具有抑菌活性的菌株1-3。菌落形態觀察,呈圓形,半透明,表面皺褶,有凸起(圖1A)。革蘭氏染色呈陽性,1000 倍顯微鏡下觀察為桿狀(圖2B)。對菌株1-316S rRNA基因序列測序后在NCBI網站用BLASTn比對,選擇相應模式菌株的16S rRNA基因序列使用MEGA7.0構建系統發育樹,結果顯示菌株1-3與B.velezensis聚類到一個分支上(圖2),與B.velezensisAJAS1(MT459821.1)的相似性達99.93%。將上述16S rRNA基因序列數據上傳到國家微生物科學數據中心(National Microbiology Data Center,NMDC),獲得序列號:NMDCN0000QQ7。

圖1 菌株1-3的菌落(A)和菌體(B)形態特征Fig.1 Colonial (A) and cellular (B) morphology of strain 1-3

圖2 菌株1-3的進化樹Fig.2 Phylogenetic tree constructed based on 16S rRNA gene sequence of strain 1-3
糖、醇發酵實驗結果顯示,菌株1-3可以利用蔗糖、乳糖、甘油、果糖、葡萄糖、棉子糖、甘露醇、熊果苷、苦杏仁苷、阿拉伯糖產酸,而不能利用蜜二糖產酸,另外對纖維二糖和甲基α-D-半乳糖苷的利用則不明顯(表1)。以上結果與《伯杰氏細菌手冊》和文獻中B.velezensis的生理生化特征描述基本一致[10,14]。因此,判定菌株1-3為B.velezensis,將其命名為B.velezensis1-3。進一步對菌株1-3轉錄組測序的CDS序列中,隨即抽取9636 條序列進行BLASTn比對分析,發現其中的9566 條序列與B.velezensis一致(表2),更進一步證實了該菌株屬于B.velezensis。
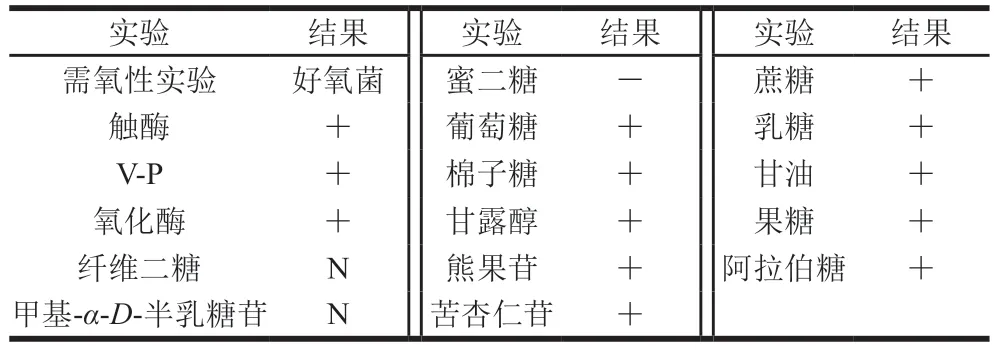
表1 菌株1-3的理化性質Table 1 Physiological and biochemical characteristics of strain 1-3
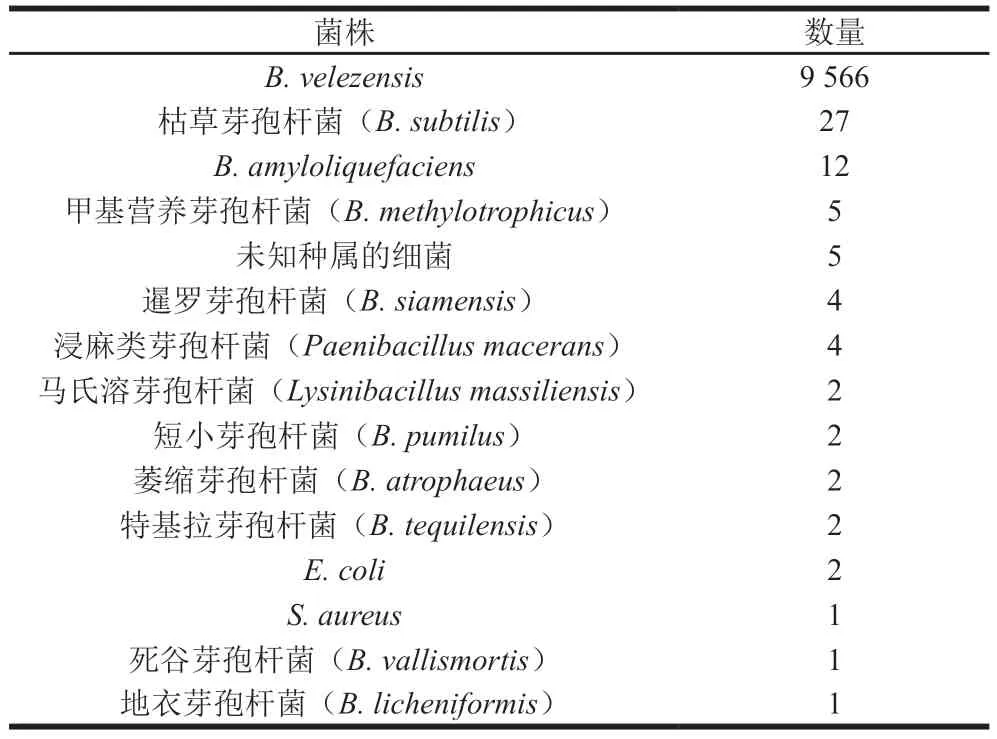
表2 菌株1-3轉錄組測序隨機比對結果Table 2 Results of random transcriptome sequence alignment of strain 1-3
2.2 抑菌活性物質的表達與分離純化
如圖3所示,從8 h開始出現抑菌活性,隨著發酵時間延長抑菌圈逐漸增大,至24 h抑菌活性最大(圖3A),其中8~20 h發酵液上清液之間的抑菌圈直徑達到顯著差異水平,而20 h與24 h樣品的抑菌圈直徑差異不顯著(P>0.05)(圖3B)。整個發酵過程中的pH值在7.0~8.0范圍內,因此可以排除pH值變化對抑菌活性的影響。采用硫酸銨分步沉淀法沉淀具有抑菌活性的產物,結果顯示30%硫酸銨沉淀物的抑菌活性最大,隨著硫酸銨含量的增大,上清液和沉淀的抑菌活性逐漸減小(圖4),表明30%硫酸銨可得到大部分活性物質。將30%硫酸銨沉淀物進行葡聚糖凝膠G-50純化,通過收集不同時間的洗脫組分,進行抑菌實驗,結果如圖5所示,在保留時間150 min左右的抑菌活性最高。將該組分收集后凍干,作為鑒定和特性研究的樣品。

圖3 不同培養時間上清液的抑菌活性(A)和抑菌圈直徑(B)Fig.3 Antibacterial activity (A) and inhibition zone diameter (B) of supernatants at different culture time

圖4 硫酸銨沉淀抑菌活性Fig.4 Antibacterial activity of precipitates obtained by ammonium sulfate salting-out

圖5 G-50分子篩凝膠層析純化層析圖譜和抑菌活性Fig.5 Sephadex G-50 column chromatogram
2.3 活性物質鑒定
排油實驗發現純化產物可以將水面油膜迅速擠向四周,形成一個圓環,表明純化產物具有表面活性劑的功能。該性能為其應用于水體、土壤等方面的有機污染物清理提供了便利[15]。同時,在石油開采中,生物表面活性劑可以有效減少界面鹽水和油之間的張力,通過改變油驅比,提高了石油開采的效率[16]。這對解決日益嚴重的能源危機同樣具有積極意義。采用預制硅膠板對葡聚糖凝膠G-50層析收集到的活性產物進行TLC分離,在254 nm紫外光下的成像結果如圖6A所示。用碘缸熏蒸后出現了3 個比較明顯的斑點(圖6B),其遷移率分別為42%、54%和71%。通過TLC-生物自顯影的方法確定純化產物中含有抑菌活性的組分(圖6C),發現遷移率為71%的組分具有抑菌活性。之前有報道,顯示一種源自B.cereus的脂肽表面活性素(Surfactin)的遷移率為70%[17],與本次分離的產物類似,因此判斷該產物可能是具有表面活性劑功能的脂肽Surfactin。
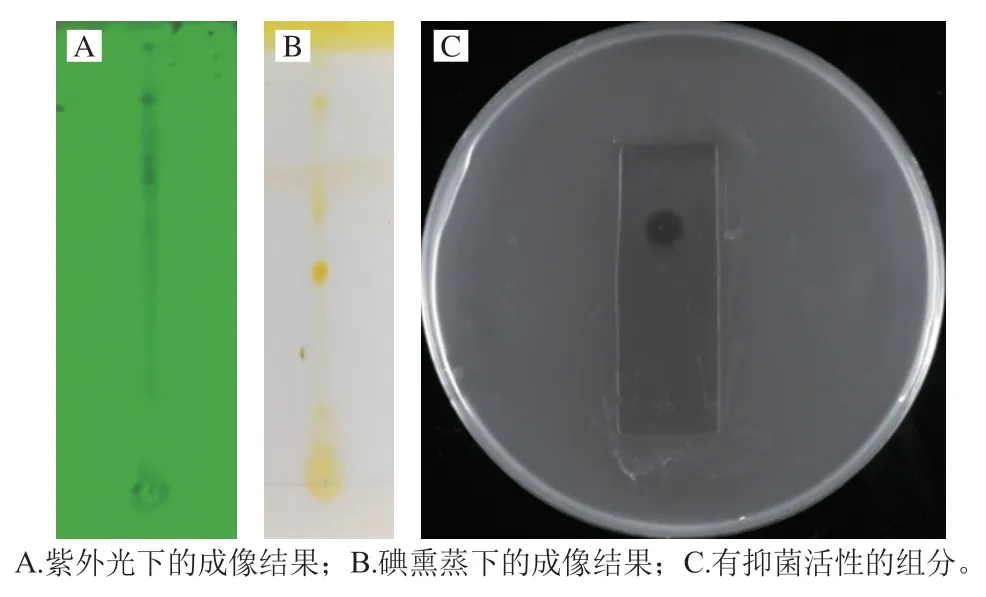
圖6 脂肽物質TLC和抑菌活性生物自顯影Fig.6 TLC and TLC-bioautographic analysis of lipopeptides
G-50純化后的粗品經高效液相色譜進一步純化后,在保留時間34.3 min的組分具有抑菌活性,將該樣品進行MALDI-TOF-MS檢測,發現有3 個特征峰,分子質量分別為1030.642、1044.660 Da和1058.677 Da,3 個特征峰的分子質量相差14 Da(圖7)。之前有研究顯示,B.velezensisKLP2016可以產生具有抑菌活性的Surfactin[15],與本研究分離得到的活性產物分子質量近似。對3 個特征峰進行二級質譜鑒定,結果如圖8所示,對出現的碎片峰進行圖譜解析,發現3 個特征峰得到碎片規律類似,都含有4 個亮氨酸(Leu)、1 個纈氨酸(Val)、1 個天冬氨酸(Asp)和1 個谷氨酸(Glu)組成的環狀結構,以及14~16 個C的脂肪鏈。該結構與之前發現自B.velezensisSH-B74的環狀脂肽Surfactin結構近似[18]。因此,確定在B.velezensis1-3中分離的活性產物為C14~C16的環狀脂肽Surfactin。脂肽Surfactin并非由基因組直接合成,而是在非核糖體肽合成酶的作用下,將不同的模塊連接在一起的特殊結構,具有復雜的生物合成過程[4]。另外,質譜分析結果顯示在脂肪鏈中可能含有3 對雙鍵,并且化合物在254 nm的紫外燈下有明顯熒光吸收,說明其3 個雙鍵可能依次排列形成共軛體系,但其具體位置需要進一步研究確定。
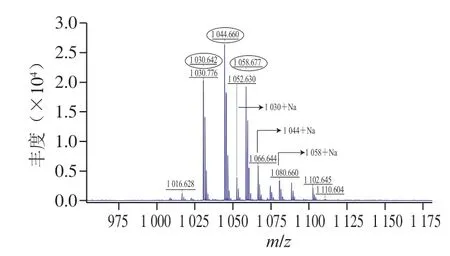
圖7 脂肽物質的鑒定Fig.7 Primary MS spectra of lipopeptides
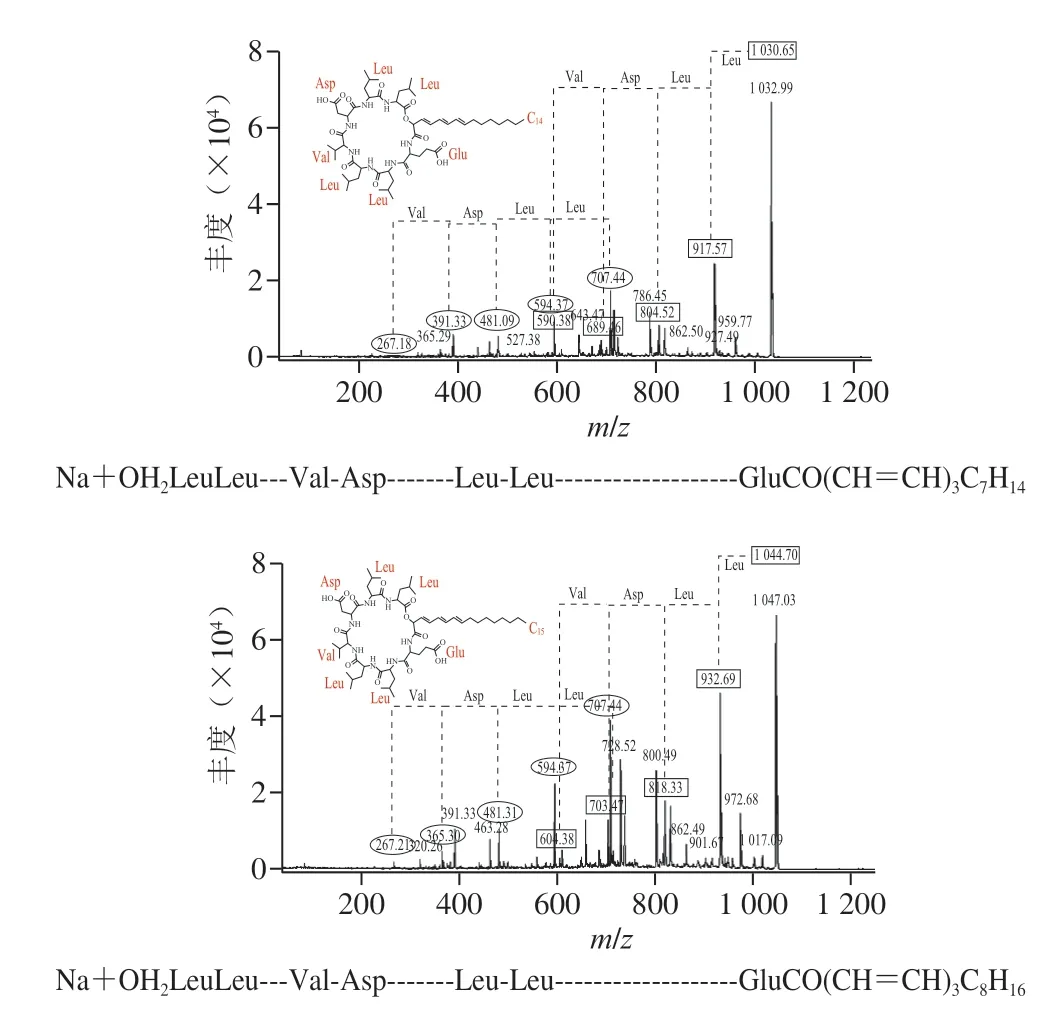
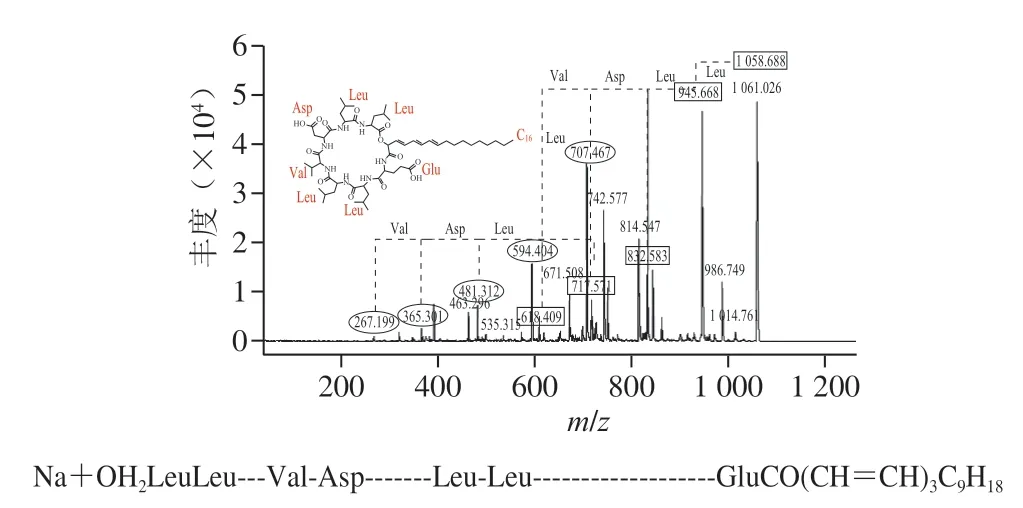
圖8 3 種脂肽物質的二級質譜及結構Fig.8 Secondary MS spectra and structures of three lipopeptides
2.4 抑菌譜和MIC
采用在醫療衛生、食品加工和畜牧生產中常見的病原菌測定Surfactin的抑菌譜,其中包括5 株革蘭氏陽性菌(G+)、6 株革蘭氏陰性菌(G-)和1 株真菌。如表3所示,Surfactin樣品對G+和G-均有一定的抑制作用,且對G+的效果明顯強于G-。之前的文獻報道,Surfactin對G+的S.aureus、L.monocytogenes、B.subtilis、巨大芽孢桿菌(Bacillus megaterium),G-的E.coli、腸炎沙門氏菌(Salmonella enterica)、費格森埃希菌(Escherichia fergusonii)、B.licheniformis和一些植物來源的真菌具有一定抗性[9,17,19-20]。本研究分離的Surfactin未表現出對C.albicans的抑制作用(表3)。但有研究顯示,當Surfactin與氟康唑聯合使用時表現出對C.albicans生長的抑制[21]。除了直接的抑菌作用外,Surfactin還可以激活植物的防御系統。Chowdhury等[22]的研究顯示,來源于B.amyloliquefaciens的Surfactin可以促進萵苣根部防御基因PDF1.2的表達。同時,關于Surfactin的抗腫瘤、抗支原體、抗病毒和抑制藍藻等方面的研究也有一定的報道[16,23]。

表3 純化產物的抑菌譜Table 3 Antibacterial spectra of purified surfactin
L.monocytogenes是一種來源廣泛的食源性致病菌,在高鹽、酸性和低溫(約5 ℃)條件下也可繁殖,據WHO統計,L.monocytogenes雖然感染性不高,但致死率高達20%~30%,因此各國均將其列為重要的公共衛生問題[24]。對樣品MIC實驗結果發現,純化產物在第7孔和第8孔之間出現了明顯的菌濃度變化,因此將樣品對L.monocytogenesATCC 19115的MIC值確定為第7孔對應樣品質量濃度,即4 μg/mL。相同的實驗條件下,Amp對指示菌的MIC為0.0625 μg/mL。雖然Surfactin的MIC大于Amp,但面對日益嚴重的耐藥性病原菌問題,采用抑菌作用機制不同于傳統抗生素新型抗菌物質,可能是解決耐受性病原菌的有效手段。研究顯示,Surfactin的抑菌機制是在病原菌的細胞膜上形成孔洞,引起細胞內的核酸、蛋白、K+、Ca2+等物外流,使細胞代謝受阻,進而導致病原菌死亡[4,9,25-26],而非傳統抗生素的對細胞壁合成的抑制。
2.5 溶血性
不同質量濃度稀釋樣品對SD大鼠紅細胞的溶血性如圖9所示,將陰性和陽性對照的溶血率分別設定為0%和100%,在4~64 μg/mL下溶血率在0.44%~0.89%之間,且組間未表現出顯著差異(P>0.05),而當樣品質量濃度達到128 μg/mL和256 μg/mL時,溶血率分別為1.63%和4.43%,雖然組間表現出顯著差異(P<0.05),但其溶血率仍處于較低水平。Nozhat等[27]對Surfactin C-15進行的體外溶血性和細胞毒性研究顯示,其半溶血率(value of half of hemolytic,HC50)和半抑制濃度(half maximal inhibitory concentration,IC50)分別為47 μmol/L和86.9 μmol/L;孫立軍等[28]在小鼠的體內實驗表明,Surfactin無任何毒性反應,評價為無毒級。Santos等[16]總結Surfactin的體內毒性研究發現,其注射和經口飼喂的半數致死量(median lethal dose,LD50)在100~2000 mg/kg。遠小于其發揮最小抑菌濃度的范圍。同時,Surfactin的肽類屬性其在消化道中會面臨諸多蛋白酶的降解,因此不會產生藥物殘留。

圖9 不同質量濃度Surfactin的溶血性Fig.9 Effect of surfactin at various concentrations on hemolysis of erythrocytes
2.6 pH值穩定性和熱穩定性
樣品在pH 4.0~10.0的環境中處理1 h,對指示菌抑菌活性未發生變化,而在pH 2.0的環境中抑菌活性有所下降,表明酸性pH值對抑菌活性有一定影響(圖10A)。在Surfactin樣品對溫度的耐受性實驗結果顯示,經20、40、60 ℃處理1 h后,對抑菌活性沒有影響,而在80 ℃處理1 h和100 ℃處理30 min后,抑菌活性均能維持在90%左右(圖10B)。Surfactin穩定的環狀結構賦予了其良好的熱穩定性和廣泛的pH值適應性,不同來源的Surfactin均顯示具有良好的熱穩定性和廣泛的pH值適應性[20,29-30]。
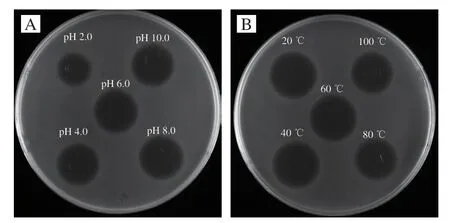
圖10 Surfactin樣品的pH值穩定性(A)和熱穩定性(B)Fig.10 pH (A) and heat (B) stability of surfactin
3 結論
從口腔樣品中分離出1 株具有抑菌活性的B.velezensis1-3。通過硫酸銨沉淀、分子篩層析得到了具有抑菌活性的組分,經排油實驗、TLC、MALDI-TOF-MS等手段確定該活性組分為含有14~16 個C的環狀脂肽Surfactin。抑菌譜和MIC結果表明Surfactin對常見的G+和G-具有抑菌活性,對L.monocytogenesATCC 19115的MIC可達4 μg/mL。較低的溶血性表明Surfactin具有一定的成藥前景,而pH值穩定性和熱穩定性研究則表明了其較強的環境適應性。綜上所述,Surfactin顯示出在食品加工、醫療衛生、畜牧生產和環境治理等方面可能具有一定的應用潛能。然而,目前Surfactin的生產成本仍然較高,大約在100~1000 美元/kg[31]。因此,未來通過對代謝途徑的調控,大幅提高產生菌合成Surfactin的效率,將是其應用的關鍵。

