局部晚期胰腺癌的治療進展
郭世偉
(海軍軍醫大學長海醫院 肝膽胰外科,上海 200433)
胰腺癌(pancreatic ductal adenocarcinoma,PDAC)作為惡性程度最高的腫瘤之一,其發病率居惡性腫瘤的第9 位,但總體致死率極高,到2030年胰腺癌絕對致死人數將僅次于肺癌,成為全球第二大癌癥致死原因[1]。缺乏突破性治療手段,已有療法在胰腺癌中獲益人群有限(有明確免疫/靶向治療指征僅占2%),是導致高致死率的主要原因。因此,目前胰腺癌仍需手術、化療、放療和靶向免疫等在內的綜合系統治療(systemic therapy)來解決問題[2]。在系統治療過程中,根據解剖學表現對患者“根治性切除難度”進行分類[R(resectable):可切除;BR(boderline recectable):交界可切除;LA(locally advanced):局部晚期;MS(metastatistic):轉移],并采取不同治療手段的策略取得了一定效果。其中,對于交界可切除的胰腺癌先給予新輔助治療(neoadjuvant therapy)可以明顯延長總體生存時間(overall survival,OS)已經成為共識;對于轉移性胰腺癌不做非根治性切除,建議其參與能覆蓋全身病灶的化療/靶向/免疫臨床試驗也已經成為主要推薦[2];對于可切除胰腺癌中高危可切除的爭論也只是停留在先做新輔助治療還是先手術的二選一問題中。局部晚期胰腺癌,由于沒有遠處轉移,具有極大的潛在可治愈可能(高治療價值)。然而局部晚期胰腺癌根治性切除的手術復雜、失敗率高,傳統的誘導治療(induction therapy)轉化率低[3],新的局部治療技術(電場、射波刀、溶瘤病毒、納米刀等)的療效尚待明確。因此,如何讓這些潛在可治愈的局部晚期胰腺癌患者獲得治愈機會或長期生存是目前胰腺癌治療領域應該重點解決的難題。
目前針對局部晚期胰腺癌的治療爭議仍較多,甚至“局部晚期胰腺癌”的定義本身就存在爭議,加上“誘導治療+鞏固治療”的復雜治療體系,使得在臨床治療實踐中每個節點的決策都充滿了挑戰。本文擬從局部晚期胰腺癌的概念和規范定義入手,匯總分析目前相關研究的最新進展,結合海軍軍醫大學長海醫院肝膽胰外科的治療經驗,對誘導化療、轉化手術和其他新興局部治療做一梳理,為臨床診療提供循證依據和建議。
1 局部晚期胰腺癌的定義和用詞規范
胰腺癌常用的四分類概念(可切除、交界可切除、局部晚期和轉移)是建立在解剖學基礎上的分類,其目的是劃分根治性切除的難度,評估患者通過手術獲得治愈的可能性。雖然目前的標準包含了根治性手術常涉及的血管和器官(腹腔干、肝總動脈、腸系膜上動脈、門靜脈、腸系膜上靜脈等)的評估,但患者是否能真正獲得根治與術者經驗、術者所在機構的規模和經驗更為相關。尤其是在局部晚期這種涉及多支動脈,靜脈切除/重建的手術中,術者的技術因素才是決定該患者是否可切除的最終標準。因此,在不同的中心/指南中對胰腺癌可切除的標準有不同的說明[4-7]。見表1和表2。
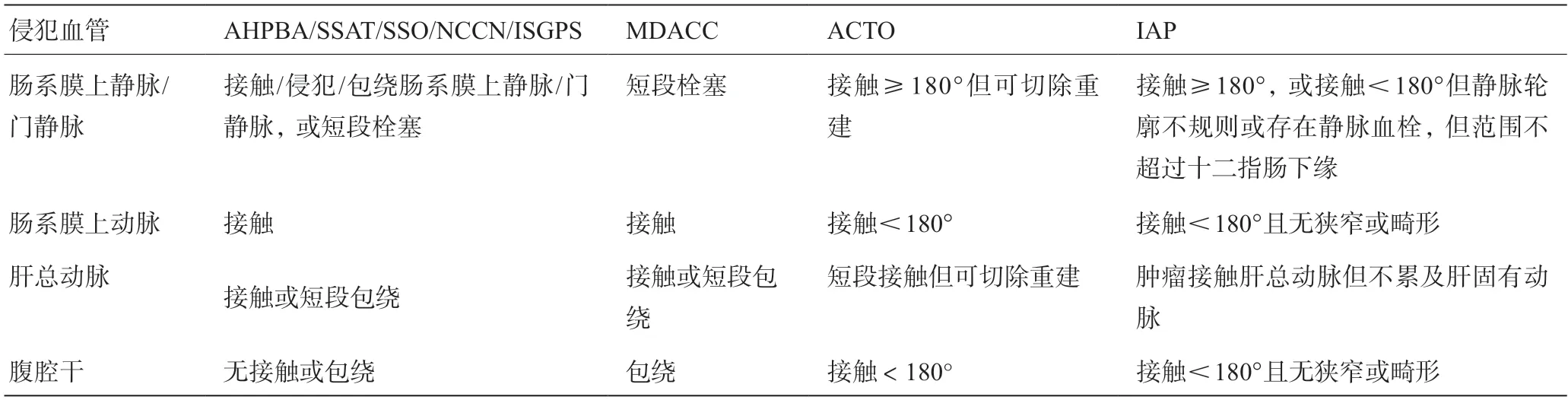
表1 交界可切除胰腺癌的常見定義

表2 不可切除胰腺癌的定義
值得注意的是,這種基于解剖學的四分類為胰腺癌患者“初治”的評估分類,其主要作用為指導“初治患者”的治療決策;而對于經過治療后(誘導化放療等)影像學評估仍是局部晚期的患者,并不意味著不能行包括聯合血管切除的手術治療等[8]。
2 局部晚期胰腺癌治療相關的規范用語
由于各國研究者開展局部晚期胰腺癌治療的時間存在先后,研究的側重點不同,對治療各階段使用的專有名詞也各有不同,為避免歧義、統一用詞,有必要對本文涉及的用詞和翻譯做出必要的規范和注釋。
(1)Induction therapy: Using high doses of anticancer drugs in the initial treatment especially of advanced cancers in order to make subsequent treatment (as surgery or radiotherapy) more effective.
誘導治療:通常針對進展期癌癥患者,在初期治療中使用較高劑量的抗癌藥物,目的是有助于后續治療高效的開展,后續治療一般包括手術和放化療等。
(2)Conversion surgery: It is defined as a surgical treatment with the goal of R0 resection in initially unresectable cancer patients after response to chemotherapy.
轉化手術:指對最初無法手術但化療后出現應答的患者進行以R0切除為目標的手術治療。
(3)Conversion therapy: It is any attempt to change a person’s sexual orientation,gender identity,or gender expression.
轉化治療:是任何改變一個人的性取向、性別認同或性別表達的嘗試。[9](鑒于我國學者在腫瘤的治療中,常用“轉化治療”代表以轉化手術為目的的綜合治療,在特定語境中也有應用,但不建議把中文的轉化治療翻譯為:conversion therapy)
(4)Consolidation therapy: Cancer treatment given after induction therapy to consolidate the gains obtained,further reduce the number of cancer cells and enhance the likelihood of a durable complete remission.
鞏固治療:癌癥患者誘導治療后以鞏固獲得的成果繼續給予的治療,目的是進一步減少癌細胞數量,提高持久完全緩解的可能性。
3 局部晚期胰腺癌的亞型
局部晚期胰腺癌治療的終極目的是通過誘導治療獲得根治性手術機會,即進行轉化手術(conversion surgery)。然而不同動靜脈包繞方式的患者,經過相同誘導治療后獲得根治性手術的概率是有很大區別的。例如,在筆者中心包繞腹腔干的胰腺癌患者有80%經過轉化治療后獲得根治性切除的機會。因此,在初診時就根據轉化后可能獲得根治性切除的概率進行亞型劃分,可能有助于轉化治療目標的設定和選擇轉化治療所使用的手段和強弱。
Chatzizacharias等[10]就在其研究中又把局部晚期胰腺癌劃分成A型和B型,A型患者獲得根治性切除的概率更大,生存更獲益。筆者也同意此類做法,結合本中心治療經驗,根據腫瘤-血管解剖結構及手術難易程度進一步細分為三種亞型(長海分型),見表3。對于轉化希望大的部分患者,治療目的應設定為根治性切除;而對于另一部分轉化手術希望渺茫的患者,治療目的應設定為延長生存并獲得更好的生活質量。

表3 局部晚期胰腺癌亞型
4 現有局部晚期胰腺癌的指導原則和爭議
雖然目前全球學者/各大指南對局部晚期胰腺癌先進行誘導治療的原則沒有爭議,但對治療前需評估的內容,誘導治療的初始方案,鞏固治療(consolidation)的可選方案及隨訪策略還存在一定的爭議[11-12],見表4。
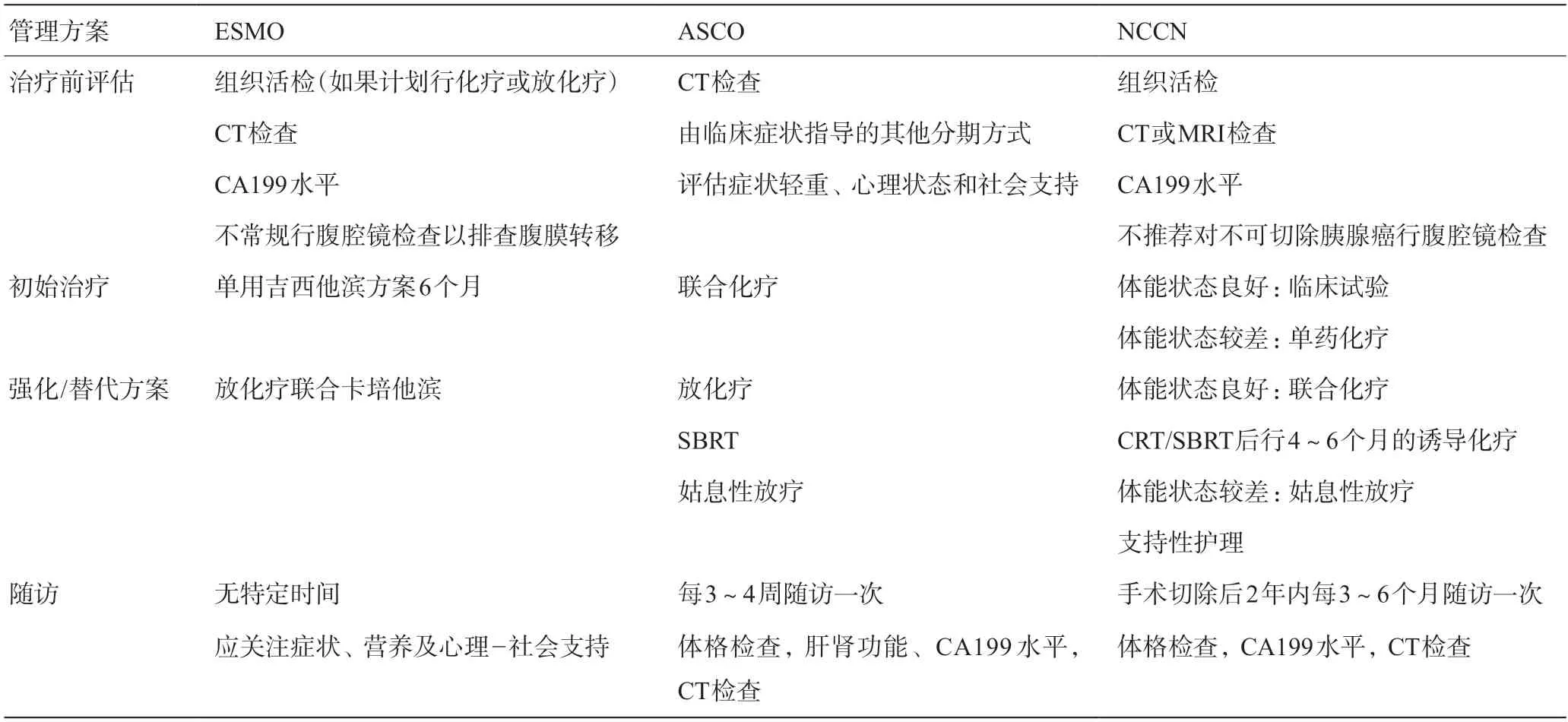
表4 當前ESMO/ASCO/NCCN指南推薦的局部晚期胰腺癌患者管理方案
誘導治療的目的是給予后續治療(subsequent treatment),其中對合適的患者施行轉化手術(conversion surgery),對不具備手術條件/無意愿的患者采取化放聯合的鞏固治療(consolidate therapy)或其他新一代局部治療技術(SBRT、納米刀等)。誘導治療作為絕大部分局部晚期患者的初始治療方案,其有效性和安全性決定了患者后續治療“選項”的多寡[13]。誘導治療效果好的患者更有可能獲得根治性切除的機會,效果差的患者可能只能被迫進入姑息治療。因此,誘導治療是局部晚期患者最重要的治療階段,也是目前研究較多、爭議最多的部分,下文也將按照“治療前評估-誘導治療-轉化手術-鞏固治療-其他治療方式-術后隨訪”的邏輯進行討論。
4.1 治療前評估
ASCO指南對于局部晚期胰腺癌的診斷僅需影像學評估,并未明確是否需要行穿刺活檢。ESMO指南中規定對于擬行化放療的患者需要行穿刺活檢,一般考慮超聲內鏡下活檢,只有在高度懷疑有腹膜轉移的患者中才建議行腹腔鏡下探查。NCCN指南則建議所有患者均應該行超聲內鏡下活檢,而對于局部晚期的患者不考慮腹腔鏡探查。
ASCO指南只建議治療前行CT、癥狀和體力狀態等評估,并未常規納入CA199;ESMO指南建議行CT和CA199聯合評估;NCCN指南同樣建議行CT和CA199 聯合評估,MRI可作為替代。同時,在2022年最新v1 版中,NCCN指南還建議,對于病理確認為胰腺導管腺癌的患者,應該行基因檢測(包括遺傳突變和體細胞突變),并對有梗阻性黃疸患者行膽管金屬支架減黃。
4.2 誘導和鞏固治療
歐洲ESMO指南推薦的初始治療方案為吉西他濱6 個月的單藥治療,可替代的方案為卡培他濱為基礎的化療聯合放療;而ASCO指南首選推薦為雙藥以上的聯合化療方案,備選方案為化放療或單獨放療(SBRT)。NCCN指南則強烈建議體力狀態較好的患者進入臨床試驗,未進入臨床試驗的患者建議行雙藥以上的聯合化療4~6個月,之后可以考慮化放療或SBRT維持;體力狀態較差的患者行單藥化療為主,不能耐受者可考慮姑息放療和支持治療。
雖然局部晚期胰腺癌沒有明確的遠處轉移,但仍存在微轉移風險,尤其是在高風險患者中(腫瘤指標高,腫瘤較大,合并淋巴結轉移等)微轉移的可能性極大[13]。因此,所有確診局部晚期的胰腺癌患者都應盡早接受系統治療(針對原發腫瘤和潛在微轉移)。其中,對于體力狀況良好的患者,應優先考慮進行誘導化療或放化療,控制疾病進展,緩解癥狀,改善生活質量。部分效果較好的患者通過初始治療可能達到部分病理緩解甚至完全病理緩解,從而把無法切除的局部晚期胰腺癌轉化為可切除的疾病。
雖然目前認為能接受誘導治療的患者預后更好,但仍缺乏高等級證據的支持。針對局部晚期胰腺癌,已公布數據的3項前瞻性臨床試驗包括,Ⅱ期SCALOP(2013年)[14]、Ⅲ期LAP07(2016年)[15]和Ⅱ期LAPACT(2020年)[16]。由于研究設計的年份差距較遠,所用的誘導治療方案不同,其總體結果也存在一定差異。(1)SCALOP試驗[14]的誘導方案為:3個標準周期的吉西他濱+卡培他濱;而后兩組分別給予6 個周期的以吉西他濱或卡培他濱為基礎的鞏固放化療(50.4 Gy)。(2)LAP07試驗[15]的誘導方案的對照組為4 個標準周期的吉西他濱單藥,實驗組為吉西他濱+厄洛替尼;鞏固治療的對照組是6個周期的吉西他濱單藥治療,實驗組為卡培他濱為基礎的放化療(54 Gy)。(3)LAPACT16的誘導方案為6個周期的吉西他濱+白蛋白紫杉醇(GnP),鞏固治療方案為:①手術;②以吉西他濱或卡培他濱為基礎的鞏固放化療;③繼續給予吉西他濱+白蛋白結合型紫杉醇化療。在意向性分析中(ITT),58%(SCALOP)、87%(LAP07)和56%(LAPACT)的局部晚期患者在誘導治療過程中出現腫瘤進展,無法進行后續鞏固治療,提示聯合方案的誘導治療可能更具優勢。同時,隨著FOLFIRINOX和GnP方案成為轉移性胰腺癌的標準方案后,其也被建議為局部晚期治療的一線方案,2015年以后的研究也多采用FOLFIRINOX或GnP方案作為誘導治療的基準方案,以轉化手術/化放聯合治療/維持治療作為鞏固治療方式。
采用哪種聯合化療方案進行誘導治療將成為下一個研究的焦點。目前已有的數據多為回顧性研究和基于回顧性數據的Meta分析[16-31],見表5。只有日本癌癥協會在ASCO 2021 年會報道了JCOG1407研究(mFOLFIRINOX組vsGnP隨機對照組)的初步結果:1 年總生存率77.4%vs82.5%,2 年總生存率48.2%vs39.7%,中位OS 2.0年vs1.8年,1年無進展生存率47.5%vs40.2%,緩解率30.9%vs41.4%。此外,Williet等[32]利用回顧前瞻性研究的方法(retroprospective study)比較了GnPvsFOLFIRINOX一線治療局部晚期胰腺癌患者的效果,結果顯示手術切除率(16.7%vs16.1%)和R0切除率相似(88.9%),中位PFS(9個月vs12.1個月)和中位OS無統計學差異(15.7 個月vs16.7 個月)。總體看兩種方案的緩解率為18%~47%之間,切除率6.3%~44%,R0 切除率30%~100%,總體中位OS為10.4~35.4 個月,且手術切除患者的OS明顯延長。因此,再結合FOLFIRINOX和GnP在可切除胰腺癌中的研究結果(SWOG1505),目前認為兩種方案沒有明顯差別,均可作為誘導治療的初始方案。
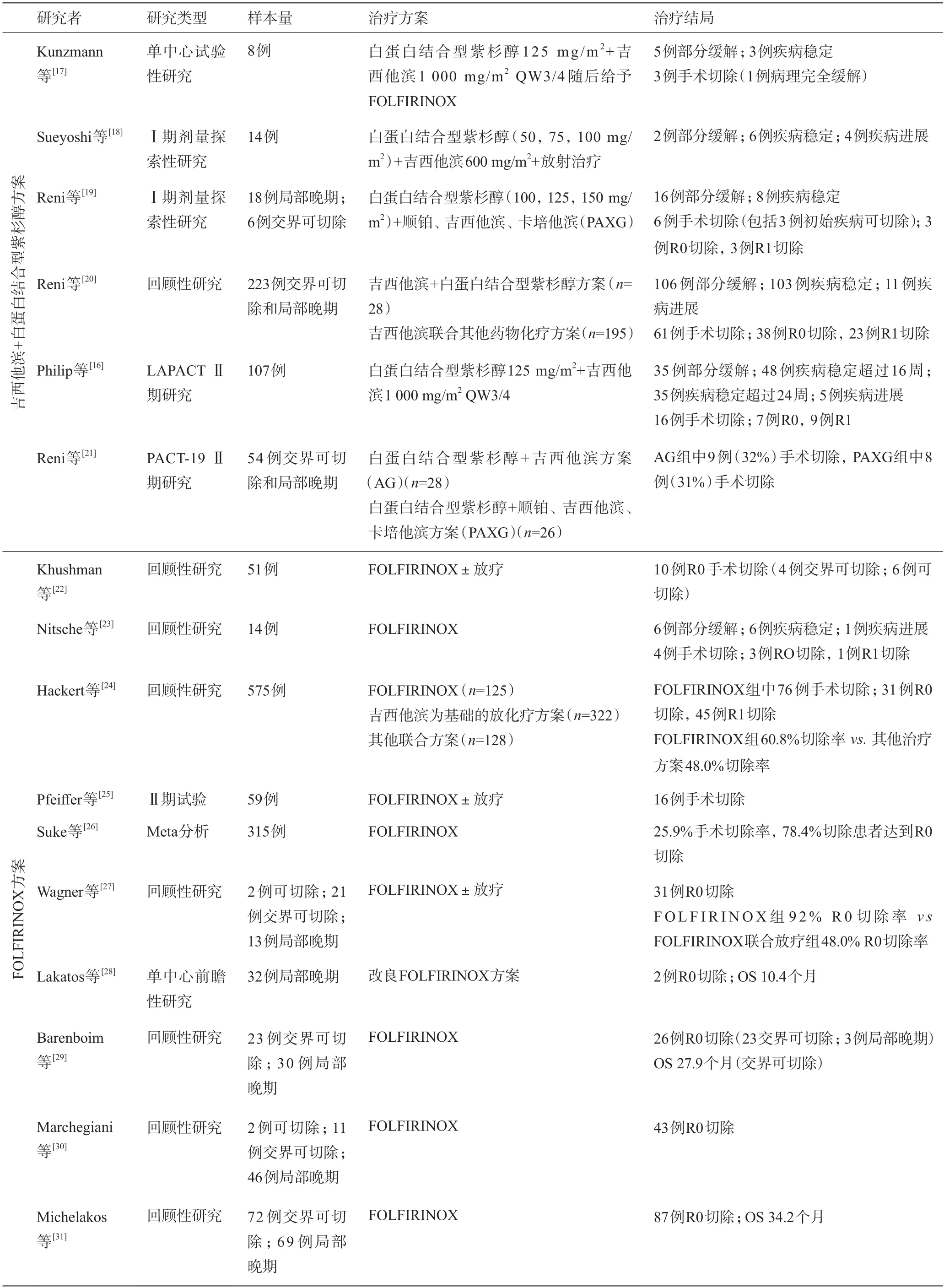
表5 局部晚期胰腺癌患者行吉西他濱+白蛋白結合型紫杉醇和FOLFIRINOX方案化療的試驗結果
同時,因為誘導治療方案的不同,所需的誘導治療時間也存在爭議。目前在綜合考慮常用化療方案的起效時間,最大耐受劑量/周期,患者體力狀況和潛在對手術安全性的影響下,一般認為不應超過6個周期[12](一般指6個月)。并建議在轉化治療過程中,每周期對患者進行一次再評估和重新分期,并由多學科團隊根據結果討論是否繼續轉化治療或手術。
另外值得注意的是,即使同為局部晚期的胰腺癌患者也可能表現為截然不同的生物學行為:部分患者無論給予何種治療都呈現出快速進展直至死亡,而另一些在誘導治療或者姑息放療后長時間穩定/不進展。因此,局部晚期患者的治療選擇不能僅僅依賴于腫瘤大小、淋巴結、遠處轉移和可切除性的解剖學定義,應更多考慮腫瘤的生物學行為,如CA199水平、體能狀態、體重減輕和生化參數等[12,33-34]。
4.3 轉化手術
轉化手術的R0切除是延長局部晚期胰腺癌患者生存期的重要治療方法[35],且絕大部分研究認為轉化手術安全性與標準切除術相比沒有統計學差異。因此,國際胰腺外科研究小組(ISGPS)強烈建議經過誘導治療后,在有可能進行血管重建的情況下進行手術探查和切除,并對動脈和靜脈侵犯/重建做出了說明[7]。
一般門靜脈/腸系膜上靜脈(PV/SMV)切除重建可分為四種常見類型:直接吻合、補片修補、自體血管重建、人工血管重建。四種方法各有優缺點,選擇哪種切除重建方式主要取決于腫瘤大小及血管浸潤程度。具體來說,腫瘤切除后靜脈管腔狹窄<30%,首選直接吻合或補片修補,血管遠期通暢率最高;管腔狹窄≥30%,切除靜脈長度小于2~3 cm,可選擇自體血管重建(推薦大隱靜脈);否則選擇人工血管重建[36]。大量文獻薈萃分析結果顯示:合并PV/SMV切除重建的胰腺癌根治性手術預后與標準手術切除在圍手術期死亡率、并發癥發生率、R0切除率及總體生存時間方面無明顯差異[37-38]。但也有文獻表明合并PV/SMV切除的患者圍手術期死亡率增加,切緣陽性率更高,生存率更差[39],這可能與靜脈切除組的疾病更晚期有關。
因動脈切除重建手術難度大,風險高,圍手術期并發癥和死亡率難以控制,術后患者無明顯生存獲益,所以是否行動脈切除重建存在很大爭議。目前ISGPS共識不推薦術中合并動脈切除重建[7]。但隨著新輔助治療越來越多的應用于局部晚期胰腺癌的誘導治療中,聯合腹腔干切除的胰體癌根治術(DPCAR)顯示出了良好的生存改善[40-41]。本中心經過多年摸索,在經過高度選擇的局部晚期Ⅰ型和Ⅱ型的胰體癌患者中行新輔助治療后的手術完成率、術后并發癥發生率和圍手術期死亡率均在臨床可接受范圍,且中位生存時間明顯高于直接手術組[8,42]。
擬行轉化手術前,充分的影像學評估是必不可少的。目前的影像學技術(胰腺動脈CTA/三維立體重建/PET-MRI等)使我們在術前評估血管浸潤程度及判斷能否切除重建都已成為可能,甚至允許術前就規劃好手術入路和備好合適的人工血管等。因此,聯合血管切除重建的轉化手術應該是主動而不是被動的手術。但需要留意的是,由于化療后間質纖維化、局部炎癥粘連等問題,術前基于實體腫瘤療效評價標準(RECIST)的影像學評估并不準確,可能導致不必要的血管切除重建,需要術者根據術中實際探查情況謹慎選擇[43]。
4.4 “不可轉化LAPC”的治療
盡管誘導化療在局部晚期胰腺癌患者的手術禁區邁出了一大步,但仍有70%的患者在治療后因腫瘤無明顯消退或持續局部進展而無法接受手術[44]。因此,針對局部晚期Ⅲ型,即“不可轉化LAPC”患者的治療顯得尤為重要。目前可用于局部晚期胰腺癌的非手術治療選擇除傳統的全身化療、放療外,還衍生出了許多局部治療方法,包括:立體定向放射療法(SBRT,即射波刀技術)、局部消融、高強度聚
焦超聲(HIFU)和區域動脈內化療(RIAC)等。其中,局部消融技術根據能量分為熱消融技術和非熱消融技術,前者包括射頻消融(RFA)、冷凍消融(CA)、微波消融(MWA)等,后者主要為不可逆電穿孔(IRE,即納米刀技術)和可逆電化學療法(ECT)[45]。
立體定向放射療法,即用多個三維設計的小照射野以單次大劑量定向照射靶區病灶,原理類似于利用放大鏡將光線集中在一點,產生區域能量聚集以達到對靶區病灶的精確毀損作用。SBRT同時綜合了3D適形放射技術(3D-CRT)的高生物有效劑量與強度調制RT(IMRT)的呼吸門控技術,常與化療聯合使用以改善腫瘤的局部控制。Kozak等[46]對接受SBRT治療的局部晚期患者的19 項試驗進行了系統評價和匯總分析,研究顯示中位總生存期為17個月。但SBRT的臨床應用也有諸多難題,各研究中心在照射總劑量和分割劑量上存在很大的異質性。通常認為使用總劑量范圍為30~45 Gy,分3~5次,其有效生物劑量(BED)更高,可以產生更強的細胞破壞作用。其次是輻射相關并發癥的問題,由于胰腺是一個腹腔深位器官,因此目標腫瘤劑量可能會被胰腺周圍的其他器官接收,產生包括消化道潰瘍和狹窄、十二指腸穿孔等在內的嚴重腸道毒性風險[47]。這些問題限制了SBRT的放療次數,并要求SBRT治療在一到兩周內集中進行,從而減少化療中斷的時間,提高患者的依從性和療效。
納米刀技術使用超短高壓直流脈沖在細胞膜上產生一個電場,此過程破壞膜穩態并不可逆地改變跨膜電位,從而激活凋亡途徑并導致細胞死亡。納米刀具有保留細胞外基質、關鍵血管結構、膽管和腸道的獨特能力,并最大程度地減少熱沉損傷。該技術除了細胞減滅能力外,還具有誘導全身免疫調節的能力。通過釋放抗原和與損傷相關的模式分子(DAMPs),誘導腫瘤細胞凋亡和壞死后的全身性免疫反應,從而促進樹突狀細胞和其他抗原呈遞細胞的成熟,這些細胞隨后可以激活淋巴性T細胞,從而誘導持久的抗腫瘤效應。此外,這種效應可能導致遠處轉移的消退,這一過程被稱為“遠視效應”。這些作用與免疫療法相結合可能提供一種全新的治療方法[45],但其臨床實際應用可能還有很長的一段路要走。
以上這些技術的出現和應用使得局部晚期患者的生存時間進一步延長,并有望使經聯合治療后腫瘤明顯退縮的患者獲得再次手術切除的機會。但這些技術中絕大多數缺乏高等級循證醫學證據支持,更有部分是國外淘汰的技術拿到國內換個名稱和包裝再使用。因此,筆者中心通常采用SBRT作為優選治療手段,無創/微創建議入組臨床試驗(如TTFiled電場治療),不推薦有創治療。
4.5 隨訪策略
ESMO指南中并未具體說明,僅強調關注癥狀、營養和社會心理的改善;ASCO指南推薦的隨訪周期為3~4個月,評估指標包括體格檢查,肝腎功能,腫瘤指標和影像學檢查;NCCN指南則對誘導化療后切除患者的隨訪周期做了明確說明,建議術后2年內每3~6個月評估一次,評估指標應該包括體格檢查,腫瘤指標和影像學檢查。
這里要說明的是,由于不同指南更新的頻次不一,表4所列的版本發布時間也不統一,目前只列出該指南發布時的建議,實際內容可能隨著新版本的發布而更新。但從以上指南中的區別中我們仍能發現不同區域組織對待局部晚期胰腺癌的積極程度不一致,仍有許多問題等待進一步解決。
4.6 局部晚期治療效果的再評估
目前,絕大多數腫瘤治療的臨床試驗評價均以OS作為主要研究終點,其次是無疾病生存期(diseasefree survival,DFS)、無進展生存期(progression-free survival,PFS)和疾病進展時間(time to progress,TTP)作為次要終點。然而,目前局部晚期胰腺癌“誘導治療+手術/化放療/維持治療”的復雜模式使單純只依靠上述指標的評價模式不能完全反映整個治療過程中出現的多種結局組合和重要事件。因此,除上述試驗終點外,近期有研究提出采用無事件生存期(event-free survival,EFS)作為新的評價指標[48]。既往美國臨床腫瘤學會將EFS定義為腫瘤復發或現有腫瘤進展的時間,美國國家癌癥研究所將EFS定義為患者沒有某些并發癥或事件的時間,旨在預防或延遲這些并發癥或事件。但在局部晚期的治療過程中,要綜合考慮手術和鞏固治療對總體生存的影響,因此,還應將終點概念擴展至:(1)未能在誘導治療或手術結束后達到局部無疾病狀態;(2)通過影像學檢測發現疾病局部區域或遠處復發;(3)死亡,詳見圖1。通過這樣的描述,EFS終點可以更科學的評價局部晚期腫瘤的治療效果,并可能在未來的研究中成為一個更有價值的研究終點,豐富甚至替代OS和生存質量(quality of life,QOL),加速臨床研究的開展。
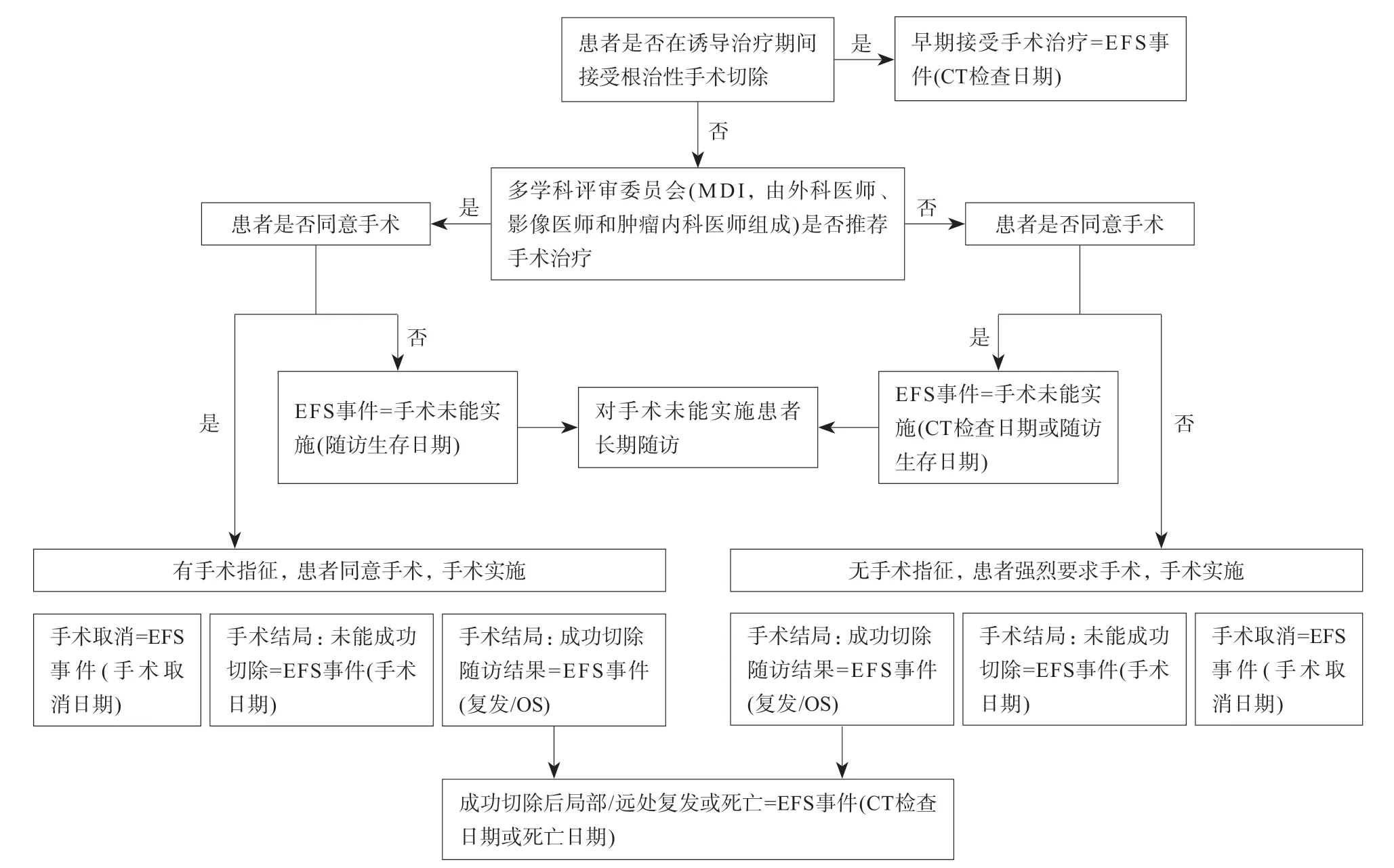
圖1 LAPC中EFS的定義
綜上所述,當和胰腺癌的全面戰爭真正縮小到“局部晚期”這個焦點戰場的時候,“戰術水平”的具體決策往往顯得更為復雜。當前,其治療要涉及多種治療方案的選擇,多個治療階段的銜接和最終總體治療效果的評價,更加考驗多學科團隊的合作和綜合實力。未來,局部晚期的最佳治療模式需要更多替代研究終點,更科學的循證醫學研究去證實。

