缺血性腦卒中偏癱病人血清神經絲輕鏈、磷酸化神經絲重鏈水平與肌肉萎縮程度的相關性
惠琳娜,曹 輝,李 娟,牛 丹,張艷榮,王艷玲,邵 雯
缺血性腦卒中(AIS)是全球第二大死亡原因和第三大致殘原因,盡管靜脈溶栓、機械取栓、抗血小板等綜合治療手段不斷改進,病人生存率得以提高,但是大部分病人仍遺留不同程度功能障礙[1]。AIS偏癱病人在發病后10 d內即可出現肌肉萎縮,肌肉萎縮不僅降低病人日常生活活動能力,還導致葡萄糖代謝下降,骨質疏松,增加下肢骨折的風險[2]。偏癱病人肌肉萎縮的發生與神經元損傷有關,現有報道顯示AIS后脊髓α運動神經元突觸信號傳遞中斷導致運動單位數量減少,肌肉組織結構發生改變[3]。神經絲是高度特異性結構神經元細胞骨架蛋白,被認為是神經損傷的敏感標志物[4]。神經絲輕鏈(NFL)和磷酸化神經絲重鏈(pNFH)是軸突細胞骨架的重要組成部分,可敏感反映神經系統損傷,血清NFL、pNFH水平升高被認為與急性腦血管事件發生有關[5-6]。但NFL、pNFH與AIS所致偏癱病人肌肉萎縮是否存在關聯尚不清楚,鑒于此,本研究擬檢測AIS病人血清NFL、pNFH水平,分析其與AIS所致偏癱病人肌肉萎縮的關系。
1 資料與方法
1.1 臨床資料 選擇2017年3月—2021年10月我院收治的105例AIS所致偏癱病人(偏癱組),其中,左側偏癱48例,右側偏癱57例。納入標準:①符合《中國急性缺血性腦卒中診治指南2014》診斷流程和標準[7];②AIS后發生偏癱;③年齡18~80歲。排除標準:①脊髓前角灰質炎、運動神經元病、格林巴利綜合征等神經源性肌肉萎縮;②多發性肌炎、肌營養不良等肌源性肌肉萎縮;③低鉀性周期性麻痹;④有上下肢手術史、周圍血管性疾病。另選擇45例未發生偏癱的AIS病人(無偏癱組)和門診接待的30名體檢志愿者(對照組)。3組性別、年齡、吸煙史、飲酒史比較差異均無統計學意義(P>0.05),偏癱組和無偏癱組合并疾病、病程比較差異無統計學意義(P>0.05),偏癱組美國國立衛生研究院卒中量表(NIHSS)評分高于無偏癱組(P<0.05)。詳見表1。本研究已經獲得我院倫理委員會批準,病人及其家屬均知情同意,并簽署同意書。

表1 3組基線資料比較
1.2 實驗室檢查 所有受試者入組后24 h內(對照組體檢當日晨)采集靜脈血3 mL注入干燥試管,取干燥試管標本中血液凝固后上清液離心(上海邁皋科學儀器有限公司M16RS高速離心機,參數:3 000 r/min,離心半徑10 cm,離心時間5 min)后取血清-20 ℃保存。采用MRX A2000酶標儀(韓國Keen Innovative Solutions)運用酶聯免疫吸附試驗檢測血清NFL、pNFH水平,試劑盒購自北京博奧生物技術公司。
1.3 肌肉萎縮評估
1.3.1 骨骼肌質量(ASM)、肌力和步速 AIS病人病情穩定后(對照組體檢當日)采用雙能X線骨密度儀(MG A型,美國)測定偏癱側(對照組、無偏癱組測量任一側)ASM,計算相對骨骼肌指數(RASM),RASM=ASM/身高(m)2。采用Jamar握力計測量偏癱側(對照組、無偏癱組測量任一側)握力,6 min步行法測量步速,記錄最快的一次步速。均取3次測量的平均值。
1.3.2 神經電生理 AIS病人病情穩定后(對照組體檢當日)采用Keypoint型全功能肌電誘發電位儀(丹麥丹迪)檢測偏癱組病人偏癱側神經及其支配肌肉(無偏癱組和對照組檢測任一側)。檢測指標包括:正中神經、尺神經、脛神經、腓總神經的運動神經傳導速度(MNCV)及感覺神經傳導速度(SNCV)。

2 結 果
2.1 偏癱組、無偏癱組、對照組血清NFL、pNFH水平比較 偏癱組血清NFL、pNFH水平均高于無偏癱組與對照組(P<0.05),無偏癱組血清NFL、pNFH水平高于對照組(P<0.05)。詳見表2。
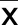
表2 偏癱組、無偏癱組、對照組血清NFL、pNFH水平比較(±s) 單位:ng/L
2.2 偏癱組、無偏癱組、對照組ASM、RASM、握力和步速比較 偏癱組ASM、RASM、握力和步速小于無偏癱組和對照組(P<0.05)。無偏癱組和對照組ASM、RASM、握力和步速比較差異均無統計學意義(P>0.05)。詳見表3。
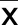
表3 偏癱組、無偏癱組、對照組ASM、RASM、握力和步速比較(±s)
2.3 偏癱組、無偏癱組、對照組神經電生理指標比較 偏癱組正中神經、尺神經、脛神經、腓總神經MNCV和SNCV小于無偏癱組和對照組(P<0.05)。無偏癱組和對照組正中神經、尺神經、脛神經、腓總神經MNCV和SNCV比較差異均無統計學意義(P>0.05)。詳見表4。
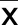
表4 偏癱組、無偏癱組、對照組神經電生理指標比較(±s) 單位:m/s
2.4 偏癱組血清NFL、pNFH水平與ASM、RASM、握力和步速的相關性 偏癱組血清NFL、pNFH水平與ASM、RASM、握力和步速均呈負相關(P<0.05)。詳見表5。

表5 偏癱組血清NFL、pNFH水平與ASM、RASM、握力和步速的相關性
2.5 偏癱組血清NFL、pNFH水平與神經電生理指標的相關性 偏癱組血清NFL、pNFH水平與正中神經、尺神經、脛神經、腓總神經MNCV和SNCV均呈負相關(P<0.05)。詳見表6。

表6 偏癱組血清NFL、pNFH水平與ASM、RASM、握力和步速的相關性
3 討 論
AIS是導致成人殘疾的主要原因,約40%AIS病人遺留中度功能障礙,15%~30%遺留重度殘疾,目前研究較少關注AIS后肌肉質量的變化,據統計腦卒中幸存者下肢肌肉面積和體積比正常下肢低20%~24%,肌內脂肪比正常下肢高17%~25%[3]。AIS偏癱相關肌肉萎縮的發病機制尚不清楚,現有研究認為,與制動、廢用性萎縮、進食障礙、炎癥、交感神經過度激活和去神經支等多種因素有關[3]。運動神經元損傷是AIS后肌肉萎縮的關鍵因素,AIS后中樞神經系統下行抑制功能喪失,皮質脊髓營養供給不足,導致跨突觸改變和運動功能退化,在AIS發生后4 h,偏癱側肢體肌肉組織中運動單位數量就開始減少[8]。神經絲是中間絲蛋白家族成員,主要在神經元細胞質、軸突中特異性表達,具有誘導軸突徑向擴張,維持軸突細胞骨架,調節神經信號傳導等作用,神經元損傷時神經絲被釋放到間質液中,進入腦脊液和外周循環,可在腦脊液和血液中檢測到[9],因此,檢測血清神經絲水平有望為AIS肌肉萎縮程度評估提供參考。
NFL是一種蛋白磷酸酶-1結合蛋白,是目前神經絲研究最廣泛的亞型,任何因素引起的神經元和軸突損傷均可引起NFL釋放增加,腦脊液和血清NFL水平增高[10]。pNFH是腦組織中磷酸化程度最高的蛋白質之一,由神經絲重鏈修飾而成,可促使神經元發育,神經纖維信號傳導,抵抗蛋白質降解,維持細胞骨架穩定,腦脊液和血清pNFH水平反映神經系統再生和退化、軸突損傷和再生間平衡關系[11]。現有報道顯示,肌萎縮側索硬化[12]、阿爾茨海默病[13]病人血清NFL水平明顯增高,并且可作為肌萎縮側索硬化、阿爾茨海默病的鑒別診斷指標。pNFH也被證實在肌萎縮側索硬化[14]、小腦共濟失調[15]、運動神經元疾病[16]病人血液或腦脊液中升高,反映疾病嚴重程度和疾病進展。Darras等[11]報道指出脊髓性肌萎縮癥嬰兒血漿pNFH水平明顯增高,并在治療后降低,血漿 pNFH水平被認為是脊髓性肌萎縮癥疾病活動和治療反應的標志物。
NFL、pNFH在AIS所致偏癱病人肌肉萎縮方面的報道十分少見,本研究發現偏癱組、無偏癱組血清NFL、pNFH水平均高于對照組,說明NFL、pNFH在AIS病人中均升高,分析原因為大腦缺血缺氧損傷神經和軸突,NFL、pNFH釋放至腦脊液,進入外周血循環,導致血清NFL水平升高。進一步比較發現,血清NFL、pNFH水平在偏癱病人中更高,表明NFL、pNFH水平與AIS神經損傷程度有關。Pekny等[17]報道也指出血清NFL水平升高與腦卒中病人神經損傷嚴重程度相關。本研究偏癱組ASM、RASM、握力、步速及正中神經、尺神經、脛神經、腓總神經MNCV和SNCV低于無偏癱組和對照組,無偏癱組與對照組比較差異均無統計學意義,提示偏癱病人可出現明顯的骨骼肌質量的減少、肌力的減退和神經傳導異常。相關性分析顯示,偏癱組血清NFL、pNFH與ASM、RASM、握力、步速以及正中神經、尺神經、脛神經、腓總神經MNCV和SNCV呈負相關,說明NFL、pNFH水平越高,AIS所致偏癱病人神經傳導異常越明顯,肌肉萎縮程度越重,肌肉質量和肌力越低,NFL、pNFH水平可反映ASI所致偏癱病人肌肉萎縮程度。推測其機制為:AIS所致偏癱肌肉萎縮與α運動神經元退化有著密切關系,AIS損傷神經元和軸突可導致NFL產生和神經絲重鏈異常磷酸化,引起神經元和軸突中NFL異常聚集,pNFH過度積累和功能紊亂,導致軸突變性,神經纖維萎縮,影響突觸連接和信號轉導,繼而引起神經傳導受損,運動神經元功能障礙和肌肉萎縮。
綜上所述,AIS所致偏癱病人存在明顯肌肉萎縮,血清NFL、pNFH水平與AIS所致偏癱病人骨骼肌質量減少、肌力降低、神經電生理異常有關,可作為AIS所致偏癱病人肌肉萎縮的評估指標。

