基于網絡藥理學及實驗驗證探討香砂六君子湯治療功能性消化不良作用機制
趙琳娜 ,成映霞 ,白敏 ,劉夢雅 ,李潤法 ,高晗 ,安耀榮 段永強
1.甘肅中醫藥大學,甘肅 蘭州 730000; 2.甘肅省實驗動物行業技術中心,甘肅 蘭州 730000;3.寧夏醫科大學中醫學院,寧夏 銀川 750004; 4.石家莊傅山腫瘤醫院,河北 石家莊 050000
功能性消化不良(functional dyspepsia,FD)是臨床常見的功能性胃腸道疾病之一,全球總患病率約為16%[1],我國患病率可達20%[2],對患者生理、心理及社會產生嚴重影響[3]。FD臨床主要表現為上腹部飽脹感、早飽感、上腹痛、上腹部燒灼感等,且無明顯器質性病變。FD病理機制復雜,現代醫學多認為與十二指腸低度炎癥、胃腸動力障礙等因素有關,常用促胃腸動力、抑酸劑等藥物進行治療,但復發率較高[4]。
FD屬中醫學“痞滿”范疇,其病因病機復雜,主要與脾胃虛弱、飲食不節、情志失調、勞倦過度、先天稟賦不足等相關,其中脾胃虛弱為其主要病機。《證治匯補》有“大抵心下痞悶,必是脾胃受虧,濁氣挾痰,不能運化為患”,指出脾胃虛弱是導致機體運化失常、痰濕內生、心下痞滿不舒的主要因素。香砂六君子湯出自《古今名醫方論》,由人參、白術、茯苓、甘草、陳皮、半夏、砂仁、木香組成,全方以健脾補氣的四君子湯加理氣化痰藥物陳皮、半夏、砂仁、木香組成,促進脾胃運化,為健脾和胃經典方劑,治療脾胃虛弱型FD臨床效果顯著[2,5],但其具體作用機制尚不明確。網絡藥理學將藥物作用網絡與生物網絡相結合,從分子水平闡釋藥物與疾病的作用靶點與機制,能夠準確預測分析中藥復方的作用機制[6]。本研究借助網絡藥理學方法探究香砂六君子湯干預FD的作用靶點及機制,并通過動物實驗對核心靶點進行驗證。
1 材料與方法
1.1 網絡藥理學預測分析
1.1.1 藥物-成分-靶點-疾病網絡構建
通過TCMSP(https://old.tcmsp-e.com/tcmsp.php)對香砂六君子湯組方藥物人參、白術、茯苓、甘草、陳皮、半夏、木香、砂仁的化學成分進行查詢。以口服生物利用度(OB)≥30%且類藥性(DL)≥0.18為條件[7],篩選出藥物有效成分及相應靶點,并通過UniProt數據庫獲取靶點蛋白的基因名稱。通過GeneCards數據庫(https://auth.lifemapsc.com),以“functional dyspepsia”為檢索詞,檢索FD的基因靶點。將藥物靶點與FD基因靶點取交集,篩選出藥物與疾病的共同靶點,并通過Cytoscape3.7.1軟件構建藥物-成分-靶點-疾病網絡。
1.1.2 蛋白相互作用網絡構建
將藥物與疾病共同靶點輸入STRING數據庫(https://www.string-db.org),類型選擇“homo sapiens”(人類)并設置最小關系值≥0.95,刪除無連接節點,構建蛋白相互作用(PPI)網絡。運用Cytoscape3.7.1軟件進行拓撲分析,找出Betweenness、Closeness、Degree、Information、LAC、Network值均大于其平均值的靶點,并根據Degree值大小篩選出核心靶點。
1.1.3 GO及KEGG通路富集分析
將藥物與疾病共同靶點導入Metascape數據庫(https://metascape.org/gp/index),物種設置為“Homo sapiens”,進行GO及KEGG通路富集分析。
1.2 實驗驗證
1.2.1 藥物
參考《方劑學》[8],香砂六君子湯由人參(生曬參)10 g、麩炒白術9 g、茯苓9 g、陳皮9 g、法半夏12 g、砂仁6 g、木香6 g、炙甘草6 g組成。飲片購自甘肅中醫藥大學附屬醫院中藥房,并經甘肅中醫藥大學楊扶德教授鑒定符合2020年版《中華人民共和國藥典》規定。飲片常規浸泡2 h,煎煮2次,每次40 min,所得藥液濃縮至每毫升含原藥材1 g,冷卻后置4 ℃冰箱保存。色甘酸鈉(美國APRxBIO公司,批號B330021337769),用蒸餾水配制成7.2 mg/mL溶液。
1.2.2 動物
SPF級SD孕鼠15只,通過觀察幼鼠行為活動及性別,篩選出60只健康幼年雄鼠用于實驗,甘肅中醫藥大學醫學實驗中心提供,動物許可證號SYXK(甘)2020-0001。大鼠飼養于SPF環境中,每12 h進行一次標準嚙齒動物食物、水和明暗循環,相對濕度45%~55%,室溫(23±2)℃。本實驗經甘肅中醫藥大學動物倫理委員會審查批準(2021-204)。
1.2.3 主要試劑與儀器
大鼠白細胞介素-6(IL-6)、腫瘤壞死因子-α(TNF-α)、白細胞介素-1β(IL-1β)ELISA試劑盒,江蘇菲亞生物科技有限公司,批號分別為2203R18、2203R30、2203R16;內參GAPDH、二抗IgG,北京ImmunoWay公司,批號分別為YM3215、RS002;p-ERK一抗,美國GeneTex公司,批號GTX24819;p-P38MAPK一抗,武漢塞維爾生物科技有限公司,批號AC220406032;p-NF-κBp65一抗,上海ABmart公司,批號TP56372M;RIPA裂解液、SDS-PAGE蛋白上樣緩沖液,北京索萊寶科技有限公司,批號分別為R0010、P1200。
5910R型冷凍型高速離心機,德國Eppendorf公司;美谷SpectraMax i3X酶標儀、VE-180型垂直板電泳裝置,美國BIO-RAD公司;DYY-6C型電泳儀,北京六一生物有限公司;GeLView 6000puls凝膠成像系統,廣東博鷺騰生物科技有限公司。
1.2.4 造模、分組、給藥及取材
將60只SPF級SD大鼠隨機抽出10只為空白組,10日齡起灌胃2%蔗糖溶液0.2 mL,每日1次,連續1周,正常飼養至6周齡。其余大鼠采用綜合法建立脾胃虛弱型FD大鼠模型[9]:10日齡起灌胃含有0.1%碘乙酰胺的2%蔗糖溶液0.2 mL,每日1次,連續6 d。將大鼠正常飼養到6周齡后,造模大鼠每日游泳至力竭,連續2周,同時隔日禁食。以體質量、進食量下降及胃排空時間長、推進率下降為造模成功標準。
將成模大鼠隨機分為模型組、色甘酸鈉組及香砂六君子湯高、中、低劑量組(高、中、低劑量組),每組10只。按人與動物體型系數折算[10],色甘酸鈉組大鼠予72 mg/(kg·d)色甘酸鈉溶液灌胃,高、中、低劑量組大鼠分別予12、6、3 g/(kg·d)香砂六君子湯藥液灌胃,給藥體積均為10 mL/kg,連續2周。空白組與模型組予等體積生理鹽水灌胃。飼養過程中記錄大鼠體質量及3 h進食量變化。給藥結束后,禁食24 h,測算大鼠胃排空率及腸推進率,剪取胃、十二指腸組織,生理鹽水沖洗,一部分以多聚甲醛固定,另一部分于-80 ℃凍存。
1.2.5 胃排空率及腸推進率測定
大鼠禁食24 h后灌服含炭粉的半固體營養糊2 mL,30 min后以3%戊巴比妥鈉5 mL/kg腹腔注射麻醉,取出全胃,稱重,沿胃大彎剪開,生理鹽水充分沖洗清潔后稱量胃凈重,計算胃排空率。胃排空率(%)=[1-(胃總重-胃凈重)÷所給糊重]×100%。以幽門為起點測量黑色糊狀物推進距離(L)及小腸全長(S),計算腸推進率。腸推進率(%)=L÷S×100%。
1.2.6 胃腸組織HE染色
取多聚甲醛固定的胃、十二指腸組織,石蠟包埋,切片,蘇木素-伊紅染色,鏡下觀察組織形態結構。
1.2.7 ELISA檢測十二指腸炎癥因子含量
將十二指腸組織制備為10%組織勻漿,按ELISA試劑盒說明書操作,計算各組大鼠十二指腸組織IL-6、TNF-α、IL-1β含量。
1.2.8 蛋白印跡法檢測十二指腸關鍵通路蛋白表達水平
取大鼠十二指腸組織,提取蛋白,蛋白定量后上樣,電泳轉膜,室溫封閉2 h,加入一抗p-ERK(1∶1 000)、p-P38MAPK(1∶500)、p-NF-κBp65(1∶1 000),4 ℃孵育過夜,再加入二抗,室溫搖勻2 h,暗室曝光,以GAPDH為內參,分析蛋白相對表達量。
1.2.9 統計學方法
2 結果
2.1 藥物-成分-靶點-疾病網絡
經數據庫檢索并篩選后得到香砂六君子湯有效成分159個,對應2 472個靶點,去重后得到230個靶點;FD疾病靶點1 857個。將藥物靶點與疾病靶點取交集后得到共同靶點151個。藥物-成分-靶點-疾病網絡見圖1。
圖1 香砂六君子湯治療FD藥物-成分-靶點-疾病網絡
2.2 蛋白相互作用網絡
將藥物與疾病共同靶點基因輸入STRING數據庫生成PPI網絡(見圖2),并通過Cytoscape3.7.1軟件進行拓撲分析。其中Degree值較高的基因有MAPK1、MAPK14、JUN、IL-6等,見圖3。
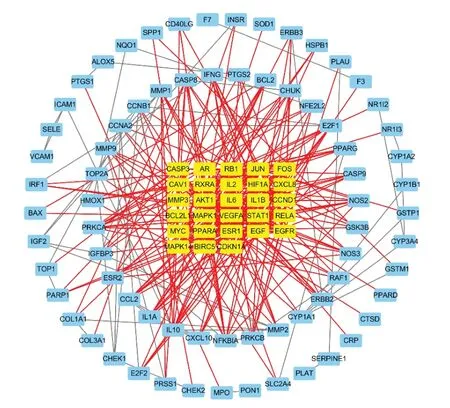
圖2 香砂六君子湯治療FD靶點PPI網絡
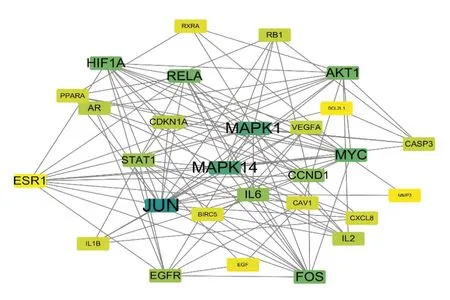
圖3 香砂六君子湯治療FD靶點PPI網絡核心靶點
2.3 GO和KEGG通路富集分析結果
對151個共同靶點進行GO富集分析,得到2 198個條目,其中生物過程(BP)1 689條,細胞組成(CC)97條,分子功能(MF)145條,各前10個條目見圖4。KEGG通路富集分析得到203條相關通路,前30條通路見圖5。BP主要富集在對UV-A的反應、對活性氧的反應、細胞對鎘離子的反應、對脂多糖的反應、對無機物的反應、細胞對脂質的反應、對細菌源性分子的反應等;CC主要富集在蛋白酶抑制劑復合物、絲氨酸蛋白酶抑制劑復合物、肽酶抑制劑復合物等;MF主要富集在氧化還原酶活性、離子通道調節活性、裂解酶活性、外源性蛋白結合DNA結合轉錄抑制活性等。KEGG通路主要富集在癌癥相關通路、脂質與動脈粥樣硬化、AGE-RAGE信號通路、MAPK信號通路、TNF信號通路、IL-17信號通路等。
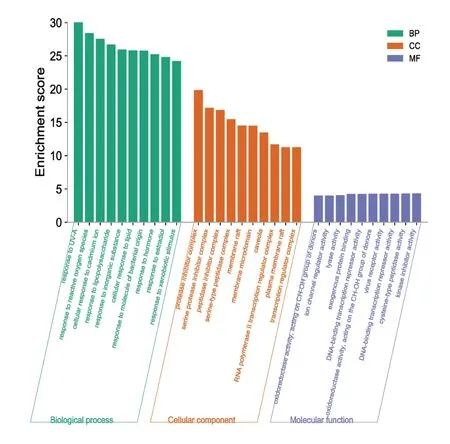
圖4 香砂六君子湯治療FD靶點GO富集分析

圖5 香砂六君子湯治療FD靶點KEGG富集分析
2.4 香砂六君子湯對模型大鼠體質量、進食量的影響
與空白比較,模型組大鼠體質量增長緩慢,進食量明顯減少(P<0.01);與模型組比較,高、中劑量組及色甘酸鈉組大鼠體質量和進食量均有所上升(P<0.05,P<0.01)。見圖6、圖7。
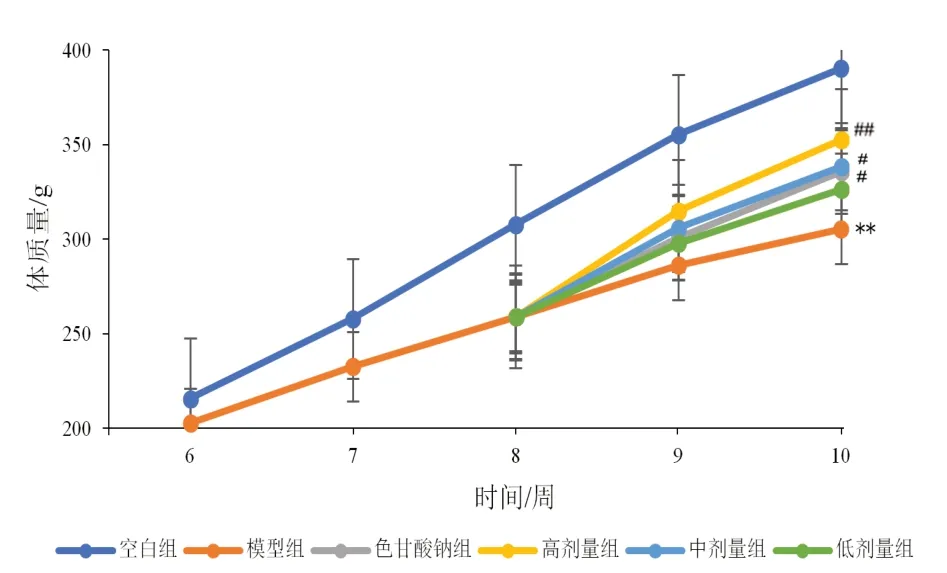
圖6 各組大鼠不同時點體質量比較(±s,每組10只)
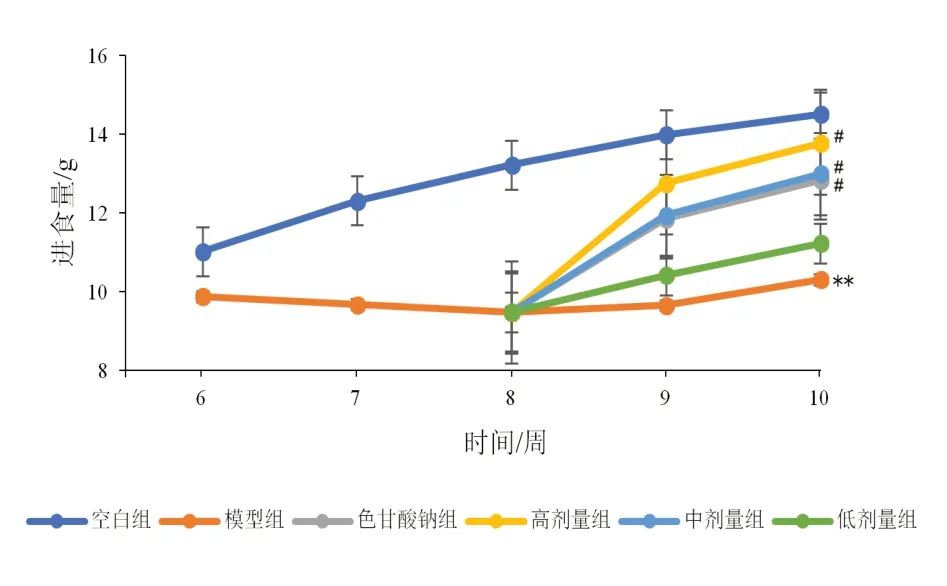
圖7 各組大鼠3 h進食量比較(±s,每組10只)
2.5 香砂六君子湯對模型大鼠胃排空率及腸推進率的影響
與空白組比較,模型組大鼠胃排空率及腸推進率顯著下降(P<0.01);與模型組比較,各給藥組大鼠胃排空率顯著升高(P<0.05,P<0.01),除低劑量組外,各給藥組大鼠腸推進率顯著升高(P<0.01)。見表1。
表1 各組大鼠胃排空率及腸推進率比較(±s,%)
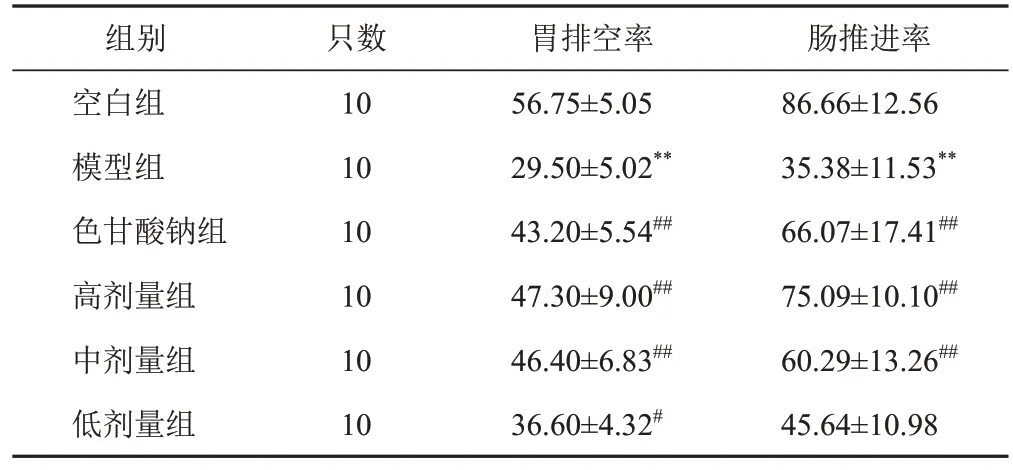
表1 各組大鼠胃排空率及腸推進率比較(±s,%)
注:與空白組比較,**P<0.01;與模型組比較,#P<0.05,##P<0.01
組別空白組模型組色甘酸鈉組高劑量組中劑量組低劑量組只數10 10 10 10 10 10胃排空率56.75±5.05 29.50±5.02**43.20±5.54##47.30±9.00##46.40±6.83##36.60±4.32#腸推進率86.66±12.56 35.38±11.53**66.07±17.41##75.09±10.10##60.29±13.26##45.64±10.98
2.6 香砂六君子湯對模型大鼠胃、腸組織病理形態的影響
空白組及模型組大鼠胃黏膜完整,黏膜上皮細胞及腺體排列規整,黏膜固有層未見炎細胞,黏膜無水腫、充血病理改變。空白組大鼠十二指腸黏膜完整,絨毛排列緊密,黏膜層無炎性浸潤;模型組大鼠十二指腸絨毛排列散亂,部分出現倒伏、脫落現象,且黏膜層出現腫脹,有炎性細胞浸潤;與模型組比較,各給藥組大鼠十二指腸絨毛排列緊密,倒伏、脫落現象減少,黏膜層炎性細胞浸潤出現不同程度改善,色甘酸鈉組及高劑量組最為明顯。見圖8、圖9。
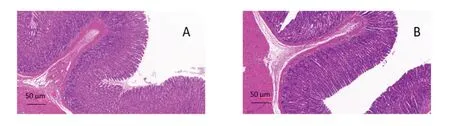
圖8 各組大鼠胃黏膜病理形態(HE染色)
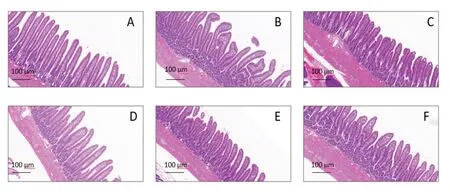
圖9 各組大鼠十二指腸黏膜病理形態(HE染色)
2.7 香砂六君子湯對模型大鼠十二指腸組織炎癥因子含量的影響
與空白組比較,模型組大鼠十二指腸組織IL-6、TNF-α、IL-1β含量明顯升高(P<0.01);與模型組比較,各給藥組大鼠十二指腸組織IL-6、TNF-α、IL-1β含量不同程度降低,色甘酸鈉組及高劑量組最為明顯(P<0.01)。見表2。
表2 各組大鼠十二指腸組織IL-6、TNF-α、IL-1β含量比較(±s)

表2 各組大鼠十二指腸組織IL-6、TNF-α、IL-1β含量比較(±s)
注:與空白組比較,**P<0.01;與模型組比較,#P<0.05,##P<0.01
組別空白組模型組色甘酸鈉組高劑量組中劑量組低劑量組只數10 10 10 10 10 10 IL-6/(pg/mL)17.90±2.17 66.15±9.47**34.66±2.41##25.12±1.55##42.91±0.89#53.75±8.18 TNF-α/(ng/mL)135.68±29.47 343.13±37.00**217.50±11.65##174.95±21.13##239.59±27.82##270.94±13.00 IL-1β/(pg/mL)7.47±1.49 22.73±2.14**11.00±1.32##8.77±1.65##16.20±1.99##18.95±1.95
2.8 香砂六君子湯對模型大鼠十二指腸關鍵通路蛋白表達的影響
與空白組比較,模型組大鼠十二指腸組織p-ERK、p-P38MAPK、p-NF-κBp65蛋白表達水平顯著升高(P<0.01);與模型組比較,各給藥組大鼠十二指腸組織p-ERK、p-P38MAPK、p-NF-κBp65蛋白表達水平不同程度降低,色甘酸鈉組及高劑量組最為顯著(P<0.05,P<0.01)。見圖10、表3。
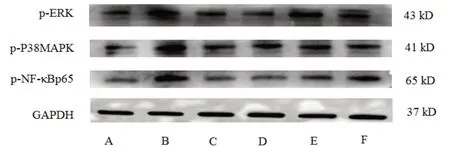
圖10 各組大鼠十二指腸組織p-ERK、p-P38MAPK、p-NF-κBp65蛋白表達免疫印跡
表3 各組大鼠十二指腸組織p-ERK、p-P38MAPK、p-NF-κBp65蛋白表達比較(±s,/GAPDH)
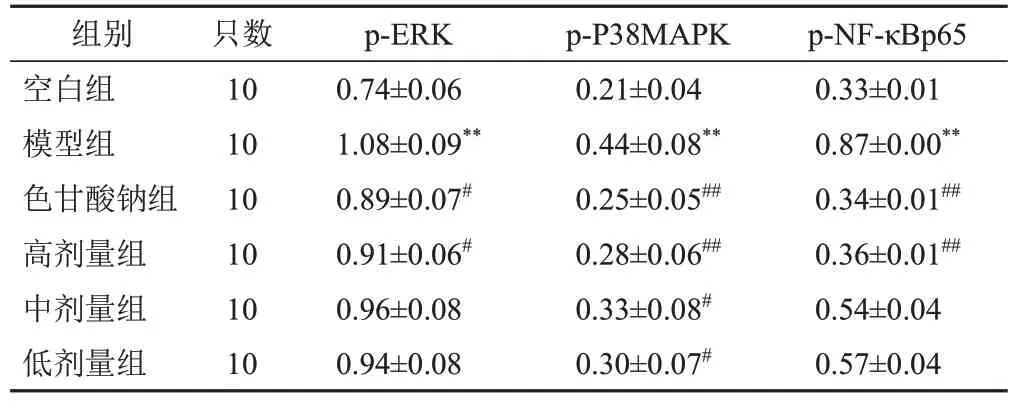
表3 各組大鼠十二指腸組織p-ERK、p-P38MAPK、p-NF-κBp65蛋白表達比較(±s,/GAPDH)
注:與空白組比較,**P<0.01;與模型組比較,#P<0.05,##P<0.01
組別空白組模型組色甘酸鈉組高劑量組中劑量組低劑量組只數10 10 10 10 10 10 p-ERK 0.74±0.06 1.08±0.09**0.89±0.07#0.91±0.06#0.96±0.08 0.94±0.08 p-P38MAPK 0.21±0.04 0.44±0.08**0.25±0.05##0.28±0.06##0.33±0.08#0.30±0.07#p-NF-κBp65 0.33±0.01 0.87±0.00**0.34±0.01##0.36±0.01##0.54±0.04 0.57±0.04
3 討論
網絡藥理學預測表明,香砂六君子湯治療FD相關靶點共151個,PPI網絡分析顯示關鍵靶點為MAPK1、MAPK14、JUN、IL-6等。KEGG通路富集分析得到203條相關通路,主要富集在癌癥相關通路、脂質和動脈粥樣硬化相關通路、AGE-RAGE信號通路、MAPK信號通路、TNF信號通路、IL-17信號通路等,其中MAPK1、MAPK14、IL-6等 靶 點 及AGE-RAGE、MAPK、TNF、IL-17等通路均與炎癥密切相關。動物實驗結果顯示,FD模型大鼠胃組織無明顯炎性浸潤,而十二指腸組織炎性浸潤明顯,表明十二指腸低度炎癥是FD的重要因素。研究表明,十二指腸低度炎癥為FD的始動因素,可以影響十二指腸-胃反饋,從而導致早飽感、腹脹等癥狀的出現[11]。
十二指腸黏膜內低度炎癥主要表現為T細胞、肥大細胞和嗜酸性粒細胞數量增加[12],其中肥大細胞是重要的免疫細胞之一,廣泛分布于機體各個部位,與多種慢性疾病、炎性疾病、自身免疫性疾病有關[13]。在十二指腸黏膜中,肥大細胞釋放的介質可以影響上皮的完整性,刺激先天和適應性免疫反應[14-15],產生局部甚至全身炎癥,進而促進胃腸道FD臨床癥狀的產生。因此,本實驗使用肥大細胞穩定劑色甘酸鈉作為阻斷劑抑制肥大細胞脫顆粒。
動物實驗結果顯示,香砂六君子湯可以改善FD大鼠十二指腸絨毛散亂及炎性浸潤,下調十二指腸組織IL-6、TNF-α、IL-1β含量及p-ERK、p-NF-κBp65、p-P38MAPK表達水平,提示香砂六君子湯能減輕十二指腸低度炎癥,其機制可能與下調p-ERK、p-P38MAPK及下游p-NF-κBp65水平有關。IL-6、TNF-α、IL-1β為促炎細胞因子,由單核細胞、肥大細胞及巨噬細胞分泌,可以參與細胞免疫且與炎癥的發生發展密切相關。研究表明,IL-6可介導NF-κB、MAPK等多種炎性通路,引起自身免疫疾病[16]。TNF-α、IL-1β屬于早期反應細胞因子,在細胞受到刺激后立即分泌從而破壞促炎-抗炎平衡,進一步刺激IL-6、IL-2等炎性因子活化,從而形成炎性反應[17]。TNF-α、IL-1β可通過調節胃酸分泌從而調節FD[18-20]。
絲裂原活化蛋白激酶(MAPK)是一種絲氨酸-蘇氨酸蛋白激酶,參與調節細胞的生長、分化及炎癥反應等多種生理病理過程,其與炎性介質的調節關系密切。MAPK主要亞族由ERK、P38、JUK組成。其中MAPK1屬于ERK亞族,MAPK14屬于P38亞族。P38可以調節多種細胞因子、炎性介質的表達,在免疫應答中發揮主要作用。研究顯示,在多數炎癥性腸病中,P38及其磷酸化表達均有所升高,且抑制P38過度激活可改善腸道炎癥及上皮黏膜功能[21-22]。ERK同樣為免疫調節中的重要因子,Monick等[23]研究表明,抑制ERK活性可以負調節吞噬細胞,從而調節機體免疫。MAPK可激活下游NF-κB。NF-κB是一種誘導型轉錄因子,可誘導激活多種免疫調節蛋白、炎性細胞因子,從而導致炎癥[24-25]。有研究表明,調節NF-κB的轉錄可以調控FD大鼠十二指腸低度炎癥的發生[26-27]。
綜上所述,本研究采用網絡藥理學方法從分子水平預測分析香砂六君子湯干預FD的作用機制,發現其多與免疫相關。通過動物實驗發現,FD大鼠胃組織無明顯炎性浸潤而十二指腸炎性浸潤明顯,提示香砂六君子湯干預FD的作用機制與十二指腸低度炎癥密切相關。核心靶點驗證結果表明,香砂六君子湯可能通過下調p-ERK、p-P38MAPK及下游p-NF-κBp65的水平調控十二指腸低度炎癥,改善FD癥狀。

