基于脂代謝和炎癥反應探討兩種濕熱證痛風性關節炎大鼠模型的構建
甘 斌李華南李 松章曉云陳 宇顧 兵張云開劉永乾邵子晨
(1.江西中醫藥大學臨床醫學院,南昌 330004;2.江西中醫藥大學附屬醫院,南昌 330006;3.江西科技師范大學生命科學學院,南昌 330013)
痛風性關節炎(gouty arthritis,GA)是最常見的由晶體誘發的自身炎癥性疾病之一,其特征是單鈉尿酸鹽(monosodium urate,MSU)晶體沉積于關節和(或)非關節結構中誘發[1]。全球患病率在1%~4%之間[2]。隨著國民經濟提高和飲食習慣的改變,我國GA的患病率呈顯著上升趨勢,患病率數據顯示已達1136.24/100 000[3],且愈趨于年輕化[4]。一般來說,根據機體對MSU晶體炎癥反應的臨床表現可分為四期[5]:持續性高尿酸血癥期、劇烈疼痛的急性炎癥性關節炎期(GA發作期)、無痛無癥狀期(臨界期)以及MSU晶體引起的持續性炎癥期(慢性GA)和痛風石(Tophi)期,其中GA發作期在臨床中最為常見[6]。
古代醫學認為病之總者為病,而一病總有數證。94版《中醫病癥診斷療效標準》[7]根據GA階段性本質的癥狀集合將其概括為四證:濕熱蘊結證、痰濁阻滯證、瘀熱阻滯證、肝腎陰虛證。本課題組臨床觀察發現濕熱證GA占比73.14%[8],這可能與江西人體質多屬濕熱質相關。江西省位于北回歸線附近,屬長江中下游地區,地形南高北低,雨量偏多,日照充足,為亞熱帶濕潤氣候;此外江西人飲食重油重辣,多食油脂等厚味之品,長此已久,故江西人體質偏濕熱質。既往濕熱內傷伏邪理論在臨床學術研究中占首要,余邪伏于里遇誘因(外邪)而發-外邪入里、內濕為合,這也是濕熱證最基礎的病機[9]。
目前西醫臨床一線治療急性期GA主要口服皮質內固醇、非甾體抗炎藥或秋水仙堿等對癥治療[5],這些藥物可迅速控制疼痛并抑制炎癥,但使用時普遍受腎功能不全和心血管等諸多合并癥的限制[10],此外還存在胃腸道和腎毒性等副作用。中藥自古以來就用于GA治療[11],從單味中藥或中藥組方中分離出的部分化學成分具有多靶點、低毒等特點,在GA防治中展示出良好前景[12]。動物模型是開展藥物研究的重要載體,將“病”和“證”相結合構建接近人體濕熱證GA(急性發作期GA)病證結合動物模型更是深入研究濕熱證參與GA急性發作的病理生理機制及中藥藥效評價的基礎[13]。盡管單獨的“濕熱證”模型和“GA”模型造模方式繁多,但尚無公認合理成熟的濕熱證GA病證結合動物模型造模方法。基于此,本實驗以雄性SD大鼠為造模對象,從脂代謝和炎癥反應出發探討兩種不同濕熱證GA病證結合模型造模差異,以期為篩選穩定且具備可重復性的濕熱證GA病證結合大鼠模型提供客觀數據支持。
1 材料和方法
1.1 實驗動物
SPF級健康雄性SD大鼠44只,6周齡,體重180~200 g,由江西中醫藥大學實驗動物科學技術中心提供[SCXK(贛)2018-0001],飼養于江西中醫藥大學實驗動物科學技術中心[SYXK(贛)2017-0004]。實驗過程通過了江西中醫藥大學實驗動物倫理委員會審查(JZSYDWLL-20200901),并嚴格遵循實驗動物3R原則。于江西中醫藥大學動物中心無特定病原體級屏障系統內采用晝夜間斷12 h/12 h照明方式飼養,溫度(23±2)℃,相對濕度(55±3)%。所有大鼠均由江西中醫藥大學實驗動物科學技術中心的工作人員檢疫并適應性飼養1周后開始造模。適應性飼養期間大鼠自由飲水、進食,同時每3 d更換高溫滅菌后的玉米芯墊料。
1.2 主要試劑與儀器
正常普通基礎飼料:成分為玉米30%,小麥25.5%,豆粕20%,酪蛋白10%,魚粉5%,蜜糖酵母2.5%,油2.5%,磷酸氫鈣2%,生長預混料1%,石粉1%,食鹽0.3%,氯化膽堿0.2%;高脂高糖飼料:在上述正常普通基礎飼料基礎上添加糖、黃油和魚粉,具體成分為58.9%普通基礎飼料、黃油15%,綿糖15%、蛋黃粉5%,魚粉5%,膽固醇1%,豬膽鹽0.1%。
TG、TC、LDL-C、HDL-C(批號分別為:20210118、20210115、20210118、20210304,南京建成生物工程研究所);NF-κB、IL-1β、TNF-α、IL-6(批號分別為:YX-201406R、 YX-091203R、 YX-201407R、 YX-091206R,上海赫澎生物科技有限公司);紅星二鍋頭白酒(批號:20160424,北京紅星股份有限公司);冠生園蜂蜜(批號:GB14963,上海冠生園蜂制品有限公司);鼠傷寒沙門菌(批號:ATCC14028,美國菌株保藏中心);戊巴比妥鈉(批號:SIGMA-P3761,美國Sigma-Aldrich公司)。
人工氣候箱(批號:MGC-350-HP-2,上海一恒科學儀器有限公司);全波長多功能酶標儀(批號:3001-1950,美國Thermo公司);高速冷凍離心機(批號:C2500-RC,美國Labnet公司)。
1.3 實驗方法
1.3.1 MSU混懸液的配置
向關節腔內注射MSU混懸液是濕熱證GA病證結合模型中“GA”模型誘導的關鍵。按照黃火高[14]的方法并結合MSU晶體在不同pH值環境下的形態改變[15]對其配制方法進行改良,具體步驟如下:將4.5 mL NaOH溶液(濃度:0.5 moL/L)加入400 mL超純水中,加入2 g尿酸,用磁力攪拌器緩慢加熱并不斷攪拌,直至尿酸完全溶解。隨后將溫度保持在60℃用1 moL/L的HCl溶液調pH=7.2,室溫冷卻后置于4℃冰箱過夜冷藏,隔日濾去上清,盛入蒸發皿中經水浴鍋干燥,干燥后用碾缽碾成細末并通過250 μm孔徑金屬網篩過篩,經高溫高壓滅菌后用無菌EP管收集。以無菌生理鹽水配成濃度20 mg/mL MSU混懸液,使用前置于高壓滅菌鍋內滅菌30 min,現配現用。
1.3.2 實驗分組及干預
健康SD雄性大鼠44只,經由江西中醫藥大學實驗動物科學技術中心的工作人員檢疫并適應性喂養1周后按隨機數字表法分為4組:正常對照組、GA對照組、模型組A、模型組B。除正常對照組和GA對照組10只外其余各組每組12只(根據預實驗中大鼠死亡率評估增加20%)。
正常對照組:在屏障實驗室恒溫恒濕環境內普通飼料喂養,自由飲水21 d。
GA對照組:喂飼方式同正常對照組,第18天以大鼠踝關節外側兩骨突出為注射定位點,將抽取了MSU混懸液注射器配6號注射器針頭,針頭斜面朝關節腔沿脛骨前肌內側向下插至關節腔,有落空感時停止進針且回抽無血后注入50 μL MSU溶液(濃度:20 mg/mL)以對側關節囊鼓起為注入標準,誘導GA模型。
模型組A:第一階段即高脂高糖和高溫高濕階段制備濕熱證模型,給大鼠飼以高脂高糖飲食,并在高脂高糖飼料喂養的基礎上,用200 g/L蜂蜜水自由飲用,且白酒1 mL/100 g和豬脂1.5 mL/100 g交替灌服,共持續14 d。從第8天開始每日上午8:00放入人工氣候箱中,溫度為(32±2)℃,相對濕度95%,8 h,共持續14 d;第二階段制備GA“病”模型,在第18天造模同GA對照組。通過上述復合多因素造模方式制備濕熱證GA病癥結合大鼠模型。
模型組B:第一階段即高脂高糖階段聯合生物因素干預制備濕熱證模型,給大鼠飼以高脂高糖飲食,并在高脂高糖飼料喂養的基礎上,加用200 g/L蜂蜜水自由飲用,且白酒1 mL/100 g和豬脂1.5 mL/100 g交替灌服,共持續14 d。于第10天灌服鼠傷寒沙門氏菌液(10 mL/kg,每毫升109個),第15天加強一次(5 mL/kg);第二階段制備GA“病”模型,在第18天造模同GA對照組。通過上述復合多因素造模方式制備濕熱證GA病癥結合大鼠模型。
1.3.3 觀測指標
(1)一般情況觀測及統計造模后各組死亡率
確定以第1、8、15、21天同一時刻對大鼠表征進行觀察,包括:①精神狀態;②飲食飲水;③毛色;④大小便等情況;最后造模結束統計大鼠死亡率。
(2)踝關節腫脹的測定
周長法:使用縛線測量注射MSU混懸液前0 h及造模后4、8、12、24、48及72 h后大鼠踝關節劃線部位的周長。以造模前后周長的差值作為腫脹度變化,即腫脹度=造模后周長-造模前周長。
(3)大鼠步態分析
①步態改變分級:在造模后,請1名骨科醫生(不知分組情況)觀察大鼠步態的改變并按步態分級標準計分:正常步態為0級;輕度跛行,右足稍呈彎曲態行走為1級;中度跛行,右足彎曲明顯,輕挨地面行走為2級;重度跛行,右足脫離接觸面甚至三足步態行走為3級。
②炎癥指數評分標準:正常為0級,記作1分;關節皮膚出現紅斑,輕度腫脹,骨性標志可見為Ⅰ級,記作2分;腫脹皮膚出現褶皺,骨性標志消失,但腫脹未跨出關節部位為Ⅱ級,記作3分;關節皮膚呈暗紅且關節以外肢體也出現腫脹為Ⅲ級,記作4分。
(4)血清制備,脂代謝指標和炎癥因子檢測
造模后第21天,各組大鼠禁食不禁水12 h,3%戊巴比妥鈉腹腔注射麻醉后腹主動脈采血,將采血管略傾斜靜置2 h,3000 r/min × 15 min離心,收集上層血清于-80℃中保存。嚴格按照ELISA試劑盒檢測血清TG、TC、HDL-C、LDL-C、IL-1β、IL-6、TNFα、NF-κB的表達情況。
1.4 統計學方法
采用SPSS 26.0軟件對數據進行分析,采用平均數±標準差(±s)表示,運用單因素方差分析對各組間統計數據進行比較。組間多重比較,若滿足方差齊性采用LSD法檢驗,反之則采用Dunnett’sT3檢驗;以α=0.05為檢驗水準,P<0.05表示具有統計學意義,P<0.01表示具有極顯著統計學差異。采用Graphpad Prism 8.0.2軟件繪圖。
2 結果
2.1 各組大鼠一般情況觀察
正常對照組:喂養期間精神狀態好,活動正常,毛色柔順亮澤,雙目炯炯有神,體重增加平穩,飲食、大小便均正常;GA對照組:由于前期未參與高糖高脂飼料和濕熱證階段造模,故表征均正常,注射MSU后首先出現煩躁不安并用舌頭舔舐右足,右后肢彎曲明顯,輕挨地面行走甚至抬離地面,隨后精神萎靡,蜷縮在角落;模型組A和模型組B:大鼠逐漸出現活動力減弱,毛發粗糙疏松、毛色暗淡,前7 d體重逐漸增加隨后增勢緩慢且飲食減少尤其在放入人工氣候箱后大部分出現精神倦怠、嗜睡,毛發枯槁潮濕掉毛,體重及飲食均減少,大便較正常組量少甚至不成型、溏便。在第18天注射MSU后合并GA對照組造模癥狀。與模型組A相比,模型組B大鼠在灌服鼠傷寒沙門氏菌后大鼠體重不增反減,大便糞質稀溏味臭。
2.2 實驗大鼠死亡及其解剖分析
納入的44只大鼠,其中有4只(模型組A死亡1只,模型組B死亡3只)大鼠在造模過程中死亡,模型組A死亡率8.3%,模型組B死亡率25%。
2.3 各組大鼠踝關節腫脹度測定比較
由表1可見,組內比較:正常對照組在4 h腫脹程度達到高峰,隨后腫脹程度逐漸回落,到72 h基本恢復,可能是由于注射生理鹽水引起的非病理性腫脹,后期生理鹽水被自體吸收。GA對照組、模型組A和模型組B在4、8、12 h腫脹程度逐漸增大,并于12 h達到高峰,隨后腫脹程度逐漸回落。組間比較:與正常對照組比較,造模后4、8、12、24、48、72 h,GA對照組、模型組A和模型組B的踝關節腫脹明顯增大(P<0.01)。這與前人研究相一致[16-17],提示造模成功。模型組A在不同時間點與模型組B比較均不具備統計學意義(P>0.05)。
表1 各組大鼠不同時間點踝關節周長法腫脹度測量變化(±s,mm)Table 1 Measure the changes of ankle joint swelling degree at different time points in each group of rats based on the circumference method

表1 各組大鼠不同時間點踝關節周長法腫脹度測量變化(±s,mm)Table 1 Measure the changes of ankle joint swelling degree at different time points in each group of rats based on the circumference method
注:與正常對照組相比, *P<0.05, **P<0.01;與GA對照組相比, #P<0.05。Note. Compared with the control group, *P<0.05, **P<0.01. Compared with the GA group, #P<0.05.
組別Groups n 4 h 8 h 12 h 24 h 48 h 72 h正常對照組Control group 10 0.24±0.06 0.16±0.03 0.09±0.04 0.08±0.03 0.10±0.03 0.07±0.02 GA對照組GA group 10 2.38±0.35** 3.47±0.88** 4.47±0.98** 3.89±0.62** 3.07±0.54** 1.96±0.43**模型組A Model group A 11 2.28±0.30** 3.48±0.55** 4.88±1.07** 4.28±0.88** 3.38±0.67* 2.89±0.49**#模型組B Model group B 9 2.22±0.41** 3.52±0.35** 5.22±0.64** 4.97±0.57**# 3.66±0.65** 2.74±0.62**#
2.4 各組大鼠步態分級和炎癥指數評分比較
由表2可見GA對照組、模型組A和模型組B大鼠步態等級大部分被評為Ⅲ級。由圖1可見,與正常對照組比較,GA對照組、模型組A和模型組B炎癥指數存在顯著差異性(P<0.01),說明“GA”病模型復制成功。且進一步說明大鼠步態分級和炎癥指數的改變主要與MSU注射后引發右踝關節的炎癥改變相關。

圖1 各組大鼠注射MSU混懸液后關節炎癥指數評分柱狀圖Figure 1 The score of ankle joint inflammation index in each group after inject MSU suspension
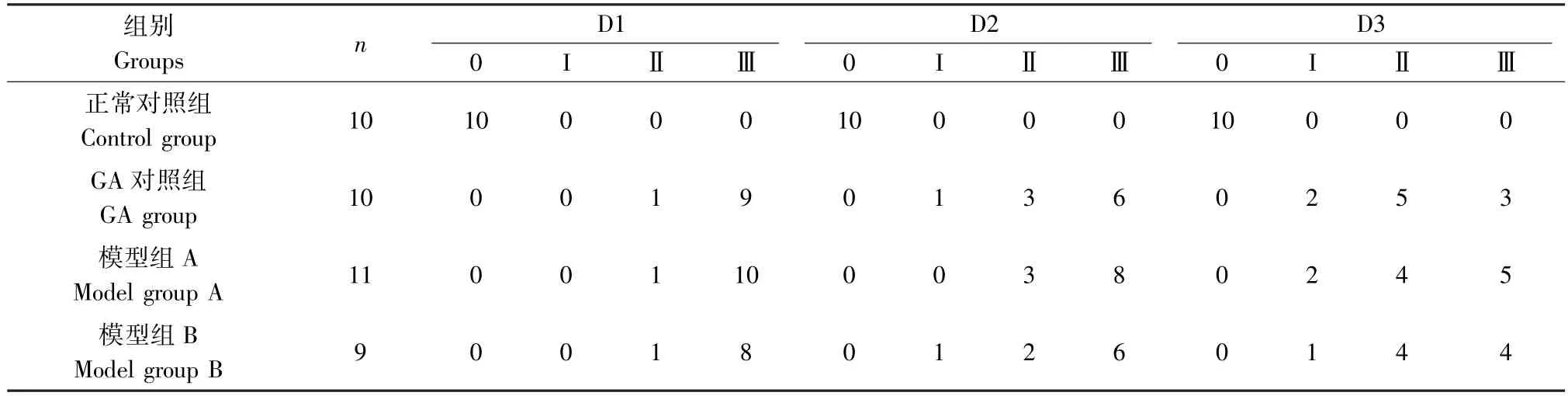
表2 注射MSU混懸液后各組大鼠踝關節步態分級情況Table 2 Ankle gait classification of rats in each group after inject MSU suspension
2.5 各組大鼠脂代謝指標表達比較
由表3可知,模型組A和模型組B的TG、TC和LDL-C均高于正常對照組和GA對照組,HDL-C則顯著低于正常對照組和GA對照組,差異有統計學意義(P<0.05)。與模型組A相比,模型組B的TG和HDL-C趨勢有所升高,TC和LDL-C趨勢降低,但差異無統計學意義(P>0.05)。
表3 各組大鼠血脂代謝改變情況(±s,mmol/L)Table 3 Changes of blood lipid metabolism in rats in each group
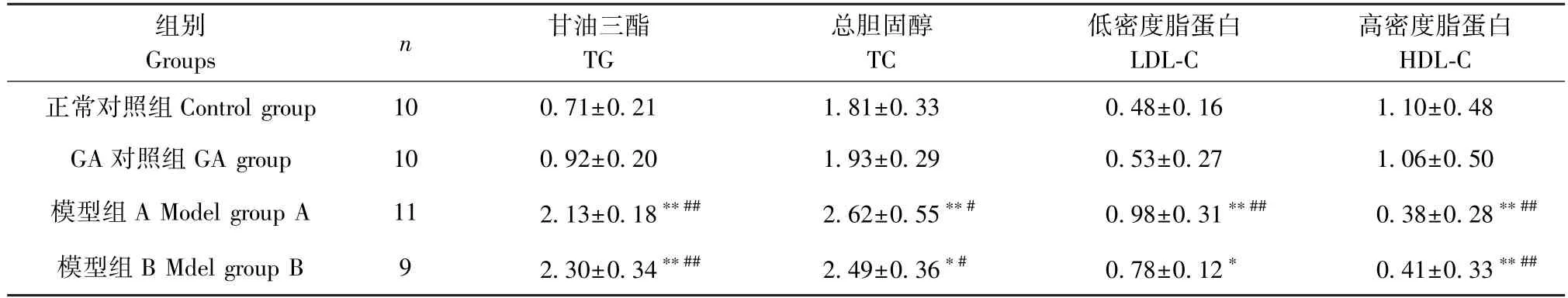
表3 各組大鼠血脂代謝改變情況(±s,mmol/L)Table 3 Changes of blood lipid metabolism in rats in each group
注:與正常對照組相比, *P<0.05, **P<0.01;與GA對照組相比, #P<0.05, ##P<0.01。Note. Compared with the control group, *P<0.05, **P<0.01. Compared with the GA group, #P<0.05, ##P<0.01.
組別Groups n 甘油三酯TG總膽固醇TC低密度脂蛋白LDL-C高密度脂蛋白HDL-C正常對照組Control group 10 0.71±0.21 1.81±0.33 0.48±0.16 1.10±0.48 GA對照組GA group 10 0.92±0.20 1.93±0.29 0.53±0.27 1.06±0.50模型組A Model group A 11 2.13±0.18**## 2.62±0.55**# 0.98±0.31**## 0.38±0.28**##模型組B Mdel group B 9 2.30±0.34**## 2.49±0.36*# 0.78±0.12* 0.41±0.33**##
2.6 各組大鼠免疫炎癥因子表達比較
由表4可知,與正常對照組相比,GA對照組、模型組A和模型組B的NF-κB、IL-1β、IL-6和TNFα水平均顯著升高(P<0.01),這提示模型復制成功。與GA對照組相比,模型組A的NF-κB和TNFα水平有所升高(P<0.05),模型組B的NF-κB、IL-1β、IL-6和TNF-α水平有所升高(P<0.05),這提示兩種病證結合模型造模方式或可刺激機體產生慢性炎癥反應。與模型組A相比,模型組B的IL-1β、IL-6和TNF-α水平有所升高(P<0.05),這或許可以作為兩種病證結合模型炎癥反應量化指標。
表4 各組大鼠NF-κB、IL-1β、IL-6和TNF-α改變情況(±s,pg/mL)Table 4 The level of NF-κB, IL-1β, IL-6, TNF-α in rats of each group

表4 各組大鼠NF-κB、IL-1β、IL-6和TNF-α改變情況(±s,pg/mL)Table 4 The level of NF-κB, IL-1β, IL-6, TNF-α in rats of each group
注:與正常對照組相比, *P<0.05, **P<0.01;與GA對照組相比, #P<0.05, ##P<0.01;與模型組A相比, aP<0.05, aaP<0.01Note. Compared with the control group, *P<0.05, **P<0.01. Compared with the GA group, #P<0.05, ##P<0.01. Compared with the model group A, aP<0.05, aaP<0.01.
組別Groups n 核因子-κB NF-κB白細胞介素 1β IL-1β白細胞介素-6 IL-6腫瘤壞死因子-α TNF-α正常對照組Control group 10 391.69±22.99 46.13±10.68 32.76±5.81 4.86±1.26 GA對照組GA group 10 680.10±29.07** 361.50±8.58** 143.1±10.67** 58.81±6.53**模型組A Model group A 11 738.74±49.33**# 366.70±12.48** 146.5±11.09** 64.78±5.93**#模型組B Model group B 9 741.15±52.59**# 430.00±12.50**##aa 168.9±6.61**##aa 71.26±4.44**##a
3 討論
《素問·至真要大論篇》指出:“諸濕腫滿,皆屬于脾”[18];《素問·陰陽應象大論篇》指出:“中央生濕……其藏為脾”[18],可見脾與濕密切相關;清代薛生白言“濕熱乃陽明太陰同病也”,以上均說明濕熱證病位多責之于脾胃[19]。濕熱證病程多纏綿反復,系飲食內傷致脾失健運,水液運化機能失職,導致水液留滯、內濕內生,復感外邪,內外相引,故病濕熱[20]。這也和《素問·奇病論篇》中:“甘者,肥美之所發”,指出甘為濕之應,常食膏粱厚味,易生濕蘊熱,病因病機相吻合。總結以上對濕熱證病因病機的論述,在本實驗中模型組A和模型組B均通過自由飲用蜂蜜水,豬脂、白酒隔日灌服14 d,以損其脾胃,復刻脾失健運,水液運化失職,導致內濕自生。模型組A給予高溫高濕外環境,模型組B通過外邪(鼠傷寒沙門氏菌)從口鼻而入,模擬中醫傳統病因,內外相引,故病濕熱。從癥狀表現來看,模型組A和模型組B大鼠均出現便溏的臨床表現,這提示脾胃運化機能障礙,升降失序,清濁不分。根據現有的模型評判標準,可認為模型組A和模型組B均復制身重困倦、腹脹納呆、便溏的濕熱證表現。
眾所周知,高尿酸血癥是GA最主要的危險因素,但臨床研究表明,許多高尿酸血癥患者不會發展為GA,也不會形成MSU晶體,甚至終身無癥狀。另有研究表明,約70% GA患者雖血尿酸值正常,但臨床卻表現出GA急性發作癥狀。這說明只有當關節內MSU晶體沉積并與中性粒細胞相作用時,才會導致以中性粒細胞為首的先天免疫系統被激活,進而引發GA發作[21-22]。臨床上GA起病急驟,發作時可導致患者關節紅腫、劇烈疼痛和運動障礙等癥狀,通常在7~10 d后緩解,患者自行恢復。此外本次實驗造模使用的大鼠為嚙齒類動物,與靈長類不同在于其自身存在可將尿酸代謝為尿囊素的尿酸酶[23],故非長期刺激,而只是一過性刺激難以建立以高尿酸血癥為基礎的GA動物模型[24]。MSU晶體作為誘發GA發作的關鍵物質,因此目前建立GA動物模型最經典方法便通過向關節腔內注射外源性MSU晶體。該造模方式不僅操作簡便、模型穩定而且與臨床GA患者急性發作癥狀相吻合。根據本實驗結果,注射MSU晶體混懸液2 h后模型逐漸形成,12h后模型效果達到峰值,此后即使不做干預,紅腫熱痛癥狀亦逐漸緩解。這提示本實驗GA模型復制與臨床GA急性發作相符合,這也提示臨床GA發作12 h內是治療的黃金時間可極大地緩解GA發作癥狀。
濕邪為有形之邪,血脂便是其生化物質基礎之一,脂代謝紊亂則表明脾失健運,導致運化水濕、分清泌濁的功能失職,為濕熱證的發展創造了內在條件[25]。呂文亮等[26]采用“人工氣候箱+肥甘飲食+鼠傷寒沙門菌”法建立濕熱證模型可引發血循環中LDL-C升高而HDL-C降低。李華鋒等[27]和闕鐵生等[28]采用“高脂飲食+高溫高濕+大腸埃希菌灌胃”法制備的溫病濕熱證中TC、TG、LDL-C水平顯著增加,HDL-C水平顯著減少。由此可見脂代謝紊亂是濕熱證特征之一。此外臨床橫斷面研究表明脂代謝異常是GA誘發因素之一[29]。本實驗中模型組A和模型組B的TG、TC和LDL-C水平顯著高于正常對照組和GA對照組,HDL-C水平則顯著低于正常對照組和GA對照組,說明兩種造模方式均發生脂代謝紊亂,大鼠出現濕熱證表現,且對GA發作有促進作用。
GA屬炎癥性疾病的一種,其最大特征是MSU晶體沉積誘發炎癥發作。先天免疫在GA發作的自我緩解機制中發揮重要作用,單核/巨噬細胞是先天免疫系統的重要細胞組分。MSU晶體作為一種“危險信號”因子,在GA發作的啟動、放大和維持中發揮重要作用,主要與IL-1β、IL-6和TNF-α等促炎因子相關[30]。這些促炎因子主要由于單核/巨噬細胞被MSU晶體誘導活化而產生。有生物活性的成熟IL-1β被當作GA發作的始動因子,其可通過活化IL-1受體通路刺激炎癥因子和趨化因子,募集大量中性粒細胞。TNF-α可激活中性粒細胞和淋巴細胞,從而促進其他細胞因子的合成和釋放,也可誘導細胞凋亡。此外TNF-α可刺激黏附因子的大量分泌,隨后黏附因子與白細胞共同作用損傷關節細胞和關節軟骨[31],這可能與GA患者劇烈疼痛相關。Liu等[32]發現MSU晶體刺激單核細胞,可刺激單核細胞分泌IL-1β和TNF-α,且呈時間依賴性。另有研究表明IL-6有助于誘發GA炎癥,是激活MSU介導的NLRP3炎性體激活所必需的炎癥因子[33]。患者IL-6表達檢測可反映GA病情發展變化[34]。徐曉辰等[35]探討GA患者不同時間點血清炎性因子的變化,結果表明IL-1β、IL-6及TNF-α在炎癥過程中可能存在共同作用。研究報道,30年前David Baltimore和Ranjan Sen發現一個在炎癥反應過程中的關鍵轉錄因子,即NF-κB,其含了一個二聚體轉錄因子家族,對炎癥反應的調控以及幾乎所有生物中細胞的增殖、生化和凋亡都至關重要[36]。MSU晶體、促炎因子(如:IL-1β、IL-6和TNF-α)和脂多糖等胞外刺激均可誘導NF-κBp65轉入細胞核,促進靶基因轉錄表達[37]。研究表明MSU晶體主要通過兩種途徑誘導NF-κB活化:(1)在大多數細胞中,其通常以p65/p50二聚體形式存在,p65主要承擔NF-κB轉錄活性。MSU晶體可能與toll樣受體2和toll樣受體4結合,導致NF-κBp65的核易位,最終誘導NF-κB活化。(2)MSU晶體可誘導由核苷酸結合寡聚化結構域、亮氨酸重復序列和熱蛋白結構域組成的NLRP3炎癥小體的活化,活化的NLRP3炎癥小體可激活效應蛋白胱冬肽酶-1,最終導致成熟IL-1β的產生[38]。成熟的IL-1β能夠通過IL-1受體通路誘導NF-κB的活化。以上諸多文獻均證明NF-κB、IL-1β、IL-6和TNF-α在GA發作中的重要作用,同時也有研究表明濕熱證與炎癥密切相關[39]。本實驗結果表明IL-6、IL-1β、TNF-α和NF-κB表達呈現模型組B>模型組A>GA對照組>正常對照組,說明模型組A、模型組B和GA對照組大鼠均表現出明顯炎癥反應。此外模型B炎癥因子IL-6、IL-1β和TNF-α表達高于模型組A,總體而言說明生物因子與單純濕熱環境相比,生物因子對于炎性因子的啟動可反應“熱”致病因子靶點所在。
綜上所述,本研究結果表明兩種造模方式均可誘導濕熱證“證”和GA“病”的臨床表現。從脂代謝和炎癥因子指標觀察二者既有共性也有各自特點,但毋庸置疑高脂高糖飲食是脂代謝紊亂的直接影響因素,且脂代謝可作為“濕”致病因子靶點,炎性因子可作為“熱”致病因子靶點。綜合比較生物因子對于大鼠炎癥影響更明顯,可作為濕熱證GA病證結合模型中“熱”靶點量化評價指標。將“病”和“證”相結合制備濕熱證痛風性關節炎病證結合模型可為探明中醫藥治療作用和機理研究提供可行的動物模型選擇。

