兩種造模方法建立小鼠先兆子癇模型比較研究
許佳歡別亞男陳千晴陳柏羽歐寶芳謝水林吳少瑜*
(1.南方醫科大學藥學院,廣州 510515;2.廣東藥科大學生命科學與生物制藥學院,廣州 511436;3.華南理工大學生物科學與工程學院,廣州 510006)
先兆子癇(pre-eclampsia,PE)是一種累及多器官的妊娠相關疾病,其發病機制是不同程度的胎盤灌注不良引起可溶性因子釋放,導致母體血管內皮損傷,從而致使高血壓和多器官功能障礙[1-2]。PE引起的胎盤損傷可導致胎兒生長受限、流產以及死胎死產。PE是孕產婦圍產期死亡主要原因之一。2019年全球疾病負擔報告顯示,每年約有1800萬婦女患有妊娠高血壓疾病,約27 800名孕產婦死亡[3]。在過去的二十年中,先兆子癇的預防治療取得了重大進展,主要包括孕前咨詢、圍產期血壓控制和并發癥管理、胎兒及時分娩和產后監測等[4]。但除分娩外,沒有其他更有效的靶向性治療方案,目前也缺乏特效藥物延緩疾病進展。因此,建立PE動物模型,對揭示其相關分子機制和探索有效的靶向治療方案提供理論和實驗依據。
小鼠模型因與人類的高度同源性以及相似的循環系統,在PE研究中被廣泛使用和接受[5]。模擬小鼠PE樣癥狀的方法包括手術操作、近交系交配、外源性藥物誘導以及構建轉基因動物模型等[6]。其中外源性藥物主要是通過干擾免疫系統從而誘導PE的發生。先天模式識別受體家族Toll樣受體 (Toll-like receptors, TLR) 的激活會誘發妊娠依賴性高血壓、腎功能不全、內皮功能障礙和胎盤損傷[7]。在本研究中,我們使用不同的TLR激動劑誘導PE,并評估TLR4激動劑脂多糖(lipopolysaccharide, LPS)[8]和TLR7/8激動劑雷西莫特(Resiquimod, R848)[9]在構建PE模型方面的異同點。
1 材料和方法
1.1 實驗動物
SPF級雄性CD-1小鼠12只,8~12周齡,體重30~40 g;SPF級雌性CD-1小鼠24只,8~12周齡,體重20~40 g;購于浙江維通利華實驗動物技術有限公司[SCXK(浙)2019-0001],飼養于廣州華騰生物科技有限公司[SYXK(粵)2020-0237]。所有動物實驗均經廣州華騰生物科技有限公司倫理委員會審核并批準(HTSW211214),嚴格遵守3R原則。
1.2 主要試劑與儀器
脂多糖(上海麥克林生化科技有限公司,L861706);雷西莫特 (MedChemExpress,144875-48-9);小鼠ELISA試劑盒(soluble FMS-like tyrosine kinase 1, sFlt-1,ml002064; soluble endothelial factor, sEng,ml002193)(上海酶聯生物科技有限公司);異氟烷(深圳市瑞沃德生命科技有限公司,R510-22)。大小鼠無創尾動脈血壓測量分析系統(ZS-Z,北京眾實科技有限公司);全自動生化分析儀(Thermo Indiko Plus)。
1.3 實驗方法
1.3.1 動物分組與造模處理
孕鼠的獲得:將24只雌性小鼠與12只雄性小鼠按雌雄2∶1的比例合籠飼養過夜;在第2天9:00檢查雌性小鼠的陰道栓,若見陰道栓定義為妊娠第0天(記為E0)。
動物分組與造模處理:將24只孕鼠隨機分為4組:脂多糖對照組、脂多糖組、R848對照組、R848組,每組6只。脂多糖對照組于妊娠第13、14、15、16、17天(E13、E14、E15、E16、E17)尾靜脈注射200 μL生理鹽水;脂多糖組于妊娠第13、14、15、16、17天尾靜脈注射40 μg/kg LPS;R848對照組于妊娠第13、15、17天腹腔注射200 μL R848溶劑(5% DMSO+40% PEG300+5% Tween-80+50% saline);R848組于妊娠第13、15、17天按10 mg/kg的劑量腹腔注射R848。
1.3.2 孕鼠無創血壓測量
分別在妊娠第12、14、16、18天(E12、E14、E16、E18) 上午8:00~11:00,使用尾動脈血壓監測儀測量孕鼠血壓,每只孕鼠測量3次,結果取均值。
1.3.3 孕鼠尿蛋白/尿肌酐比值測定
收集孕鼠妊娠第17天17:00~妊娠第18天8:00的尿液,使用全自動生化分析儀測定尿蛋白與尿肌酐含量。
1.3.4 ELISA檢測孕鼠血清sFlt-1和sEng水平
在妊娠第18天,采用眼眶靜脈采血收集各組孕鼠血液于促凝管中,4℃靜置30 min后,3000 r/min離心10 min收集上清。根據試劑盒說明書檢測血清中sFlt-1和sEng的含量。
1.3.5 HE染色
在妊娠第18天,采用眼眶取血后,使用10 mL異氟烷過量麻醉處死孕鼠,開腹取出子宮,剝離胎盤,剖出胎鼠進行計數與稱重。收集孕鼠的胎盤組織、子宮,于10%甲醛固定、乙醇脫水,經石蠟包埋、連續切片(厚度4 μm)后按常規步驟進行HE染色,觀察各組織的病理改變。
1.4 統計學方法
實驗數據采用IBM SPSS 20進行統計分析。采用GraphPad Prism 7軟件進行繪圖。對正態分布或近似正態分布的計量資料使用平均數±標準差(±s)進行統計描述。多組比較采用單因素方差分析,組間兩兩比較采用LSD法或Tamhane’sT2法,P<0.05為差異有統計學意義。
2 結果
2.1 各組孕鼠尾動脈收縮壓比較
于妊娠第13天開始給予相應藥物后,LPS對照組與R848對照組相比,尾動脈收縮壓水平無統計學差異(P>0.05)。與LPS對照組相比,LPS組尾動脈收縮壓水平顯著升高(P<0.0001)。與R848對照組相比,R848組尾動脈收縮壓水平顯著升高(P<0.0001)(圖1、表1)。LPS組和R848組均出現孕鼠妊娠期高血壓。

表1 各組孕鼠尾動脈收縮壓(mmHg, n=6)Table 1 The systolic blood pressure of the tail artery of pregnant mice in each group
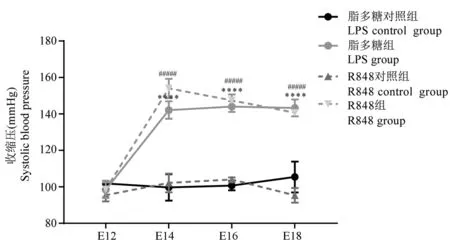
圖1 四組孕鼠妊娠第12、14、16、18天尾動脈收縮壓(n=6)Figure 1 The systolic blood pressure of caudal artery of pregnant mice in four groups on the 12th, 14th, 16th and 18th day of pregnancy
2.2 各組孕鼠尿蛋白/尿肌酐比值比較
使用終點法測定孕鼠尿蛋白,氧化酶法測定孕鼠尿肌酐,求得比值后發現,與LPS對照組相比,LPS組比值升高(P<0.05)。R848組與R848對照組無統計學差異(P>0.05)(圖2)。
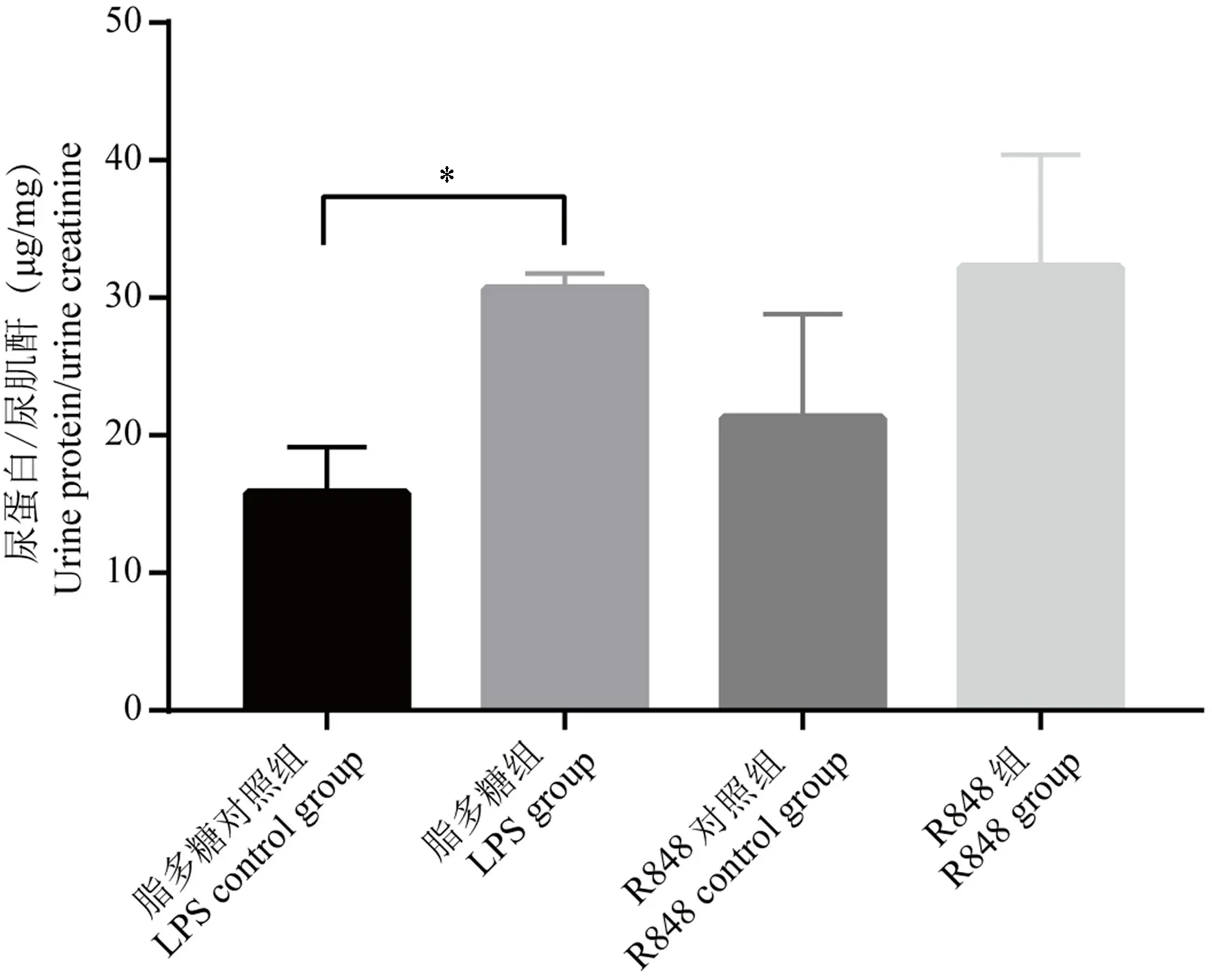
圖2 四組孕鼠尿蛋白/尿肌酐結果(n=6)Figure 2 Results of urinary protein/creatinine of pregnant mice in four groups
2.3 各組孕鼠胎鼠情況比較
經過統計分析(圖3A),各組胎鼠數量無統計學差異(P>0.05)(圖3B)。LPS對照組與R848對照組胎鼠體重無統計學差異(P>0.05),但與LPS對照組相比,LPS組的胎鼠體重略有下降(P<0.05)。與R848對照組相比,R848組胎鼠體重顯著下降(P<0.0001)(圖3C)。提示LPS和R848誘導的先兆子癇模型會影響胚胎的發育。

圖3 四組孕鼠胎鼠大體觀察、數量及體重結果(n=6)Figure 3 Results of gross observation, number and weight of pregnant mice in four groups
2.4 各組孕鼠血清中sFlt-1和sEng的表達量
ELISA檢測結果顯示(圖4),與R848對照組相比,LPS對照組的各因子表達量無統計學差異(P>0.05)。LPS組與LPS對照組相比,sFlt-1和sEng的表達無統計學差異(P>0.05)。R848組相比較于R848對照組,sFlt-1和sEng的表達升高(P<0.01)。

圖4 各組孕鼠血清中sFlt-1和sEng的表達水平結果(n=3)Figure 4 Results of sFlt-1 and sEng expression level in serum of pregnant mice in four groups
2.5 病理學變化
HE染色結果顯示(圖5),LPS對照組和R848對照組的胎盤中迷路可見大量血竇,血竇大小正常,血竇周圍見大量合胞體滋養層、細胞滋養層,細胞形態正常。LPS組胎盤組織與LPS對照組相比無明顯差異。而R848組的全部孕鼠出現嚴重的胎盤病變:胎盤組織迷路可見大量藍紫色鈣鹽沉積,合胞體滋養層廣泛增生并伴有大量鈣化,可見細胞灶狀壞死,滋養層內血竇數量明顯減少。
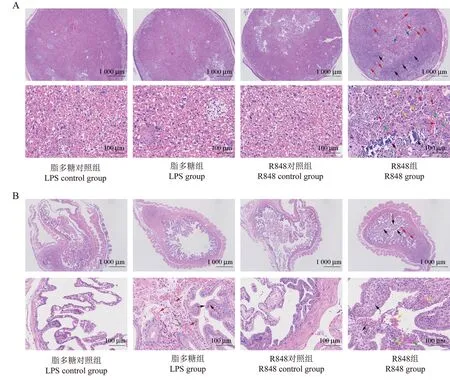
圖5 四組孕鼠胎盤、子宮HE染色Figure 5 HE staining of placenta and uterus of four groups of pregnant mice
此外,子宮HE染色結果顯示,LPS對照組和R848對照組子宮的黏膜層見大量絨毛樣結構,上皮完整,上皮細胞胞質豐富,形態正常,固有層見較多毛細血管,管腔大小正常。與LPS對照組比較,LPS組2/3孕鼠的子宮的黏膜層絨毛輕度水腫,大量毛細血管增生及充血擴張,伴少量炎性細胞浸潤。與R848對照組比較,R848組全部孕鼠的子宮的黏膜上皮高度水腫,絨毛明顯增厚,固有層結締組織增生明顯,毛細血管增生及淤血擴張,組織內可見小范圍輕度出血,伴少量炎性細胞浸潤。
3 討論
先兆子癇是一種多系統妊娠特異性疾病,其發病機制主要涉及兩個階段:胎盤異常和母體綜合征的發展[10]。因此構建合適的動物模型有助于更好地了解其發病機制和尋找有效的治療方法。小鼠胎盤在結構上類似于人類胎盤,具有高度的功能保護[11]。目前,構建小鼠PE模型的方法主要有:(1)使用手術誘導法,降低胎盤灌注壓[12]。此方法產生類似于伴有胎兒生長受限的晚發性PE病理效應。由于手術是在胎盤發育后進行的,不影響螺旋動脈正常重塑,一般用于胎盤缺血和胎盤功能不全的研究;(2)近交系交配:雄性DBA/2近交系小鼠與CBA/J近親繁殖[13], 此方法可引起半異體胎盤的免疫排斥反應,及主要組織相容性復合體(major histocompatibility complex, MHC)與母體不相容性導致流產;(3)基因編輯:storkhead box 1過表達[14]、吲哚胺2,3-雙加氧酶敲除[15],此方法使用傳統的轉基因技術調控與PE相關基因的表達,同時影響胎盤和胎兒,因此必須考慮胎兒基因組改變對病理或表型的影響;(4)外源性藥物誘導:血管緊張素II型1受體[16]、TLR激動劑[17]、L-NAME(ng-nitro-larginine methyl ester, 硝基-L-Arg-甲基酯)[18],這些藥物中的絕大多數調節免疫系統,通常在胎盤發育發生后引入,模擬晚發性PE的慢性炎癥狀態;(5)全身性腺病毒感染和滋養層特異性轉基因方法[19],全身性腺病毒感染因其肝中靶基因的腺病毒攝取和錯誤表達可導致母體假病毒性肝炎,產生與PE無關聯性的其他癥狀。滋養層特異性慢病毒轉基因方法僅在胎盤的滋養層部分表達靶基因,可避免產生脫靶或繼發性效應。上述造模方法可產生PE部分或全部特征,及一些與人類PE臨床不具相關性的輔助表型,但由于存在發病機制和功能活性的差異以及病理進程的不一致,仍需建立更可靠的PE動物模型進行驗證以提高向人類轉化效率。
LPS是一種細菌內毒素,作用于細胞膜表面的Toll樣受體4[20]。LPS給藥是常用的PE造模方法。在免疫細胞中,LPS可以觸發促炎細胞因子的釋放和活性氧的產生[21]。Li等[8]于妊娠7.5~17.5 d在CD-1小鼠中注射LPS,隨后觀察到血壓升高,胎盤胎兒血管面積、滋養層侵襲和螺旋動脈重塑減少,纖維蛋白沉積和腎小球腫脹的腎損傷。
TLR7和TLR8通過與內體或吞噬體中的配體結合來識別細胞內信號[22]。與正常孕婦相比,PE患者的胎盤中合體滋養細胞和細胞滋養細胞中的TLR7和TLR8表達增加。研究發現,用TLR7/8激動劑誘導的PE小鼠,其滋養層細胞的TLR7和TLR8的蛋白質水平增加,出現高血壓、蛋白尿、炎癥和胎盤功能障礙的表征[9]。
在本研究中,與相對應的對照組相比,LPS模型組和R848模型組均出現了妊娠期高血壓(收縮壓≥140 mmHg/舒張壓≥90 mmHg)。尿蛋白/尿肌酐結果顯示,LPS組出現蛋白尿,但R848組并沒有出現蛋白尿,這可能與TLR8在小鼠中抑制TLR7的介導作用有關,從而對腎有保護作用[23]。盡管如此,胎盤TLR7/8的過度激活可誘發妊娠依賴性高血壓和內皮功能障礙。本研究發現,LPS組和R848組的胎兒體重低于相應對照組(P<0.05),這表明胎兒生長受限。與此同時,HE染色結果表明,LPS組和R848組子宮均出現少量炎性細胞浸潤,且R848組胎盤組織可見灶狀壞死。因此,本研究成功地構建了使用TLR4激動劑LPS和TLR7/8激動劑R848誘導的PE動物模型。
在先兆子癇中,胎盤分泌的過量sFlt-1,通過結合局部和循環血液中的血管生成蛋白(vascular endothelial growth factor, VEGF)和胎盤生長因子(placental growth factor, PlGF),抑制其傳導,從而導致內皮細胞功能障[24]。抗血管生成蛋白sEng是一種胎盤衍生的可溶性 轉化生長因子β (transforming growth factor-β, TGF-β) 共受體,抑制TGF-β1與其受體和下游信號傳導的結合,引起TGF-β信號傳導失調[25]。sEng在先兆子癇患者血清中的表達量與疾病嚴重程度呈正相關。在妊娠大鼠中,相比于單獨使用,sEng和sFlt-1的聯用產生先兆子癇的體征和癥狀更嚴重[26]。這與我們的實驗結果相一致,sEng和sFlt-1表達量升高的R848模型組比sEng和sFlt-1含量無統計學差異的的LPS模型組的先兆子癇表征更嚴重,如胎兒體重下降更明顯、胎盤嚴重病變。
綜上所述,LPS和R848均能構建出與人類PE病理相似(新發高血壓或伴有蛋白尿、胎盤功能障礙以及其他器官功能障礙等[6])的PE動物模型。LPS在妊娠和非妊娠動物中都可誘導全身炎癥,其機制為慢性炎癥狀態的持續激活,這表明LPS引起的表型可能不是妊娠特異性的[27]。根據胎盤HE染色結果表明,R848構建的PE模型表征更為嚴重,且給藥方式為腹腔注射,操作簡單。同時,在R848模型小鼠循環中發生了抗血管生成與促血管生成的不平衡:與對照組相比,R848組小鼠血清的sFlt-1和sEng表達上升,暗示TLR7/8介導的炎癥免疫反應可能通過調節sFlt-1和sEng的表達從而抑制母胎界面的血管生成,參與PE的發生發展[28-29]。因此,針對TLR7/8開發的ssRNA或者小分子抑制劑可能通過促進新生血管的生成阻斷PE的進展。
本研究建立的TLR7/8誘導的PE樣小鼠模型是較為新穎且有相關數據支持的模型[30]。該模型不僅具有妊娠期特有的高血壓以及合并胎兒生長受限等不良妊娠結局的PE樣表型,而且具有類似人類PE胎盤滋養細胞侵襲不足的病理特征。進一步提示了母胎界面TLR7信號通路異常在PE發病過程中的重要作用,并為研究PE的發病機制提供了一個合適的動物模型。

