伏立康唑與利福平藥物相互作用的臨床回顧性研究
陳婷婷?林志強 吳水發?張清泉

摘要:目的 回顧性研究利福平對伏立康唑谷濃度的影響和影響持續的時間,以及兩者相互作用的影響因素。方法 收集2018年5月—2022年12月我院收治的均使用過伏立康唑和利福平且進行伏立康唑TDM的病例,匯總患者的一般資料、利福平給藥方案、伏立康唑給藥方案、其他合并用藥及伏立康唑TDM結果。結果 共納入32例患者,15例同期聯用利福平,17例未同期聯用利福平。聯用利福平組伏立康唑平均谷濃度為(1.58±3.01) mg/L,66.7%(10例)患者低于目標范圍下限,達標率為26.7%;未聯用利福平組伏立康唑平均谷濃度為(3.67±2.44) mg/L,0例患者谷濃度低于下限,達標率為82.4%,兩組谷濃度分布存在顯著統計學差異(P<0.01)。聯用組中,谷濃度低于目標范圍的10例患者,首次TDM時機均為停用利福平7 d內,其中6例患者停用利福平后多次復查谷濃度,3例在停藥7 d后谷濃度上升至目標范圍下限;聯用組內首次TDM谷濃度>1.0 mg/L的5例患者中,3例為危重癥患者,SOFA評分均大于10分,其中1例同時聯用大劑量PPI;1例在利福平停藥第7 d實施伏立康唑TDM;1例在聯用利福平前谷濃度超標。結論 伏立康唑與利福平聯用時,谷濃度顯著降低,利福平停藥7 d以上,谷濃度可能恢復至目標范圍內;利福平對伏立康唑的代謝誘導作用可能受患者病情嚴重程度的影響。
關鍵詞:伏立康唑;利福平;治療藥物監測;藥物相互作用;回顧性研究
中圖分類號:R978.1文獻標志碼:A
Retrospective study on the interaction between voriconazole
and rifampin in clinical? patients
Chen Tingting, Lin Zhiqiang, Wu Shuifa, and Zhang Qingquan
(Department of Pharmacy, Quanzhou First Hospital, Quanzhou 362000)
Abstract Objective To retrospectively study the induction and duration of rifampin on voriconazole trough concentration and the interfering factors of the interaction between rifampin and voriconazole. Methods? ?The data of patients in our hospital who had been treated with voriconazole and rifampin and also underwent voriconazole TDM from May 2018 to December 2022 was collected. The basic information, rifampin regimen, voriconazole regimen, other co-medications and voriconazole TDM results were analyzed. Results? ? A total of 32 patients were collected; 15 patients had concomitant use of voriconazole with rifampin in the same period, while 17 patients did not. The mean trough concentration of voriconazole was (1.58±3.01) mg/L in the combined group, with 66.7% (10/15) of patients below the target range and 26.7% (4/15) of patients in the target range. The mean trough concentration was (3.67±2.44) mg/L in the uncombined group, with 82.4%(14/17) of patients achieving the target concentration and no patient below the target range. The distribution of voriconazole trough concentration between the two groups was significantly different (P<0.01). In the combined group, the initial TDM of 10 patients who were below the target range were all sampled within 7 days after discontinuing rifampin; 6 patients repeated voriconazole TDM several times, while 3 patients achieved the therapeutic concentration after discontinuing rifampin for more than 7 days. There were 5 patients with voriconazole trough concentrations beyond 1.0 mg/L in the combined group, including 3 critically ill patients with a SOFA score greater than 10 and one patient who had coadministration with a heavy dose of PPI at the same time; one patient underwent TDM after discontinuing rifampin for 7 days; and one patient who had voriconazole trough concentrations over the target range twice before coadministration with rifampin. Conclusion? ? The trough concentration of voriconazole will be significantly reduced when coadministration with rifampin, but may increase into the target range after discontinuing rifampin for more than 7 days. The induction of rifampin in voriconazole's metabolism may affected by the SOFA score of patients.
Key words Voriconazole; Rifampin; Therapeutic drug monitoring; Drug-drug interaction; Retrospective study
伏立康唑在體內主要經肝臟代謝,它既是CYP2C19、CYP2C9、CYP3A4的底物,又是其抑制劑,臨床應用中易與其他CYP酶底物、抑制劑或誘導劑發生藥物相互作用。利福平是CYP酶的強誘導劑,伏立康唑說明書明確指出兩者應禁止聯用。然而,目前關于伏立康唑與利福平相互作用的臨床研究罕見有報道,尤其是利福平對伏立康唑誘導作用的持續時長,這關系到停用利福平后伏立康唑的再次啟用時機。伏立康唑治療藥物監測(therapeutic drug monitoring, TDM)是實施個體化治療監護的重要手段[1-2],本文通過回顧性研究伏立康唑TDM,探索利福平對伏立康唑谷濃度的影響和其代謝誘導作用的持續時間,以及兩者相互作用的影響因素,為兩者相互作用的研究提供更多的臨床數據。
1 材料與方法
1.1 病例資料
檢索2018年5月—2022年12月我院收治的均使用過伏立康唑和利福平的病例。排除標準:①未實施伏立康唑TDM的病例;②年齡<18周歲的病例;③資料不完整的病例。匯總患者的一般資料、利福平給藥方案、伏立康唑給藥方案、其他合并用藥及伏立康唑TDM結果。
1.2 伏立康唑TDM
本回顧性研究中伏立康唑谷濃度采用HLPC法測定,參考國內外指南[3-6],設定伏立康唑谷濃度目標范圍為1.0~5.5 mg/L。
1.3 伏立康唑合并用藥評價
參考《中國伏立康唑個體化用藥指南》[7]中藥物相互作用部分所列出的藥品目錄,包括:①不推薦與伏立康唑同時使用的藥品,②聯用時需增加伏立康唑劑量的藥品,③聯用時需密切監測伏立康唑安全性與有效性的藥品,將伏立康唑用藥前3 d及用藥期間合并使用的目錄內藥品,納入本研究中的合并用藥。
1.4 數據分析
本研究的數據使用SPSS 25.0軟件進行統計分析。正態分布連續變量的比較采用T-test,非正態分布連續變量的比較采用Wilcoxon秩和檢驗,分類變量的比較采用Fisher確切概率法,P<0.05為差異有統計學意義。
2 結果
2.1? ? 一般資料
2018年5月—2022年12月我院均使用過伏立康唑及利福平并實施伏立康唑TDM的病例共32例。患者科室分布:呼吸與危重癥科21例、重癥醫學科4例、感染病科4例、血液內科1例、骨科1例、消化內科1例;利福平用藥目的:肺結核20例、結核性腹膜炎1例、非結核分枝桿菌感染4例、經驗治療7例;伏立康唑用藥目的:曲霉菌病17例、念珠菌病2例、馬爾尼菲籃狀菌病2例、經驗治療11例。其中,伏立康唑與利福平同期聯用的病例15例,伏立康唑與利福平未同期聯用的病例17例,兩組在性別、年齡、體重、肝腎功能、伏立康唑用法用量、伏立康唑TDM時機及合并用藥等方面均無統計學差異,患者的基線數據對比如表1所示。
2.2 聯用與未聯用利福平組伏立康唑首次TDM結果
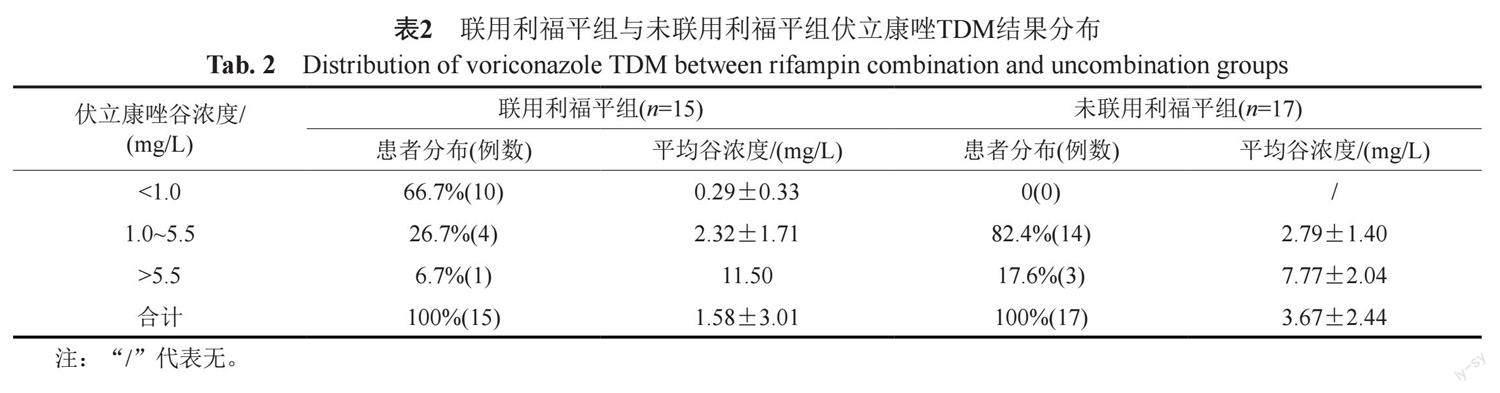
聯用組中15例患者,伏立康唑與利福平平均聯用天數為3.5(0~10) d,TDM前平均聯用天數為3.3(0~10) d;未聯用組中17例患者,10例患者多次辦理出入院并在非同次住院期間分別使用伏立康唑與利福平,7例患者在同次住院期間使用伏立康唑與利福平,其中4例患者在聯用利福平前實施伏立康唑TDM,另外3例患者兩藥間距時間分別為4、7和12 d。聯用組與未聯用組伏立康唑平均谷濃度分別為(1.58±3.01)和(3.67±2.44) mg/L,兩者存在統計學差異(Z=-3.31, P<0.01);聯用組與未聯用組谷濃度達標率分別為26.7% (4/15)和82.4% (14/17),兩者存在顯著差異(Z=-3.57, P<0.01);聯用組中66.7%(10/15)病例谷濃度低于目標范圍下限,未聯用組0例低于下限。 聯用組與未聯用組伏立康唑TDM結果見表2。
2.3? 伏立康唑谷濃度與利福平停藥天數
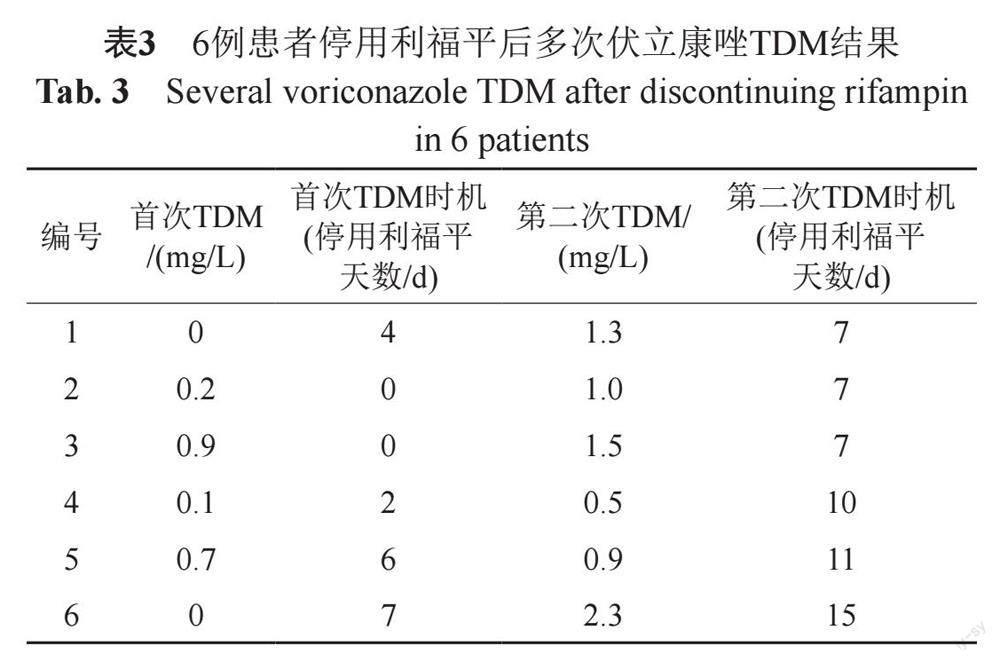
聯用組中15例患者,首次TDM谷濃度低于目標范圍的10例患者采樣時機均為停用利福平7 d內,其中6例患者多次進行伏立康唑TDM:3例患者停用利福平7 d后,第二次復查谷濃度達標;2例患者停用利福平10 d以上,復查谷濃度仍低于目標范圍下限;1例患者停用利福平15 d并增加伏立康唑劑量后,谷濃度達標。伏立康唑多次TDM結果詳見表3。
2.4? 聯用組中伏立康唑谷濃度>1.0 mg/L的病例
聯用組中,5例患者首次TDM谷濃度>1.0 mg/L:3例為危重癥患者,SOFA評分分別為12、16、16,其中1例患者同時聯用大劑量PPI;1例患者在停用利福平第7天進行伏立康唑TDM;1例患者在聯用利福平前的兩次TDM谷濃度分別為9.9和8.9 mg/L,聯用利福平后TDM谷濃度為1.7 mg/L。5例患者的具體用藥信息見表4。
3 討論
3.1 利福平對伏立康唑谷濃度的影響
2017年1項Meta分析顯示[8],許多酶誘導劑與伏立康唑存在藥物相互作用。利福霉素為CYP酶的強誘導劑,可與許多藥物發生藥物相互作用[9]。利福平及利福布丁可導致伏立康唑AUC、Cmax及平均谷濃度下降[10],伏立康唑說明書明確提出禁止與利福平合用,盡量避免與利福布汀合用。伏立康唑與利福平的相互作用,2007年在1例急性淋巴細胞白血病的患者中報道[11],兩者聯用致伏立康唑的整體暴露量下降99%。伏立康唑與利福布丁的相互作用,2008年在1例爪蟾分枝桿菌合并煙曲霉肺部感染的患者中報道[12],患者按體重給予伏立康唑后,谷濃度始終未達標,增加伏立康唑劑量后,谷濃度升至0.68 mg/L。本研究中,聯用組伏立康唑谷濃度達標率為26.7%,顯著低于未聯用組82.4%;聯用組66.7%患者谷濃度低于下限范圍,未聯用組則沒有病例低于下限。本研究進一步確證了利福平可致伏立康唑谷濃度明顯下降。
3.2 利福平對伏立康唑代謝誘導作用的持續時間
利福平對伏立康唑的代謝誘導作用會持續多久,是臨床值得關注的問題,關系到停用利福平后再次啟用伏立康唑的時機,若時機過早,不但不能達到治療效果,還會造成藥物的浪費。Nassar等[13]的研究表明,利福平的誘導作用在給藥22 h后出現,大約28~30 h后達到最大值,然后在1~2 h內急劇下降,幾乎到基線水平。有研究表明,利福平停藥14 d后殘余的誘導作用最小[14-15]。而其他臨床研究表明[16-17],利福平停用7 d以上,伏立康唑谷濃度可能達到治療濃度。西娜等[18]的研究也表明利福霉素對伏立康唑谷濃度的影響需要大約一周時間才會消除。但停用利福平后,伏立康唑谷濃度恢復到基線水平需要14 d甚至更長時間[17]。本研究中,聯用組內10例谷濃度偏低的患者,首次TDM均在停用利福平7 d內,3例患者停用利福平7 d后復查谷濃度達標,2例患者停藥10 d后復查谷濃度仍未達標,本研究認為停用利福平7 d以內,不建議再次使用伏立康唑,伏立康唑再次啟用時機可能需要利福平停藥至少7 d以上。
3.3 病情嚴重程度對伏立康唑谷濃度的影響
重癥患者中的各種病理生理變化可導致抗菌藥物PK改變,從而使其最佳劑量方案復雜化[19-20]。Blot 等[19]的研究指出,重癥患者中主要存在五個因素導致抗菌藥物PK改變,包括表觀分布容積增大、蛋白結合率改變、腎功能增強或減退及肝功能障礙,進而引起抗菌藥物血藥濃度下降或升高。Bienvenu等[21]的研究表明,Sofa評分≥10為伏立康唑谷濃度增加的相關因素。本研究中,聯用組內3例患者病情危重,Sofa評分均大于10,其中2例患者伏立康唑谷濃度在目標范圍內,另1例患者谷濃度為11.7 mg/L,電子病例顯示,該患者當天同時做了萬古霉素血藥濃度監測,結果顯示谷濃度>50 mg/L,同樣遠超出目標范圍。本研究表明,患者病情嚴重程度可能影響伏立康唑谷濃度,進而改變利福平與伏立康唑相互作用的結局。此外,研究表明聯用PPIs可增加伏立康唑谷濃度[10,22],以上3例患者均同時聯用了PPIs,因此患者病情嚴重程度對伏立康唑谷濃度的影響需要進一步驗證。
3.4 其他因素對伏立康唑谷濃度的影響
伏立康唑臨床應用個體差異影響因素很多[23-25],包括基因型、年齡、胃腸吸收、藥物相互作用及患者的病理生理狀態等。大部分PPIs是CYP2C19抑制劑,與該酶的底物聯用時可發生藥物相互作用。2003年一項研究表明[26],與奧美拉唑40 mg qd po聯用時,伏立康唑平均Cmax和AUCt分別增加15%及41%。而2012年另一項多中心研究表明[22],與任何PPI聯用時,伏立康唑谷濃度均顯著增加。此外,Cojutti等[10]的研究表明,伏立康唑谷濃度的增加與PPI的類型及劑量有關,伏立康唑與酶抑制劑或者與酶抑制劑及酶誘導劑同時聯用時,谷濃度均大大增加,尤其是聯用大劑量PPI時。本研究中,1例患者同時聯用伏立康唑、利福平及大劑量PPI,谷濃度為4.9 mg/L,聯用大劑量PPI可能與血藥濃度提高有關,但由于該患者同時是一位危重患者,該多重合并用藥對伏立康唑谷濃度的影響仍需進一步確證。
在CYP2C19慢代謝者中,伏立康唑的Cmax和AUC值比正常代謝者高2~5倍[27]。研究顯示了CYP2C19基因多態性對伏立康唑初始穩態谷濃度的影響[28]。而CYP2C19基因多態性分布因種族而異,約15%~20%的亞洲人群是慢代謝者,而白種人中慢代謝者僅約2%~3%[29]。本研究中,1例患者聯用利福平后谷濃度為1.7 mg/L,而聯用利福平前的兩次TDM均高于目標范圍,分別為9.9及8.9 mg/L,該患者不存在其他合并用藥,TDM結果可能與該患者的CYP2C19基因型有關,但患者未實施基因型檢測。
4 結論與展望
本回顧性研究顯示,伏立康唑與利福平聯用時,谷濃度顯著降低,利福平停藥7 d以上,谷濃度可能恢復至目標范圍內,利福平停藥至少7 d以上方建議加用伏立康唑;利福平對伏立康唑的代謝誘導作用可能受患者病情嚴重程度的影響。
然而,本研究存在一定的局限性。首先,樣本量較少;其次,該研究為回顧性研究,不能排除患者由用藥依從性所致的影響;此外,本次研究中析無患者的CYP2C19基因多態性檢測內容,不能排除基因型對患者伏立康唑谷濃度的影響。因此,利福平對伏立康唑代謝誘導作用的持續時間需要更多的數據進行驗證,與此同時,患者病情嚴重程度、聯用大劑量PPI及CYP2C19基因型對利福平與伏立康唑相互作用的影響也需要進一步探索。
參 考 文 獻
Luong M L, Al-Dabbagh M, Groll A H, et al. Utility of voriconazole therapeutic drug monitoring: A meta-analysis[J]. J Antimicrob Chemother, 2016, 71(7): 1786-1799.
John J, Loo A, Mazur S, et al. Therapeutic drug monitoring of systemic antifungal agents: A pragmatic approach for adult and pediatric patients[J]. Expert Opin Drug Metab Toxicol, 2019, 15(11): 881-895.
Ashbee H R, Barnes R A, Johnson E M, et al. Therapeutic drug monitoring (TDM) of antifungal agents: Guidelines from the british society for medical mycology[J]. J Antimicrob Chemother, 2014, 69(5): 1162-1176.
Chau M M, Kong D C, van Hal S J, et al. Consensus guidelines for optimising antifungal drug delivery and monitoring to avoid toxicity and improve outcomes in patients with haematological malignancy, 2014[J]. Intern Med J, 2014, 44(12b): 1364-1388.
Laverdiere M, Bow E J, Rotstein C, et al. Therapeutic drug monitoring for triazoles: A needs assessment review and recommendations from a Canadian perspective[J]. Can J Infect Dis Med Microbiol, 2014, 25(6): 327-343.
Takesue Y, Hanai Y, Oda K, et al. Clinical practice guideline for the therapeutic drug monitoring of voriconazole in non-asian and asian adult patients: Consensus review by the Japanese society of chemotherapy and the Japanese society of therapeutic drug monitoring[J]. Clin Ther, 2022, 44(12): 1604-1623.
Chen K, Zhang X, Ke X, et al. Individualized medication of voriconazole: A practice guideline of the division of therapeutic drug monitoring, Chinese pharmacological society[J]. Ther Drug Monit, 2018, 40(6): 663-674.
Li T Y, Liu W, Chen K, et al. The influence of combination use of CYP450 inducers on the pharmacokinetics of voriconazole: A systematic review[J]. J Clin Pharm Ther, 2017, 42(2): 135-146.
Baciewicz A M, Chrisman C R, Finch C K, et al. Update on rifampin, rifabutin, and rifapentine drug interactions[J]. Curr Med Res Opin, 2013, 29(1): 1-12.
Cojutti P, Candoni A, Forghieri F, et al. Variability of voriconazole trough levels in haematological patients: Influence of comedications with cytochrome P450(CYP) inhibitors and/or with CYP inhibitors plus CYP inducers[J]. Basic Clin Pharmacol Toxicol, 2016, 118(6): 474-479.
Geist M J, Egerer G, Burhenne J, et al. Induction of voriconazole metabolism by rifampin in a patient with acute myeloid leukemia: Importance of interdisciplinary communication to prevent treatment errors with complex medications[J]. Antimicrob Agents Chemother, 2007, 51(9): 3455-3456.
Schwiesow J N, Iseman M D, Peloquin C A. Concomitant use of voriconazole and rifabutin in a patient with multiple infections[J]. Pharmacotherapy, 2008, 28(8): 1076-1080.
Nassar Y M, Hohmann N, Michelet R, et al. Quantification of the time course of CYP3A inhibition, activation, and induction using a population pharmacokinetic model of microdosed midazolam continuous infusion[J]. Clin Pharmacokinet, 2022, 61(11): 1595-1607.
Burman W J, Gallicano K, Peloquin C. Comparative pharmacokinetics and pharmacodynamics of the rifamycin antibacterials[J]. Clin Pharmacokinet, 2001, 40(5): 327-341.
Gallicano K D, Sahai J, Shukla V K, et al. Induction of zidovudine glucuronidation and amination pathways by rifampicin in HIV-infected patients[J]. Br J Clin Pharmacol, 1999, 48(2): 168-179.
孟現民, 張莉. 伏立康唑藥物相互作用與處理對策[J]. 中國新藥與臨床雜志, 2009, 28(6): 415-420.
林志強, 傅新陽, 陳婷婷, 等. 利福平影響伏立康唑血藥濃度2例并文獻復習[J]. 中國感染與化療雜志, 2021, 21(3): 292-296.
西娜, 趙冠人, 陳明, 等. 伏立康唑的治療藥物監測在結核病患者中的應用[J]. 中國抗生素雜志, 2021, 46(5): 481-486.
Blot S I, Pea F, Lipman J. The effect of pathophysiology on pharmacokinetics in the critically ill patient--concepts appraised by the example of antimicrobial agents[J]. Adv Drug Deliv Rev, 2014, 77: 3-11.
Roberts J A, Joynt G M, Choi G Y, et al. How to optimise antimicrobial prescriptions in the Intensive Care Unit: Principles of individualised dosing using pharmacokinetics and pharmacodynamics[J]. Int J Antimicrob Agents, 2012, 39(3): 187-192.
Bienvenu A L, Pradat P, Plesa A, et al. Association between voriconazole exposure and sequential organ failure assessment (SOFA) score in critically ill patients[J]. PLoS One, 2021, 16(11): e0260656.
Dolton M J, Ray J E, Chen S C, et al. Multicenter study of voriconazole pharmacokinetics and therapeutic drug monitoring[J]. Antimicrob Agents Chemother, 2012, 56(9): 4793-4799.
Cheng L, Xiang R, Liu F, et al. Therapeutic drug monitoring and safety of voriconazole in elderly patients[J]. Int Immunopharmacol, 2020, 78: 106078.
Boast A, Curtis N, Cranswick N, et al. Voriconazole dosing and therapeutic drug monitoring in children: Experience from a paediatric tertiary care centre[J]. J Antimicrob Chemother, 2016, 71(7): 2031-2036.
Blanco-Dorado S, Maro?as O, Latorre-Pellicer A, et al. Impact of CYP2C19 genotype and drug interactions on voriconazole plasma concentrations: A spain pharmacogenetic-pharmacokinetic prospective multicenter study[J]. Pharmacotherapy, 2020, 40(1): 17-25.
Wood N, Tan K, Purkins L, et al. Effect of omeprazole on the steady-state pharmacokinetics of voriconazole[J]. Br J Clin Pharmacol, 2003, 56(Suppl 1): 56-61.
Ikeda Y, Umemura K, Kondo K, et al. Pharmacokinetics of voriconazole and cytochrome P450 2C19 genetic status[J]. Clin Pharmacol Ther, 2004, 75(6): 587-588.
Lamoureux F, Duflot T, Woillard J B, et al. Impact of CYP2C19 genetic polymorphisms on voriconazole dosing and exposure in adult patients with invasive fungal infections[J]. Int J Antimicrob Agents, 2016, 47(2): 124-131.
Yin S J, Ni Y B, Wang S M, et al. Differences in genotype and allele frequency distributions of polymorphic drug metabolizing enzymes CYP2C19 and CYP2D6 in mainland Chinese Mongolian, Hui and Han populations[J]. J Clin Pharm Ther, 2012, 37(3): 364-369.

