基于磁共振影像組的CBF精準量化方法
譚中建,邢方亮,鄒憶懷
三維動脈自旋標記(3D-ASL)是近年來興起的一項以自身動脈血中的水分子作為內源性示綜劑,完全無創、可重復、安全的灌注技術[1]。動脈自旋標記(ASL)標記方法可分為脈沖動脈自旋標記(PASL)、連續動脈自旋標記(CASL)和偽連續動脈自旋標記(PCASL)3大類。本研究采用PASL,測量的腦血流量(CBF)值是病灶區域(ROI)內的局部平均腦血流量值(rCBF),單位為mL/(100 g·min)。計算公式為:

本研究中,分母中的變量SIPD通過ASL序列中Control(控制項)數據進行近似[2-3]。
目前,常見的CBF分析處理中,其ROI確定是與組織結構的手工及目測匹配,并只能用固定的圓形或橢圓形確定ROI范圍,不能做到和病灶適形,且rCBF是均值,并不能精準反映ROI內腦血流量的空間分布狀況。本研究旨在解決ROI與結構像的精準匹配、精確反應ROI的CBF分布、定量測量的問題。本研究基于影像組[4]思想,探索一種新的Lesions-vCBF(病灶處的體素級分辨率的腦血流量Voxel-CBF)分析方法,即可針對病灶區域計算各個體素的vCBF(Voxel-CBF),并在病灶的結構像上進行可視化表達。
1 對象與方法
1.1 研究對象 回顧2021年3月20日以來本院臨床診斷為慢性腦供血不足病人10例的MRI數據,和診斷急性缺血性腦卒中病人1例的MRI數據。
1.2 檢查方法 使用西門子1.5 T(Siemens Amria1.5 T)磁共振掃描儀,選用頭頸聯合矩陣線圈(24通道),行常規的T1加權成像(T1WI)、T2加權成像(T2WI)、液體衰減反轉恢復(FLAIR)、擴散加權成像(DWI)并計算生成表觀彌散系數(ADC)圖像,ASL采用PASL基于快速梯度自旋回波(TGSE)序列3D-ASL參數:重復時間(TR)為4 000 ms,回波時間(TE)為25 ms,灌注持續時間(BD)為700 ms,反轉時間(TI)為1 990 ms,體素(Voxel)為1.5 mm×1.5 mm×1.5 mm,聚焦視野(FOV)為192 mm×192 mm,矩陣(Matrix)為64×63,90層全腦覆蓋,采集時間為196 s。彌散加權像序列采用平面回波成像(EPI),掃描參數如下:TR為3 000 ms,TE為82 ms,相位方向P>>A(后前方向),FOV為24 cm×24 cm,b值為0和1 000 s/mm2,Matrix為150×135,Voxel為1.6 mm×1.6 mm×5.5 mm,采集時間為38 s。19層覆蓋全腦采集。FLAIR序列屬于反轉恢復序列(IR),參數如下:TI為2 300 ms,TR為7 500 ms,TE為112 ms,分次采集concatenations為2,Matrix為204×256,層厚(SL)為3 mm,40層覆蓋全腦掃描,采集時間為150 s。
1.3 影像組處理與數據分析
1.3.1 從彌散加權像自動化提取病灶范圍 對于急性腦梗死病灶,在細胞腦水腫的條件下,細胞內的水分子增多,導致細胞外的間隙下降,超急性期腦梗死的水分子擴散降低,DWI顯示高信號[5];對應的ADC區域值是低信號[6]。
基于影像組跨組檢索的思想,通過設計數字濾波器從DWI序列自動化提取病灶的空間范圍。經過優化掃描參數采集到的DWI序列影像,此時即可采用適當的灰度窗口對DWI高通濾波的同時對ADC進行低通濾波自動提取出病灶所在范圍。詳見圖1。

圖1 DWI序列影像
1.3.2 病灶范圍與FLAIR像的融合 FLAIR序列對血管源性水腫敏感,DWI對細胞源性水腫敏感[7]。從彌散加權像取得的病灶區域與FLAIR像對齊在相同坐標系下面,一方面使得后期處理分析更加容易;另一方面FLAIR像攜帶了更加豐富的組織結構細節,利于臨床更加精準的判斷。將上述得到的病灶范圍與FLAIR像融合,即可同時獲得清晰的結構像與DWI高信號和ADC低信號相對應的病灶范圍(見圖2)。

圖2 FLAIR序列影像及病灶提取融合圖像
1.3.3 Lesions-vCBF跨組檢索及結構可視化 從彌散加權像DWI上的高信號并對應ADC同區域低信號的研判一致性后取出病灶ROI范圍,計算ROI內的所有Voxel-CBF,并把各個Voxel-CBF值在FLAIR序列上進行可視化。即可在FLAIR序列上精確看到病灶的vCBF分布,進而對病灶的程度有更精準的了解。通過圖3可以看到Lesions-vCBF對比rCBF測量具有以下3個明顯優勢:①跨影像組自動提取病灶范圍;②Lesions-vCBF與FLAIR結構像深度融合可以對病灶與結構的關系一目了然;③Lesions-vCBF的空間分布量化帶來更精細的CBF量化結果。
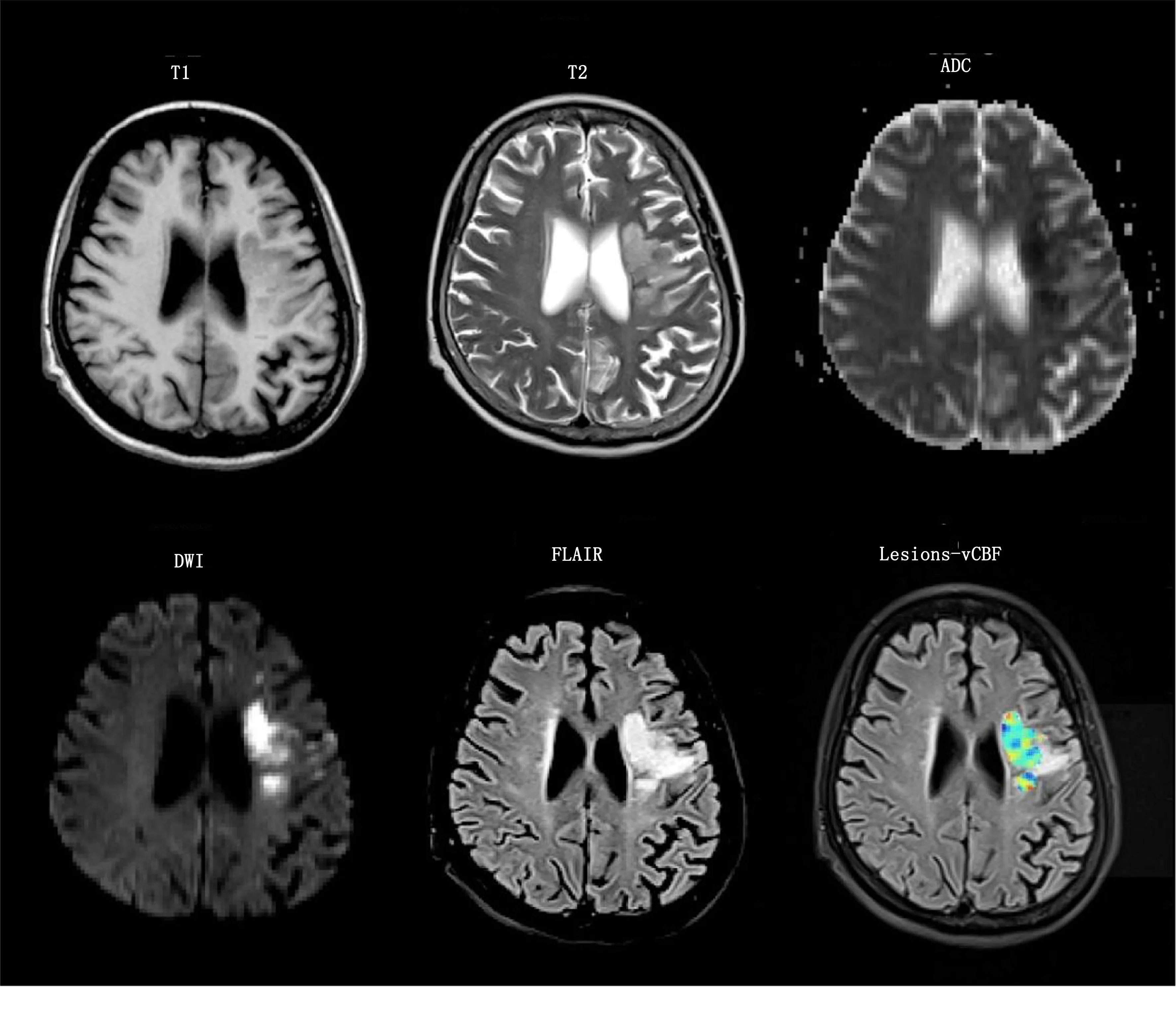
圖3 影像組各加權圖像及Lesions-vCBF圖像
1.3.4 FLAIR像與病灶vCBF的融合與分析 從FLAIR的病灶范圍提取影像掃描的三維坐標在世界坐標系下面去索引CBF像的值,可以得到病灶范圍的vCBF(見圖4)。

圖4 FLAIR像上病灶范圍的vCBF分布
圖4使用MATLAB-2021b軟件生成,計算過程如下:首先將FLAIR像與CBF像在系統全局坐標系下進行配準和融合,獲得圖4右下影像;其次根據圖2中的病灶遮罩計算對稱的健側遮罩,并提取對應的vCBF值,分別繪制正排曲線(圖4右上和左下);最后分別將患側和健側的vCBF值以不同色階渲染在FALIR相對應的位置上(圖4左上)。從圖4中可以明顯觀察到核心梗死區(藍色)和半暗帶的空間分布范圍(青色到橘色)。而且還可以得到病灶范圍的VCBF具體數值分布。取vCBF<12.3[8]的部分為核心梗死區,通過上述數據分析,可以求該病灶范圍的vCBF>12.3的占比為75.12%。這一計算方法可以明確對半暗帶進行精確量化(見圖5)。

圖5 vCBF的數值分布
1.4 慢性腦供血不足的病例分析 回顧我院臨床診斷慢性腦供血不足的入組藥物干預數據(服用九旭藥業的銀杏酮酯滴丸),可以對病例的干預前后做出以vCBF精確量化評價。圖6采用上述相同計算方法,可以獲得ROI的Lension-vCBF的數學期望,用于評估病灶的預后情況。這為評估慢性腦供血不足病灶的藥物療效提供了新的更精準的量化評估方法。

圖6 Lesions-vCBF慢性腦供血不足的藥物干預評價案例
表1中的數據來自10個病灶(圖7的結構像位置)的Lesion-vCBF的精確量化,因此可以精確地反映慢性腦供血不足病灶處的藥物預后評價情況。表1顯示藥物干預后慢性腦供血不足的病灶血供提升顯著。

表1 慢性腦供血不足的藥物干預評價 單位:mL/(100 g·min)

圖7 表1病灶在結構像上的位置
以其中10個病灶的預后數據為例進行數據分析,可以得到預后的ΔCBF表現。詳見圖8。

圖8 vCBF 慢性腦供血不足的藥物預后ΔCBF
2 討 論
本研究給出的Lensions-vCBF分析方法使基于磁共振ASL的CBF檢測應用在病灶ROI提取、跨影像組精準定位、精確vCBF量化方面取得了突破,改變了rCBF手工定位、結構模糊、無法精準量化的格局,使病灶區域的vCBF精準量化成為了更有效的檢測分析方法。通過病例分析顯示,Lensions-vCBF分析方法對于急性腦梗死和慢性腦供血不足都能夠起到很好的精準量化效果。相較于傳統的rCBF方法,Lensions-vCBF分析方法依靠病灶區域提取或者在結構像定義ROI的方式解決了rCBF模糊定位的問題;通過影像跨組索引解決了精準量化的問題;通過對vCBF的數據分析解決了對病灶的空間分布量化問題。Lensions-vCBF適用于與腦血流量有關的各種腦病[9-18]的精確量化及藥物預后評價指標。由于ASL的CBF值是瞬時腦血流量,后續研究中需完善多TI值數據采集測量,以完善CBF的準確性,同時為計算vCBV提供良好的數據支持,對ROI形成vCBF、vCBV數據組評價。本團隊將繼續探索Lesions-vCBF在腦病診斷、評價領域更多的應用場景,特別是功能磁共振靜息態、任務態大腦灰質ROI腦血流量的空間分布變化。
3 小 結
通過影像組跨組檢索、精準量化的研究方法,將vCBF指標有效地與病灶范圍、FLAIR結構像進行了融合;既解決了rCBF彩圖無結構影像使ROI定位模糊的問題,同時也取得了病灶范圍的vCBF可視化結果,這為病灶及其周邊的vCBF量化研究帶來了新的手段和方法。急性缺血性腦卒中病例應用Lesions-vCBF計算分析方法采用以解剖結構為背景、適形病灶ROI、與CBF三融合實現對新發腦梗死灶中vCBF定量測量,從而發現DWI高信號區不都是核心梗死區,并提供了可靠的量化數據支撐,證明vCBF空間分布量化的優勢。此分析方法同樣適用于其他類型的血管性癡呆(VD)病灶分析量化,或者檢測腦腫瘤內血流量空間分布情況提供了一種無創安全可靠易行的腦灌注腦血流量測評量化技術。

