硒、硅對鹽脅迫下小麥光合生理及養分累積的影響
白鳳麟,樊雨荷,李 琳
(長治學院生命科學系,山西長治 046011)
作為世界范圍內廣泛種植的谷類作物之一,小麥(TriticumaestivumL.)含有高比例的碳水化合物、蛋白質、礦質營養及膳食纖維,是全球85%以上人類和牲畜的主要食物原材料[1]。然而,小麥產區往往處于干旱或半干旱環境,長期灌溉和施肥使土壤鹽漬化加劇,然而現推廣的大多數小麥品種對土壤鹽耐受性較低、敏感性較強[2]。土壤NaCl含量累積是導致鹽漬化的主要因素,且Cl-和Na+溶解性極強,易隨著水分被植物吸收進入體內而造成累積[3]。高鹽脅迫導致的滲透脅迫對植物的水分吸收、細胞伸長和葉片生長發育具有顯著的負面影響,此外植物器官中過量的Na+積累,會抑制蛋白質生物合成、各種酶促反應和光合作用過程[4]。在過去的幾十年中,通過傳統育種和基因工程方法開發耐鹽小麥品種取得了一定的成果,但由于時間限制、技術要求苛刻及品種收益等問題,使其無法全面普及[5]。目前,一些物理性方法已應用于降低土壤鹽分脅迫,其中為植物提供有益元素被認為是最具成本效益、最簡便的可持續策略之一[6]。
硅(Si)作為一種有益元素,可以提高植物對鹽脅迫的抵抗力。研究表明,施Si均可增強谷物作物、油料作物、蔬菜以及煙草等植物的抗逆能力[7]。Si介導植物緩解鹽脅迫的主要潛在機制已被逐漸揭示:韌皮部中的Si沉積可減少Na+向木質部的質外轉運,從而降低Na+的向上轉移[8]。如Bosnic等的研究表明,Si介導Na+通過木質部轉運到枝條及通過直接誘導ZmSOS1、ZmSOS2、ZmHKT1和ZmNHX基因的表達從而調節Na+積累和分隔[9]。多項研究表明,Si可通過調節激素和激素反應基因的表達以增強植物的耐鹽性[10],以及通過調節水通道蛋白和滲透調節物質的生物合成與代謝來減輕鹽誘導的滲透脅迫[11]。
硒(Se)是人類和動物健康不可缺少的微量元素,也是對植物生長發育及品質形成的有益元素[12]。大量研究表明,Se可以緩解不同環境壓力帶來的不利影響,如重金屬脅迫、溫度脅迫、干旱和鹽脅迫[13]。Se可增強潛在的脅迫防御系統,包括刺激抗氧化酶和非酶活性(即抗氧化系統);此外,Se可改善光系統效率光合系統Ⅱ(PSⅡ)、促進葉綠素熒光代謝、減少葉綠素分解[14]。研究表明,Se介導的鹽脅迫緩解的作用效果及其機制取決于Se的劑量、化學形式、鹽度水平、植物種類以及施用條件等[15]。目前關于Si、Se對植物非生物脅迫的影響主要集中于對重金屬脅迫的作用,且多以單一施用為主,關于小麥和鹽脅迫的研究鮮有報道。基于此,本研究探索Se、Si相互作用對小麥光合生理代謝及養分累積的影響,研究結果將有助于為Se、Si運用于小麥生產提供理論依據。
1 材料與方法
1.1 供試材料
試驗于2021年3—6月在山西農業大學谷子研究所進行。供試小麥品種為晉麥47,種子來自山西農業大學谷子研究所。種子采用0.5% NaClO進行表面滅菌10 min,然后用去離子水沖洗數次并浸泡 6 h,最后放置于鋪墊潤濕濾紙的培養皿中,在28 ℃培養箱暗處理催芽24 h。供試鹽為氯化鈉(NaCl),硒為五水亞硒酸鈉(Na2SeO3·5H2O),硅為九水偏硅酸鈉(Na2SiO3·9H2O),均購自索萊寶化學試劑公司。供試土壤取自山西農業大學試驗田(111°28′39″E,35°19′21″N),土壤類型為褐土。土壤經風干后混勻過4 mm網篩,土壤pH值為7.57,土壤全氮含量為1.03 g/kg,堿解氮含量為 67.62 mg/kg,有效磷含量為22.92 mg/kg,速效鉀含量為131.56 mg/kg。
1.2 試驗設計
試驗設置3因素復合試驗,因素1:施用 150 mmol/L NaCl,因素2:施用30 mmol/L Si(Si4+),因素3:施用30 mmol/L Se(Se4+)。共5個處理,CK:不施NaCl、Si、Se;SS:施用NaCl,不施Si、Se;SS+SI:施用NaCl、Si,不施用Se;SS+SE:施用NaCl、Se,不施用Si;SS+SI+SE:施用NaCl、Si、Se。每個處理重復5次。盆栽裝置為塑料桶,盆高為 16 cm,上口徑為 14 cm,底徑為10 cm。每盆裝3 kg土,施入200 mL Hogland氏營養液,并保持75%田間持水量。每盆施入小麥種子15粒,出苗后減至6株。小麥幼苗進入分蘗期(40 d)后,施入200 mL NaCl溶液;Se、Si皆采用外源噴施,每次噴施5 mL,隔天噴施,連續10次,總量為50 mL。為保證幼苗的正常生長及養分平衡,每2周向培養基質中加入100 mL Hogland氏營養液。種植期間不定時補充水分,其他管理措施同小麥培育方法。
1.3 樣品采集及測定分析
1.3.1 小麥光合色素含量及葉綠素熒光參數的測定 培養結束后光合色素(葉綠素a、葉綠素b、類胡蘿卜素)含量測定皆采用丙酮-乙醇混合浸提,采用紫外分光光度計(UV-1800,上海美譜達儀器有限公司)在665、648、653 nm處測定,具體步驟參照高俊鳳的方法[16]。采用葉綠素熒光儀(Yaxin-1161G,北京雅欣理儀科技有限公司)測定葉片的熒光動力學參數:初始熒光(Fo)、最大熒光(Fm)及正常光照下的初始熒光(Fo′)、最大熒光產量(Fm′)及穩態熒光(Fs)。葉綠素熒光參數中,PSⅡ的最大光化學效率=Fv/Fm=(Fm-Fo)/Fm,非光化學熒光猝滅系數NPQ=(Fm-Fm′)/(Fm-Fo),實際光化學效率ΦPSⅡ=(Fm′-Fs)/Fm′,光化學熒光猝滅系數qP=(Fm′-Fs)/(Fm′-Fo′)[17]。
1.3.2 小麥光合氣體交換參數及光合酶活性測定 采用通過便攜式CIRAS-3光合作用系統(Ciras-3,PP Systems,USA)測定小麥葉片的凈光合速率(Pn)、胞間CO2濃度(Ci)、氣孔導度(Gs)和蒸騰速率(Tr)等指標。內置葉室溫度設置為(25±2)℃,CO2通量為540 μmol/mol,光量子密度為 900 μmol/(m2·s)[18]。光合作用酶包括核酮糖 1,5-二磷酸羧化酶(RuBPCase)、果糖-1,6-二磷酸酯酶(FBPase)及果糖-1,6-二磷酸醛縮酶(FDA),采用ELISA試劑盒(GenMed)測定,均購自合肥萊爾生物科技有限公司,其產品型號分別為 LE-Y1799、LE-Y1739及YX-C-C702。
1.3.3 小麥葉片養分含量測定 培養結束后,單盆單株收獲小麥植株,將葉片分離并在105 ℃殺青 30 min,75 ℃烘干至恒質量,記錄其干物質含量,采用研磨機粉碎過0.85 mm篩孔。小麥葉片采用濃硫酸消化,采用凱氏定氮法測定氮(N)含量。采用硝酸高氯酸混合酸處理消化葉片,并使用電感合成等離子體原子發射光譜儀(iCAP 7000,Thermo Scientific,USA)測定磷(P)、鉀(K)、鈣(Ca)、鎂(Mg)、鐵(Fe)、鋅(Zn)等元素的含量。
1.4 數據處理與統計分析
采用Microsoft excel 2013進行數據整理,采用IBM SPSS 19.0軟件進行試驗數據統計分析(α=0.05),采用Origin 2021進行圖形繪制。
2 結果與分析
2.1 硒、硅對鹽脅迫下小麥光合色素含量的影響
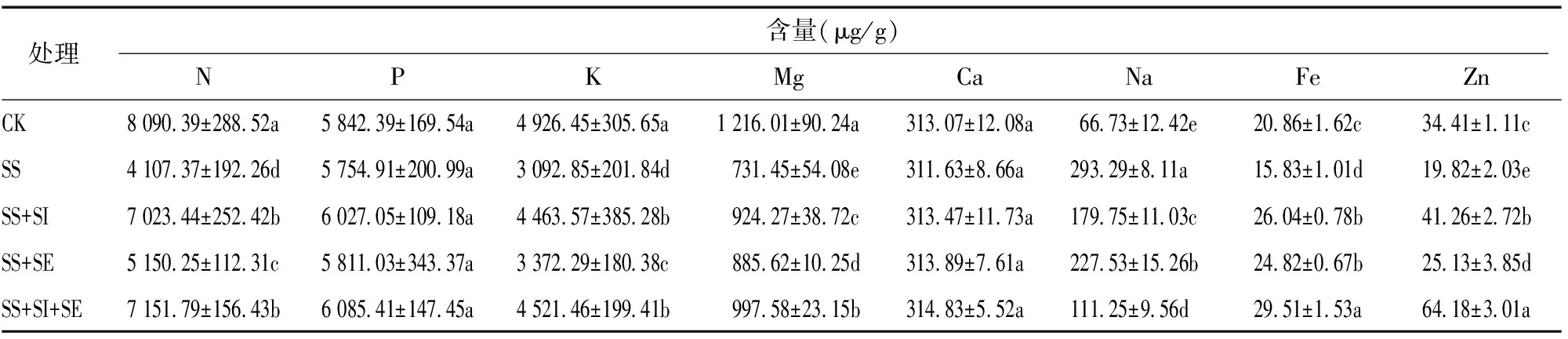
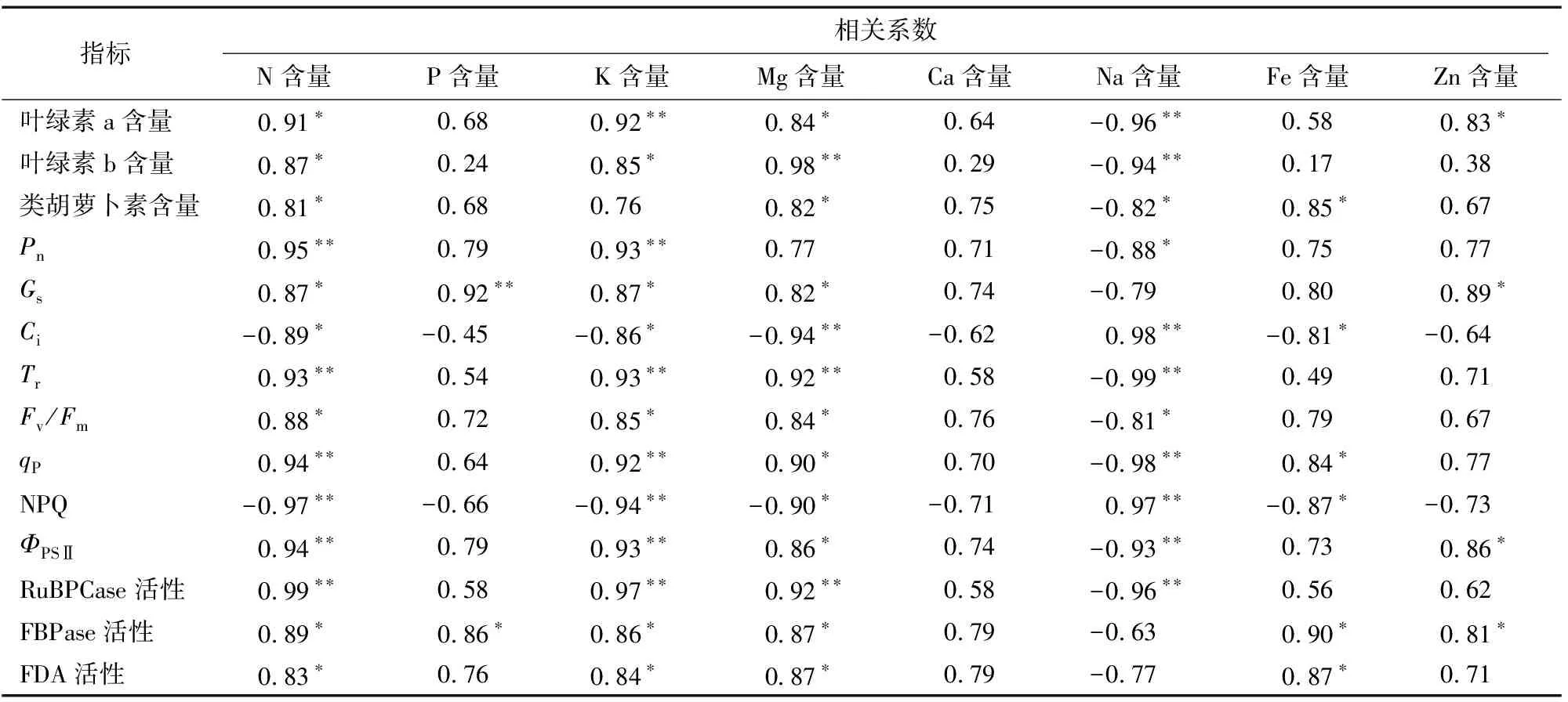
由圖1可知,光合色素中,整體而言,小麥葉片以葉綠素a含量大于葉綠素b和類胡蘿卜素含量,各光合色素含量呈葉綠素a>葉綠素b>類胡蘿卜素。由圖1-A可知,在葉綠素a含量中,各處理呈SS 由圖2-A可知,凈光合速率(Pn)中,以SS+ SI+SE處理最高,CK、SS+SI處理其次,三者無顯著差異,皆顯著大于SS、SS+SE處理,且SS+SE處理亦顯著大于SS處理。氣孔導度(Gs)中,兩兩處理間均差異顯著,其中以SS+SI+SE處理最高,CK、SS、SS+SI、SS+SE處理較其分別顯著降低13.55%、41.08%、4.60%、29.78%(圖2-B)。由圖2-C可知,胞間CO2濃度(Ci)中,以SS處理最高,CK、SS+SI、SS+SE、SS+SI+SE處理較其分別顯著降低34.58%、13.22%、13.62%、29.94%;與CK處理相比,硒硅處理(SS+SI、SS+SE、SS+SI+SE)的Ci提高7.10%~32.66%,其中SS+SI、SS+SE處理均顯著大于CK。由圖2-D可知,蒸騰速率(Tr)中,各處理呈SS 由圖3-A可知,PSⅡ最大光化學效率(Fv/Fm)中,以SS處理最低,SS+SE處理其次,兩者間差異顯著;其中CK、SS+SI、SS+SI+SE較SS和SS+SE處理分別顯著提高17.46%、19.05%、17.46%和4.23%、5.63%、4.23%。由圖3-B可知,光化學淬滅系數(qP)中,各處理呈SS 由圖4-A可知,核酮糖1,5-二磷酸羧化酶(RuBPCase)活性中,以CK處理最高,余下處理較其顯著降低6.54%~26.98%;以SS處理最低,SS+SI、SS+SE、SS+SI+SE處理較其分別顯著提高27.27%、14.23%、28.03%,其中SS+SI、SS+SI+SE處理顯著大于SS+SE處理。由圖4-B可知,果糖-1,6-二磷酸酯酶(FBPase)活性中,以 SS+SI+SE處理最高,其與SS+SI處理無顯著差異,兩者均顯著大于余下處理;以SS處理最低,CK、SS+SI、SS+SE、SS+SI+SE處理較其分別顯著提高49.43%、77.34%、57.38%、86.20%。由圖4-C可知,果糖-1,6-二磷酸醛縮酶(FDA)活性中,以SS處理最低,余下處理較其顯著提高29.06%~39.02%;與CK處理相比,硒硅處理(SS+SI、SS+SE、SS+SI+SE)變幅為-4.08%~3.38%,但四者間均無顯著差異。 由表1可知,鹽脅迫下外源施用Se、Si影響了小麥葉部對礦質養分的吸收。在N、K、Mg含量中,各處理均表現為SS 表1 硒、硅對鹽脅迫下小麥養分含量的影響 由表2可知,Ci、NPQ與養分指標(N、P、K、Mg、Ca、Fe、Zn含量)呈負相關,其中與N、K、Mg、Fe存在顯著或極顯著相關關系,Ci、NPQ與Na含量均呈極顯著正相關關系。就N含量而言,其與所有光合指標均存在明顯的相關關系;相反地,Na含量與所有光合生理指標亦存在明顯的反向相關關系。就P含量而言,其僅與Gs、FBPase活性呈顯著或極顯著正相關關系。就K含量而言,其僅與類葫蘆卜素含量無顯著關系,與其他指標均呈顯著或極顯著相關關系。就Mg含量而言,其僅與Pn無明顯相關關系。Ca含量與所有光合生理指標均無明顯的相關關系。Fe、Zn含量中,Fe含量與類胡蘿卜素含量、Fe含量與qP、Fe含量與FDA、Fe含量與FBPase活性、Zn含量與葉綠素a含量、Zn含量與Gs、Zn含量與ΦPSⅡ和FBPase活性均存在顯著的正相關關系。 表2 小麥葉片養分含量與光合生理指標間的相關分析 鹽脅迫可通過活性氧累積、抑制光化學反應等影響光合進程,從而導致光合效率降低進一步降低植物生物量[19]。葉綠素a、葉綠素b及類葫蘆卜素是主要光合色素,影響光能吸收、分配與轉化過程的基本物質[18]。此外,光合色素含量可反映植物的健康狀況和植物對脅迫環境的耐受能力[20]。本研究中,150 mmol/L NaCl處理下,小麥葉綠素a、葉綠素b、類胡蘿卜素含量及葉綠素a含量/葉綠素b含量顯著降低,這可能是由于葉綠體膜擴張和內囊體中過高的Na+累積所致[21]。一般而言,葉綠素含量與光合效率呈正相關,葉綠素含量的降低則意味著光合作用速率降低且不可逆轉[22]。本研究中,鹽脅迫處理下,光合色素含量指標均呈SS 在逆境條件下,導致光合效率下降的因素主要分為氣孔限制或非氣孔限制,當氣孔導度(Gs)和胞間CO2濃度(Ci)同時降低時則為氣孔限制,反之,則由葉綠體基粒活性下降的非氣孔限制所引起[23]。本研究中,鹽脅迫下無論施硒、硅與否,凈光合速率(Pn)與Gs、Ci規律不一致,且施入硒、硅條件下Pn、Gs更高,Ci降低,表明鹽脅迫下硒、硅皆可通過非氣孔限制調節類囊體基粒反應從而改善光合作用進程。核酮糖1,5-二磷酸羧化酶(RuBPCase)、果糖-1,6-二磷酸酯酶(FBPase)及果糖-1,6-二磷酸醛縮酶(FDA)等光合酶的活性與光合機構完整度密切相關[20]。核酮糖1,5-二磷酸加氧/羥縮酶(RuBPCase、FBPase、FDA)是影響葉片固定CO2的主要酶類,在保證光合作用過程中的底物生成具有重要作用[24]。本研究中,鹽脅迫處理(SS)下,RuBPCase、FBPase、FDA活性皆最低,且顯著低于CK處理,這表明鹽脅迫導致的光合結構受損是影響光合效率的又一因素。 植物對光能的吸收和轉化主要分為3個過程:葉綠素熒光吸收,光合電子傳遞以及光合熱散失[20]。PSⅡ最大光化學效率(Fv/Fm)是評價PSⅡ反應中心光能的初級轉化效率;實際光化學效率(ΦPSⅡ)是PSⅡ在反應中心部分關閉時的實際捕光效率,ΦPSⅡ反映了反應中心光合傳遞的凈收益值;光化學淬滅系數(qP)反映著光化學電子轉移中光色素捕獲的光能比例[25-26]。非化學淬滅系數(NPQ)是反映PSⅡ反應中心吸收的光能無法用于光合電子傳遞,而以熱能形式損失掉的光能部分[17,27]。本研究中,鹽脅迫處理(SS)下,與CK處理相比,Fv/Fm、qP、ΦPSⅡ顯著降低,而NPQ顯著提高,在此基礎上外源施用硒、硅條件下Fv/Fm、qP、ΦPSⅡ提高,NPQ降低;這表明在鹽脅迫環境下施用硒、硅提高了PSⅡ反應中心的活力,激發了光合電子傳輸效率。這可能是由于Se和Si本身是植物光化學及能量代謝重要蛋白質的催化物質,因此提高PSⅡ中心捕獲的激發能效率,減少激發熱能在PSⅡ天線中的散失[18]。 鹽脅迫會導致特定的離子毒性和植物生長抑制,Na+的過量積累對植物細胞有毒害作用,可導致新陳代謝紊亂和養分不足[28]。本研究中,在鹽脅迫處理中,Na含量顯著增加,而K含量顯著降低,這表明葉片在吸收K+和Na+之間存在競爭關系;然而鹽脅迫下施用硒、硅均顯著降低了Na含量并增加了K含量。N、P、Mg在光合代謝中起著重要作用,P、Mg含量與鹽脅迫下的光合速率呈顯著正相關[29]。在本研究中,鹽脅迫下N、P、Mg以及微量營養素(Fe和Zn)含量顯著降低,這可能是由于鹽分對N的獲取和利用的干擾所致[30],從而降低了葉綠素合成和光合作用效率。然而,在硒硅處理(SS+SI、SS+SE、SS+SI+SE)下N、P、Mg含量始終高于SS處理,這可能是由于低硒、硅與Na代謝具有串聯干擾,從而增強了微量營養素的吸收[20]。 綜上,鹽脅迫可導致葉片光合色素的分解、阻礙氣體交換與葉綠素熒光反應、降低光合酶活性以及抑制葉片養分累積,在此基礎上施用硒硅有效改善了上述光合生理及養分吸收,且相關分析結果表明,養分含量與光合生理指標間存在明顯的相關關系,表明硒硅可通過促進養分累積緩解葉片光合生理代謝,以硒硅組合施用最佳。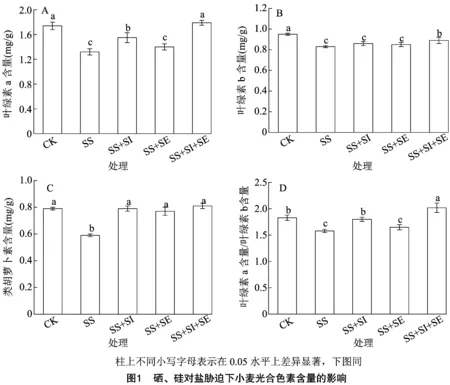
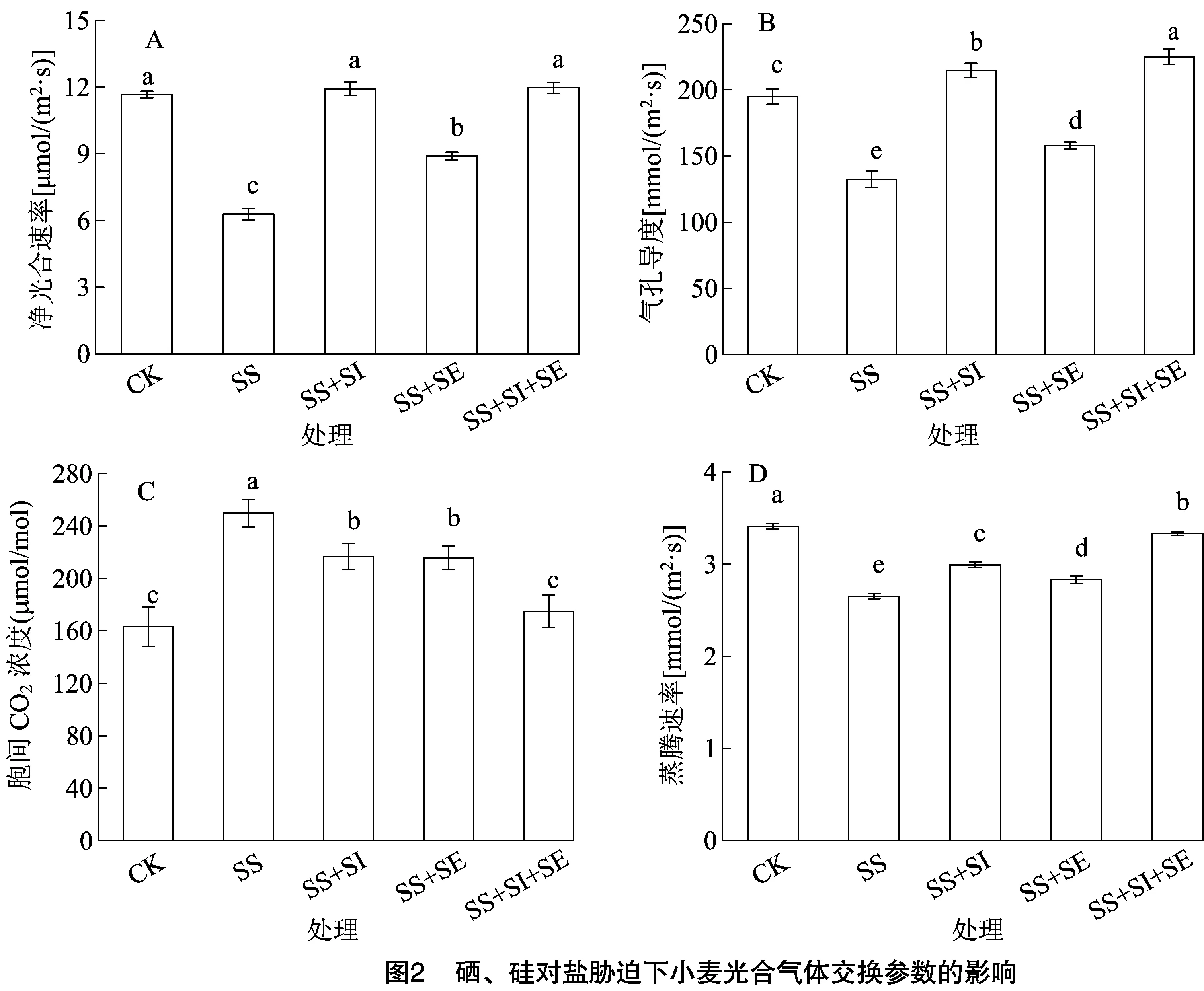
2.2 硒、硅對鹽脅迫下小麥光合氣體交換參數的影響
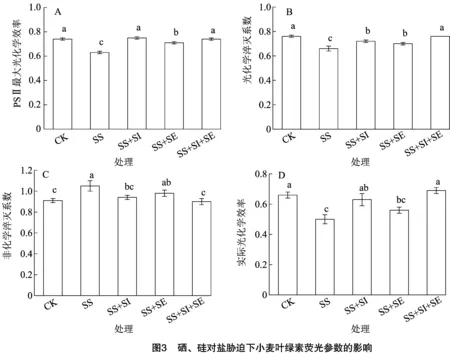
2.3 硒、硅對鹽脅迫下小麥葉綠素熒光參數的影響
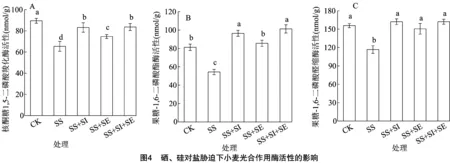
2.4 硒、硅對鹽脅迫下小麥光合酶活性的影響
2.5 硒、硅對鹽脅迫下小麥葉片養分含量的影響
2.6 小麥養分含量與光合生理指標間的相關分析
3 結論與討論

