銅脅迫下的西瓜食酸菌轉錄組分析
宋金迪,劉 君,孫玉芳,優麗圖孜·乃比,陳寶強,頡兵兵
(新疆農業大學生命科學學院,烏魯木齊 830052)
0 引 言
【研究意義】細菌性果斑病(Bacterial fruit blotch,簡稱BFB)在葫蘆科植物各個部位均可發病,如子葉、果實等,發病的果實表皮產生水浸斑,內部果肉腐爛且種子會帶菌[1]。細菌性果斑病給一些商品西瓜地造成的損失可達50%甚至90%以上[2]。細菌性果斑病的病原菌-西瓜食酸菌,種群內存在銅抗性的菌株,導致生產中以銅制劑為主的殺菌劑對細菌性果斑病防控基本無效[3]。解析病菌的抗銅分子機制,對發掘防控病菌的新方法、新途徑有重要意義。【前人研究進展】目前已報道的抗銅相關基因為:編碼P型ATP酶的copA,在西瓜食酸菌亞群I和亞群II菌株中均存在,其缺失可導致菌株在一定銅濃度下不能生長[4];多銅氧化酶基因cueO,其突變菌株對硫酸銅敏感性增強[5];類cueR與類cusB,在研究組前期工作中發現,分別與大腸桿菌(Escherichiacoli)的Cue和Cus抗銅系統組分同源[6,7],對該菌的抗銅性有重要貢獻。【本研究切入點】對西瓜食酸菌的銅抗性機制認知至今較少,高通量測序技術是研究基因表達模式的有力工具。通過轉錄組學數據預測西瓜食酸菌響應脅迫的相關代謝途徑、通路,需研究銅脅迫下病菌反饋機制。【擬解決的關鍵問題】采用RNA-Seq技術,比較不同銅培養條件下西瓜食酸菌FC440菌株轉錄組水平上基因表達的差異,解析細菌響應銅脅迫相關的路徑和特征,為分析該菌抗銅機制的相關研究提供參考依據。
1 材料與方法
1.1 菌 株
西瓜食酸菌FC440菌株分離自感病甜瓜(CucumismeloL.),由南京農業大學胡白石教授惠贈,參考用基因組為西瓜食酸菌AAC00-1菌株(GenBank No.NC_008752.1)。
1.2 方 法
1.2.1 樣品收集
將保存的甘油菌在含30 μg/mL Amp及1.25 mmol/L Cu2+的KMB(King’s Medium B)培養基上活化,28℃培養48 h。挑取單菌落分別接種于含30 μg/mL及含有0.625 mmol/L Cu2+(該處理組標注為T)或者含0 mmol/LCu2+(此對照組標注為CK)的NB(nutrient broth)培養基中,于220 r/min、28℃過夜培養至飽和菌液,再以1∶10進一步擴大培養至OD600值達0.5~0.8,將上述菌液于4℃、10 000 r/min離心后收集菌體并置于液氮保存備用。處理組(T)與對照組(CK)的樣本均設置3個重復。
1.2.2 RNA提取和轉錄組測序
菌體樣本總RNA提取,采用Trizol裂解法進行RNA提取,提取后的總RNA通過凝膠電泳檢測其完整性以及是否受到基因組污染,采用超微量分光光度儀(Titertek-Berthold Colibri)檢測RNA濃度。檢測合格后送至南京派森諾基因科技有限公司對總RNA純化后構建文庫,并利用Illumina高通量測序平臺HiSeq2000對文庫進行雙末端測序(Paired-End, PE)測序。
1.2.3 轉錄組數據處理
對每個樣本的Raw Data數據分別進行Reads數、堿基量、Q30(即質量值大于或等于Q30的堿基所占的百分比)、模糊堿基所占百分比、以及Q20(%)和Q30(%)統計。將測序中包含的一些帶接頭、低質量的Reads采用Cutadapt(Version 1.2.1)[8]去除3'端的接頭,平均質量分數不低于Q20,采用FastQC(http://www.bioinformatics.babraham.ac.uk/projects/fastqc)分析堿基質量。使用序列比對軟件Bowtie2[9]對篩選后的高質量數據(http://bowtie-bio.sourceforge.net/index.shtml)與參考基因組比對,再組裝合并得到完整基因并通過KEGG、GO等數據庫進行基因信息比對注釋。
1.2.4 差異基因表達及富集
FPKM(Fragments Per Kilobase Million)值作為基因轉錄水平的一個依據,衡量每個基因在樣品中的表達量[10]。不同處理樣本的mRNA轉錄本的表達量通過FPKM計算,使用R語言計算相關系數,再以相關系數觀察不同處理樣本的可重復性。使用HTSeq 0.6.1p2(http://www-huber.embl.de/users/anders/HTSeq)統計比對到每一個基因上Read Count值作為基因的原始表達量,將該數值采用DESeq(version 1.18.0)對基因表達進行差異分析,篩選差異表達基因,按照表達倍數差異log2|fold change|>1,顯著性P<0.05進行篩選差異表達基因,計算出上下調基因數量。所有分組的差異表達基因,使用R語言Pheatmap軟件包對基因和樣品進行雙向聚類分析。采用Euclidean方法計算距離,層次聚類最長距離法(Complete Linkage)進行聚類。采用R語言 ggplots2 軟件包繪制火山圖和 MA 圖,MA 圖用于評估文庫標準化程度[11]。
1.2.5 轉錄組數據的qPCR驗證
隨機選取15個基因進行qPCR以驗證所得轉錄組數據的可靠程度。使用primer 5設計引物,以不同處理的菌體提取的RNA經反轉錄獲得的cDNA為樣本,qPCR反應體系(20 μL):cDNA模板100 ng,正反向引物(10 μM)各0.4 μL,2×TransStartGreen qPCR SuperMix 10 μL,Passive Reference Dye(50×)(optional)0.4 μL,Nuclease-free Water 8.8 μL。采用兩步法進行qPCR,反應條件為:94 °C,5 s;60 °C,30 s共45個循環。采用2^(-ΔΔCt)法(Livak法)計算相對表達量,比對Log2FoldChange值與-ΔΔCt值的整體變化趨勢驗證轉錄組測序結果的準確性。表1
2 結果與分析
2.1 銅脅迫處理下FC440菌株轉錄本堿基質量
2.1.1 堿基質量
研究表明,共得到26.3 Gb Clean Data,各個樣品的Q30堿基百分比均不小于91.82%,Clean Data中N的比例均小于0.5%,堿基質量較好。Clean Data中GC含量(即 Clean Data中G和C兩種堿基占總堿基的百分比)在64.33%~64.58%,該菌具有高的GC含量。表2
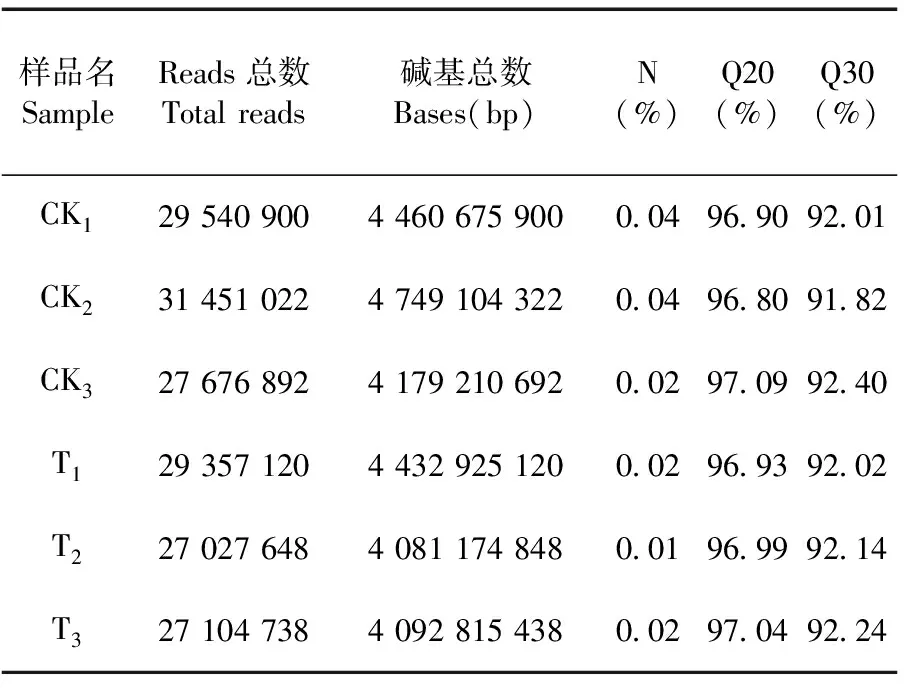
表2 銅脅迫處理下FC440菌株 轉錄本的堿基質量統計Table 2 Base mass statistics of the transcript of Acidovorax citrulliFC440 under copper stress
2.1.2 參考基因組比對
研究表明,對照組和處理組樣品間有99.55%以上的單映射比對率,而多映射讀取比例在3.68%以下,單映射比對率高,測序數據質量較好、可信度高。表3
2.2 基因表達及富集
2.2.1 樣品相關性檢驗
研究表明,T1和T2和T3、CK1和CK2和CK3之間r2大于0.9,樣本的相關性較強。T1和T2和T3均位于PC1的10附近,CK1和CK2和CK3均位于PC1的-10附近,樣本內離散度低,而CK和T位于PC1的兩端離散度高,差異顯著。樣本的重復性好。圖1~2
2.2.2 聚類分析
研究表明,同一處理各樣本的基因在圖中的顏色呈現基本一致,基因表達模式相同,同組樣本每列的顏色顯示基本一致,基因表達水平相似且樣本的重復性好。圖3
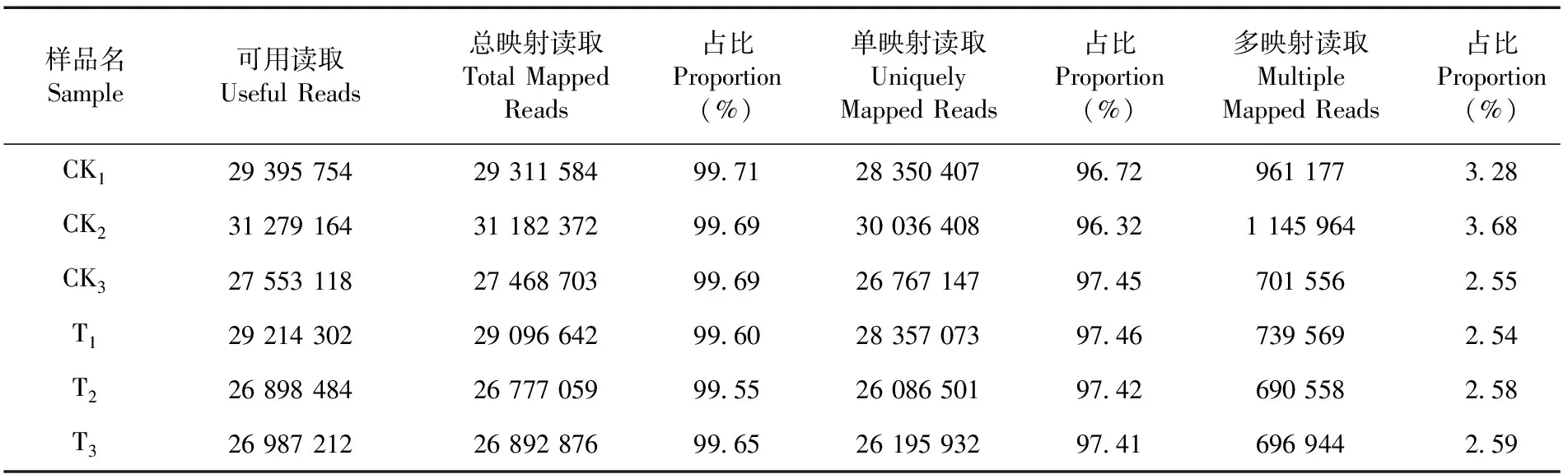
表3 FC440菌株的參考基因組比對統計Table 3 Reference genome comparison of Acidovorax citrulliFC440
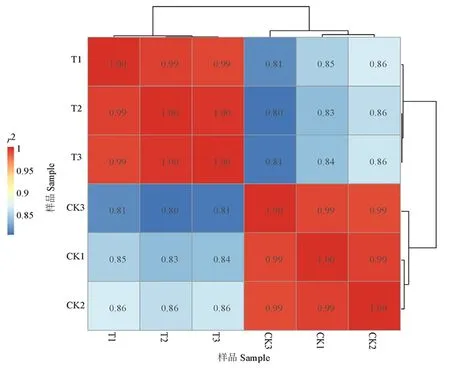
圖1 FC440菌株銅脅迫處理下的相關性檢驗
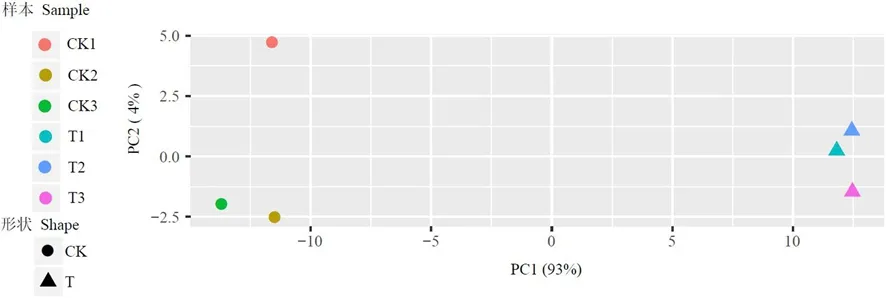
圖2 FC440菌株銅脅迫處理下的PCA變化
2.3 差異基因統計
研究表明,銅脅迫下,西瓜食酸菌4 344個表達基因中差異表達的有466個,其中上調表達的和下調表達的分別為266個(占57%)和200個(占43%)。文庫標準化后基因的表達量呈上下對稱分布,表達差異趨勢不隨基因表達量變化而發生偏向,文庫標準化程度較好。表達差異的基因整體分布對稱。圖4~5
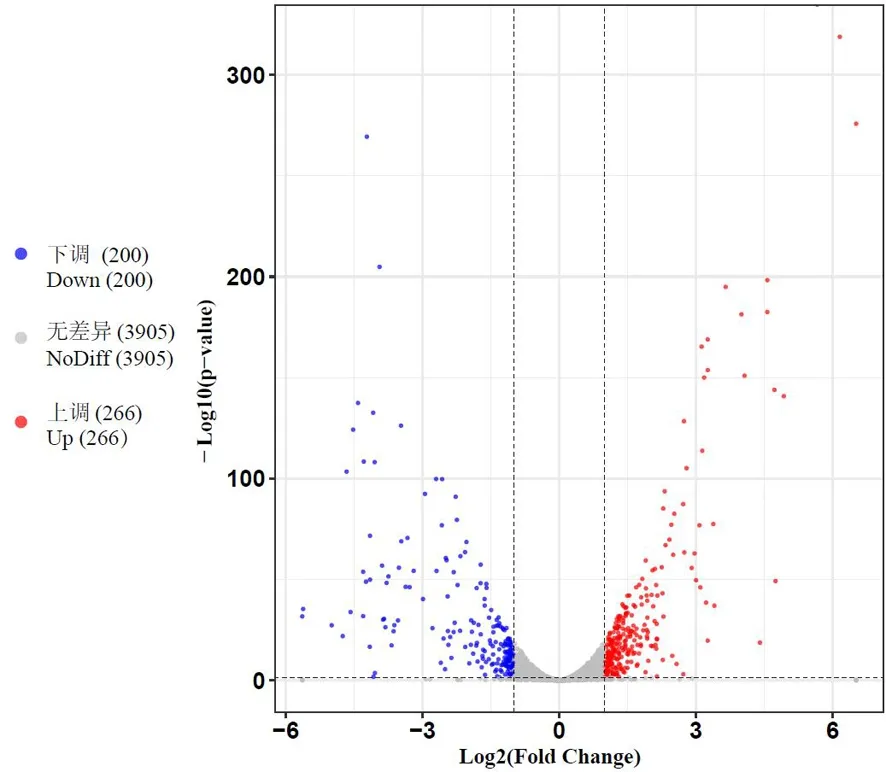
圖5 FC440菌株銅脅迫處理組下的差異表達基因火山圖
2.3.1 差異表達基因的GO功能注釋
研究表明,獲得253個GO條目,富集于329個差異表達的基因,這些基因的占比分別對應于: 28.3%的生物過程中的代謝過程(metabolic process),18.5%的氧化還原過程(oxidation-reduction process), 19.5%的分子功能中的催化活性(catalytic activity),13.4%的綁定(binding), 14%的細胞組分中膜(membrane)。
上調表達差異極顯著的基因(上調表達量超過8倍且P-value<0.01)歸類于:生物過程的轉運(transport)、跨膜轉運(transmembrane transport)、定位(localization)、定位的組建(establishment of localization);分子功能的催化活性(catalytic activity)、綁定、水解酶活性(hydrolase activity)、輔因子(cofactor binding)等,其中催化活性和綁定相關的基因數量最多。下調表達差異極顯著的基因(下調表達量超過8倍且P-value<0.01)歸類于:生物過程的氧化還原過程、代謝過程;分子功能綁定、陽離子綁定(cation binding)、金屬離子綁定(metal ion binding)等。表達差異極顯著的基因中,生物過程相關基因數量多、分布廣,分子功能綁定相關的基因數量最多,細胞組分的膜、膜組分基因數量相對較少。圖6
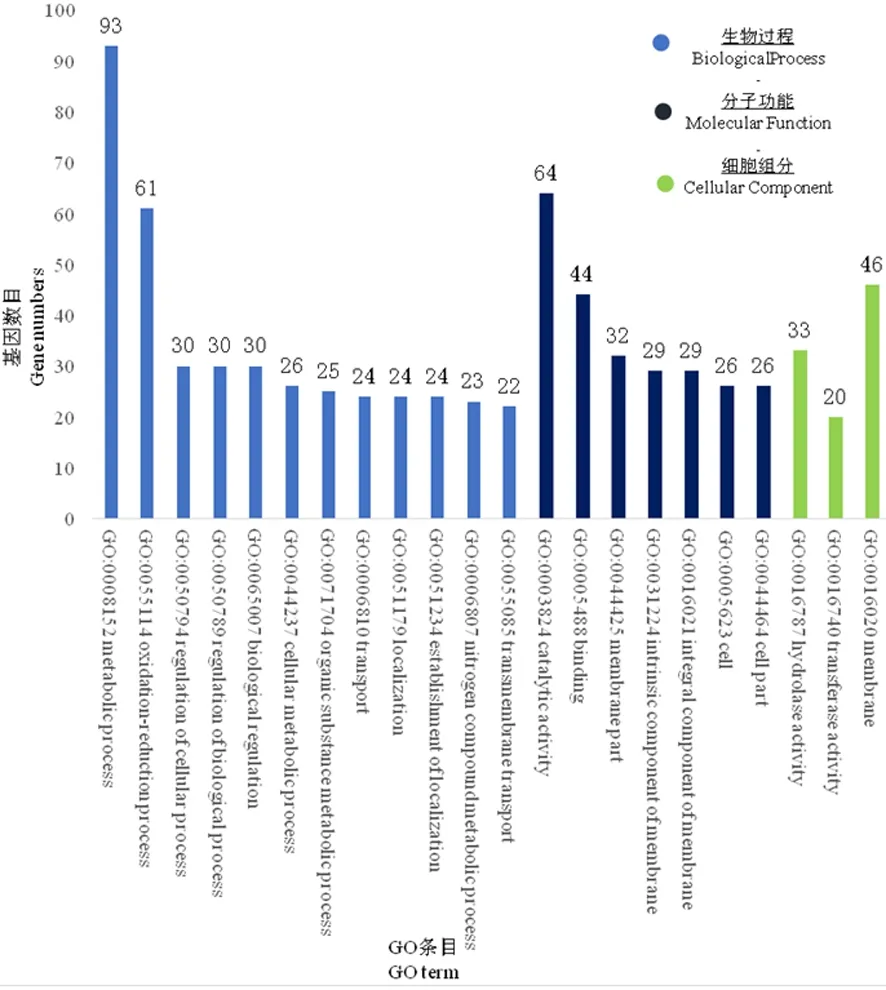
圖6 FC440菌株銅脅迫處理下的差異表達基因GO功能富集
2.3.2 差異表達基因KEGG富集分析
研究表明,差異表達的基因富集在128個通路,富集程度最顯著的前20個通路中,富集基因數量含3個以上的通路有:雙組分系統通路(ko02020)22個(下調18個、上調4個),丙酮酸代謝(ko00620)通路,鞭毛組裝(ko00790)通路,氧化磷酸化(ko00190)通路,葉酸合成(ko00790)通路,糖酵解/糖異生代謝(ko00010)通路,檸檬酸循環(ko00020)通路,纈氨酸、亮氨酸和異亮氨酸的降解(ko00280)通路(上調6個,下調1個),谷氨酸代謝途徑(ko00480(上調5個)以及心肌收縮(ko04260)通路。
上調表達差異基因最多的ABC(ATP-binding cassette)轉運通路(ko02010)涉及140個基因,其中差異表達基因19個(上調17個,下調2個),通路。下調差異表達基因最多的雙組分系統通路涉及124個基因,差異表達基因22個(下調18個,上調4個)。圖7
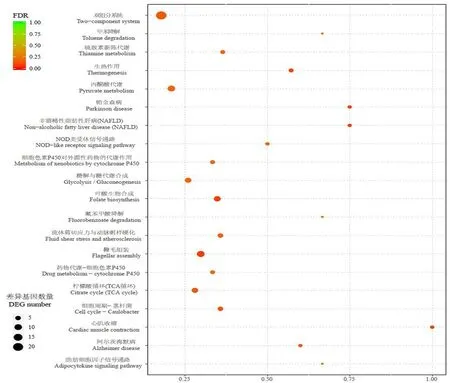
注:縱坐標為 KEGG Pathway 條目;橫坐標為Richfactor,圖中圓點的大小表示注釋到該通路的差異基因的多少,顏色表示該通路的顯著性 FDR 值
2.3.3 轉錄組數據的qPCR驗證
研究表明,選取15個隨機挑選基因,參照的管家基因為rpoB,該15個基因的相對表達量結果與轉錄組測序數據中相應基因的相對表達量在上調或下調表達倍數相近,表達趨勢一致,轉錄組數據可靠。圖8
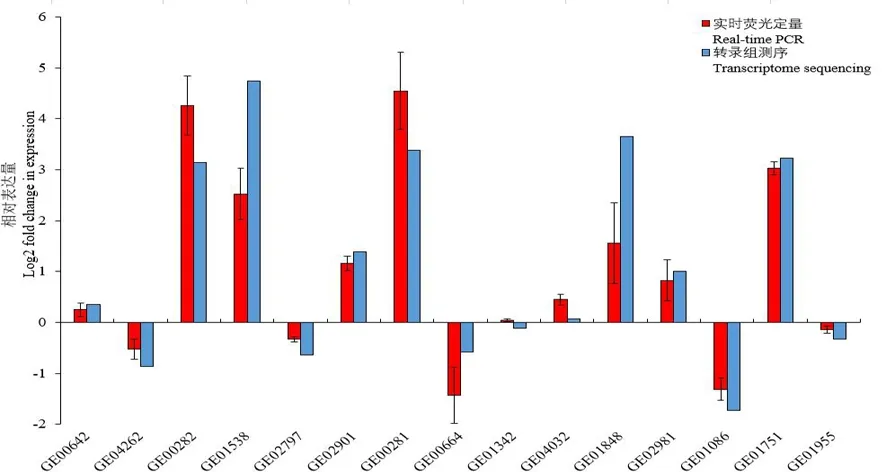
圖8 銅脅迫處理后西瓜食酸菌15個基因相對表達量
3 討 論
西瓜食酸菌其他菌株如M6菌株和pslb65菌株相似[9,12]。樣品間相關性評估指標皮爾遜相關系數(Pearson's correlation coefficient,r)[13]r2越接近1,2個樣品的相關性越強。細菌為應對環境中重金屬或離子濃度過量的傷害,在長期進化中形成了多種胞內(重)金屬離子處理方式,如氧化還原反應、跨膜轉運、胞內束縛沉淀等等,以維持其胞內金屬離子的穩態,與金屬代謝和(重)金屬離子抗性相關的基因位于細菌基因組或質粒中[14]。一個具有(重)金屬抗性的細菌通常含有很多抗性系統,其(重)金屬抗性是多個系統互作的結果[15]。西瓜食酸菌中已經被驗證存在類CueO多銅氧化酶,在細菌中該酶的功能是將周質的Cu+氧化成滲透性較弱、毒性較小的Cu2+以減輕對細胞膜損傷,進而再通過離子外排系統排出細胞外膜;那么,在西瓜食酸菌中有怎樣的類Cue系統,類CusB[6]、TolC[16]和ATP驅動的CopA[4]對應的系統及其組分,各種系統如何協作進行離子的外排等等問題,研究中銅脅迫下西瓜食酸菌轉錄組數據顯示,差異表達基因數量較多且顯著富集于氨基酸代謝通路、ABC轉運通路、雙組分系統等通路。
3.1 銅脅迫下西瓜食酸菌的氨基酸代謝
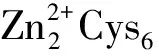
注釋為脯氨酸/精氨酸代謝的途徑(Arginine and proline metabolism,ko00330)中共有3個基因均為上調表達,經RCSB蛋白數據庫(PDB)預測分別為2個谷胱甘肽轉移酶家族成員和1個過氧化氫酶;谷胱甘肽代謝在KEGG代謝通路中有5個基因均為上調,通過RCSB蛋白數據庫(PDB)分別被預測為1個酰基轉移酶、3個谷胱甘肽轉移酶和1個葡萄糖脫氫酶。這些基因的表達量增高,顯示在銅脅迫下病菌可能通過脯氨酸/精氨酸通路、谷胱甘肽代謝等過程加速某些氨基酸合成速率。纈氨酸、亮氨酸、谷氨酸和異亮氨酸的代謝路中有86%的基因發生了顯著上調表達,這些氨基酸在一些細菌中可以通過與銅離子形成螯合物或作為氧化還原酶的關鍵位點,參與細菌胞內銅穩態維持。
3.2 銅脅迫下西瓜食酸菌的ABC轉運體
ABC轉運體廣泛存在于生物界,是目前已知最大、功能最廣泛的蛋白家族,能利用水解ATP的能量參與細胞內多種物質的跨膜轉運[27, 28]。
在嗜熱細菌中至少存在42個ABC轉運體,這些轉運體可以結合Fe2+、Cu2+以提高菌在金屬環境的耐受能力[29]。細菌中ABC轉運系統對鎳離子也具有高親和力,如大腸桿菌的NikABCDE轉運體,其中NikB、NikC形成跨膜的鎳通道,NikD和NikE能結合并水解ATP,NikA作為周質蛋白可以結合一個鎳離子,保持胞內鎳離子穩態[17]。球囊霉菌(Glomusintraradices)在含有Cu2+的培養基中培養12 h后,其gintABC1(ABC轉運體的MRP亞家族)的表達高出近4倍的水平,證明了ABC轉運體GintABC1的表達受銅離子誘導[30]。西瓜食酸菌前期的研究鑒定到一類利用ATP的外排系統,是由P型ATP酶CopA[4]、多銅氧化酶CueO[5]和類CueR組成的類Cue系統參與該菌對銅離子的外排。研究結果顯示Cu2+脅迫下該菌的ABC轉運通路89%的基因上調表達,從轉錄組水平證實該菌中存在依賴ATP、主動的ABC轉運體參與該菌對Cu2+離子的外排。該菌中存在多條主動的銅離子外排系統。
3.3 銅脅迫下西瓜食酸菌的雙組分系統
由信號轉導組氨酸激酶和轉錄調節因子組成的雙組分系統(Two-Component Regulatory System,簡稱TCS)廣泛存在于微生物中。TCS在細菌適應高濃度重金屬離子環境上有著不可或缺的作用[31]。銅綠假單胞菌(Pseudomonasaeruginosa)在含銅的環境中胞內雙組分系統czcRS表達增強,調控czcCBA操縱子表達,進而CzcCBA金屬轉運系統得以表達,促進Cu2+外排,維持胞內金屬穩態[32]。大腸桿菌DNA微陣列檢測表明,在培養基中加入CuSO4可以誘導菌中CpxAR雙組分系統[33]、YedVW雙組分系統的表達[34]。銅脅迫下的幽門螺旋桿菌(Helicobacterpylori)中,通過突變分析和體外DNA/蛋白結合實驗發現,CrdRS雙組分系統的銅離子誘導是其轉錄必須的,敲除crdS后銅離子無法誘導其表達,突變體表現對銅敏感,顯示該系統的表達對調控銅外排泵crdAB和czcBA至關重要。此外,ABC轉運體既可以誘導TCS基因的表達,也可以負調控TCS,如農桿菌(Agrobacterium)的virAG(TCS)基因的表達依賴于ABC轉運體GguAB(糖結合蛋白),高糖條件下GguAB可以誘導virAG的表達,GguAB首先與組氨酸激酶VirA互作,進而使virAG轉錄激活,從而表達細胞壞死因子[36]。枯草芽抱桿菌(Bacilussubtilis)中PhRB是一種調節磷酸鹽同化的TCS,受同一基因簇上的pstCAB(ABC轉運體)和phoU負調控,當高濃度的磷酸鹽存在時Pst基因簇表達,PhoU與phoR相互作用,抑制DNA結合蛋白PhoB的磷酸化和激活,從而抑制磷酸鹽的同化作用;低濃度磷酸鹽環境則不抑制磷酸鹽的同化,從而使細胞適應磷酸鹽有限的環境[36]。研究中銅脅迫處理后西瓜食酸菌的TCS通路基因表達顯著下調,顯示其參與菌對銅的響應,且受到負調控,是否受高表達的ABC轉運系統的負調控,以及該菌的TCS與ABC轉運體間的關系,有待后續實驗解析。
4 結 論
差異表達的基因顯著富集于ABC轉運系統的跨膜轉運、雙組分系統通路的信號轉導以及氨基酸代謝等約9大通路顯示這些通路在西瓜食酸菌對銅的脅迫響應中起積極作用。含谷氨酸和谷胱甘肽(5個基因均上調表達)等的氨基酸代謝在西瓜食酸菌抗銅脅迫中發揮重要作用;雙組分系統(22個基因,18個發生上調表達)參與西瓜食酸菌對銅離子脅迫的響應,且受到負調控;該菌中可能存在包含ABC轉運體的跨膜轉運、氧化還原反應、胞內束縛沉淀等多種系統互作的抗銅機制。

