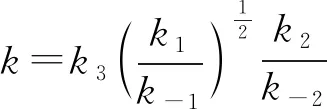化學(xué)反應(yīng)的快與慢
——高考化學(xué)中的速率方程和阿累尼烏斯公式
趙鑫光
(長春吉大附中實(shí)驗(yàn)學(xué)校)
化學(xué)反應(yīng)原理綜合題是高考化學(xué)的必考題型,該題目的設(shè)問多變,難度較大,內(nèi)容覆蓋面廣、綜合性強(qiáng)。命題背景與生產(chǎn)生活聯(lián)系緊密,考查內(nèi)容較為新穎,能夠很好地體現(xiàn)出化學(xué)學(xué)科的價(jià)值。試題經(jīng)常給出陌生公式及陌生圖像作為信息,能夠較好的考查學(xué)生綜合能力和化學(xué)學(xué)科核心素養(yǎng)。本文較為深入地探討化學(xué)反應(yīng)速率的相關(guān)知識(shí),介紹速率方程和阿累尼烏斯公式的基本內(nèi)容并配以例題,以期對高三學(xué)生的總復(fù)習(xí)有所幫助。
一、基元反應(yīng)和非基元反應(yīng)
化學(xué)反應(yīng)從反應(yīng)歷程角度可以分為基元反應(yīng)和復(fù)雜反應(yīng),復(fù)雜反應(yīng)也叫非基元反應(yīng)。
1.基元反應(yīng)
基元反應(yīng)就是能代表反應(yīng)機(jī)理,由反應(yīng)物微粒(可以是分子、原子、離子或自由基)在碰撞中相互作用直接轉(zhuǎn)化得到產(chǎn)物的化學(xué)反應(yīng),例如:
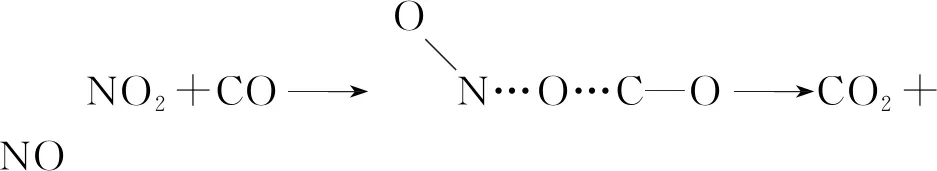
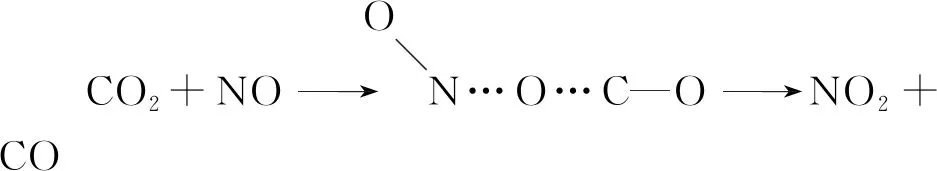
2.非基元反應(yīng)




式中M表示只參加反應(yīng)物微粒碰撞而不參加反應(yīng)的其他分子,如器壁,它只起轉(zhuǎn)移能量的作用。
3.反應(yīng)分子數(shù)
在基元步驟中,發(fā)生反應(yīng)所需的最少分子數(shù)目稱為反應(yīng)分子數(shù)。根據(jù)反應(yīng)分子數(shù)可將反應(yīng)分為單分子反應(yīng)、雙分子反應(yīng)和三分子反應(yīng)三種,如:



反應(yīng)分子數(shù)不可能為零或負(fù)數(shù)、分?jǐn)?shù),只能為正整數(shù),且只有上面三種數(shù)值,從理論上分析,四分子或四分子以上的反應(yīng)幾乎是不可能存在的。
二、速率方程和速率常數(shù)(質(zhì)量作用定律)
1.速率方程
大量實(shí)驗(yàn)表明,在一定溫度下,增大反應(yīng)物的濃度能夠增加化學(xué)反應(yīng)速率。那么化學(xué)反應(yīng)速率與反應(yīng)物濃度之間存在著何種定量關(guān)系呢?人們在總結(jié)大量實(shí)驗(yàn)結(jié)果的基礎(chǔ)上,提出了質(zhì)量作用定律:在恒溫條件下,基元反應(yīng)的速率與各種反應(yīng)物濃度以反應(yīng)分子數(shù)為冪的乘積成正比。

質(zhì)量作用定律的數(shù)學(xué)表達(dá)式為:v=k·ca(A)·cb(B)稱為該反應(yīng)的速率方程。
若該反應(yīng)為可逆反應(yīng),則其正逆反應(yīng)的速率方程分別為
v正=k正·ca(A)·cb(B);
v逆=k逆·cg(G)·ch(H)

(1)v正=k正·c(N2O4),v逆=k逆·c2(NO2)(c代表物質(zhì)的量濃度)
(2)v正=k正·p(N2O4),v逆=k逆·p2(NO2)(p代表壓強(qiáng))
(3)v正=k正·x(N2O4),v逆=k逆·x2(NO2)(x代表物質(zhì)的量分?jǐn)?shù))


對于該復(fù)雜反應(yīng)來說,決定總反應(yīng)速率的是基元反應(yīng)中反應(yīng)速率最慢的一步,則該反應(yīng)的速率方程為:v=k·c(A2),而不是v=k·c2(A)·c(B)。
2.速率常數(shù)
在上面的速率方程中,k稱為速率常數(shù),其意義是當(dāng)各反應(yīng)物濃度均為1 mol/L時(shí)的反應(yīng)速率。
對于速率常數(shù)k,應(yīng)注意以下幾點(diǎn):
①速率常數(shù)k取決于反應(yīng)的本質(zhì)。當(dāng)其他條件相同時(shí)快反應(yīng)通常有較大的速率常數(shù),k小的反應(yīng)在相同的條件下反應(yīng)速率較慢。
②速率常數(shù)k與濃度、壓強(qiáng)無關(guān)。
③k隨溫度而變化,溫度升高,k值通常增大。
④k是有單位的量,k的單位隨反應(yīng)級(jí)數(shù)的不同而不同。
3.反應(yīng)級(jí)數(shù)
由速率方程可以看出化學(xué)反應(yīng)的速率與其反應(yīng)物濃度的定量關(guān)系,對于一般的化學(xué)反應(yīng):

其速率方程一般可表示為:v=k·cm(A)·cn(B)
式中的c(A)、c(B)表示反應(yīng)物A、B的濃度,a、b表示A、B在反應(yīng)方程式中的計(jì)量數(shù)。m、n分別表示速率方程中c(A)和c(B)的指數(shù)。
速率方程中,反應(yīng)物濃度的指數(shù)m、n分別稱為反應(yīng)物A和B的反應(yīng)級(jí)數(shù),各組分反應(yīng)級(jí)數(shù)的代數(shù)和稱為該反應(yīng)的總反應(yīng)級(jí)數(shù)。
總反應(yīng)級(jí)數(shù)=m+n
通過實(shí)驗(yàn)可以得到許多化學(xué)反應(yīng)的速率方程,如表1所示:
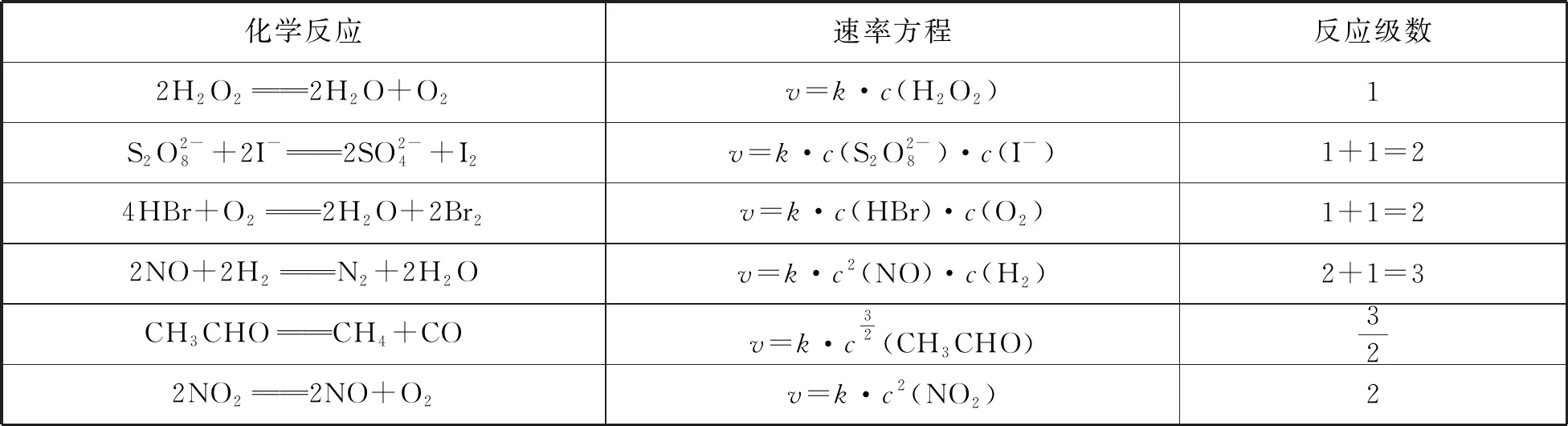
表1
可見,反應(yīng)級(jí)數(shù)的大小,表示濃度對反應(yīng)速率的影響程度,級(jí)數(shù)越大,速率受濃度的影響越大。
若為零級(jí)反應(yīng),則表示反應(yīng)速率與反應(yīng)物濃度無關(guān)。某些表面催化反應(yīng),例如氨在金屬鎢表面上的分解反應(yīng),其分解速率在一定條件下與氨的濃度無關(guān),這就屬于零級(jí)反應(yīng)。
觀察上表中六個(gè)反應(yīng)的反應(yīng)級(jí)數(shù),并與化學(xué)方程式中反應(yīng)物的計(jì)量數(shù)比較可以明顯地看出:反應(yīng)級(jí)數(shù)不一定與計(jì)量數(shù)相符合,因而對于非基元反應(yīng),不能直接由反應(yīng)方程式推導(dǎo)出反應(yīng)級(jí)數(shù)。
另外,還應(yīng)明確反應(yīng)級(jí)數(shù)和反應(yīng)分子數(shù)在概念上的區(qū)別:①反應(yīng)級(jí)數(shù)是根據(jù)反應(yīng)速率與各物質(zhì)濃度的關(guān)系來確定的;反應(yīng)分子數(shù)是根據(jù)基元反應(yīng)中發(fā)生碰撞而引起反應(yīng)時(shí)所需的分子數(shù)來確定的。②反應(yīng)級(jí)數(shù)可以是零、正整數(shù)、負(fù)整數(shù)和分?jǐn)?shù);反應(yīng)分子數(shù)只可能是一、二、三。③反應(yīng)級(jí)數(shù)是對宏觀化學(xué)反應(yīng)而言的;反應(yīng)分子數(shù)是對微觀上基元步驟而言的。

實(shí)際上分三步進(jìn)行:

慢反應(yīng)(決速步驟)


實(shí)驗(yàn)測得速率方程為v=k·c(N2O5)
它是一級(jí)反應(yīng),不是二級(jí)反應(yīng)。
4.速率常數(shù)k正、k逆與化學(xué)平衡常數(shù)K的關(guān)系

(1)當(dāng)v正和v逆沒有注明具體的物質(zhì)時(shí),如v正=k正c(N2O4)和v逆=k逆c2(NO2),則建立平衡關(guān)系式時(shí)不需要考慮化學(xué)式前面的計(jì)量數(shù),平衡時(shí)v正=v逆,則有k正c(N2O4)=k逆c2(NO2),
(2)當(dāng)v正和v逆注明了具體的物質(zhì),如v(N2O4)正=k正c(N2O4),v(NO2)逆=k逆c2(NO2),則建立平衡關(guān)系式時(shí)要考慮化學(xué)式前面的計(jì)量數(shù),平衡時(shí)2v(N2O4)正=v(NO2)逆。
則有2k正c(N2O4)=k逆c2(NO2),
三、阿累尼烏斯(Arrhenius)公式
1.阿累尼烏斯公式的表達(dá)式及意義
1889年,阿累尼烏斯在大量實(shí)驗(yàn)結(jié)果的基礎(chǔ)上,總結(jié)出了速率常數(shù)k與熱力學(xué)溫度T的經(jīng)驗(yàn)公式:
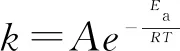
式中:
k——溫度為T時(shí)的速率常數(shù);
A——指前因子,也稱為阿累尼烏斯常數(shù),單位同k;
Ea——活化能,一般可視為與溫度無關(guān)的常數(shù),其單位為J/mol或kJ/mol;
R——?dú)怏w摩爾常數(shù),其數(shù)值為8.314 J/(mol·K);
T——絕對溫度(熱力學(xué)溫度),單位為K;
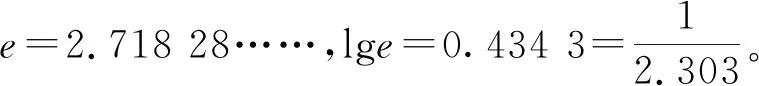
應(yīng)用阿累尼烏斯公式討論問題時(shí),可以認(rèn)為Ea、A不隨溫度變化而變化。但由于T在指數(shù)上,故對k的影響較大。
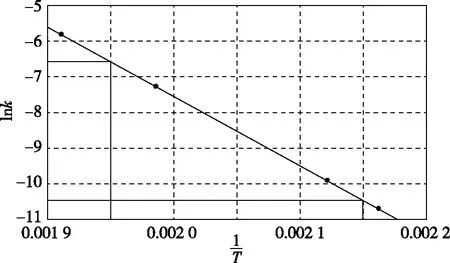
根據(jù)阿累尼烏斯公式,知道了反應(yīng)的Ea和某溫度T1時(shí)的k1,即可求出任意溫度T2時(shí)的k2。由對數(shù)式:
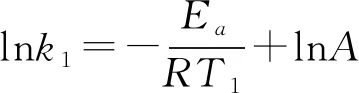
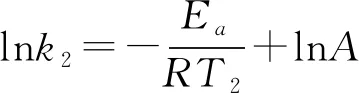
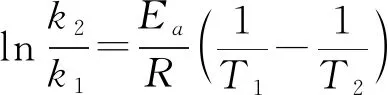
2.活化能
分子從常態(tài)轉(zhuǎn)變?yōu)槿菀装l(fā)生化學(xué)反應(yīng)的活躍狀態(tài)所需要的能量稱為活化能。活化分子的最低能量與反應(yīng)物分子平均能量的差值即為活化能。

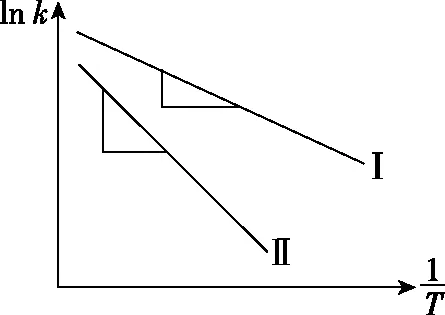

四、用速率方程和阿累尼烏斯公式解釋化學(xué)反應(yīng)速率的影響因素

v正=k正·ca(A)·cb(B);
v逆=k逆·cg(G)·ch(H)
阿累尼烏斯經(jīng)驗(yàn)公式的指數(shù)式表達(dá)式為
(1)由于a、b、g、h均為正值,故增大反應(yīng)物A或B濃度,正反應(yīng)速率增大;增大生成物G或H濃度,逆反應(yīng)速率增大;減小反應(yīng)物A或B濃度,正反應(yīng)速率減小;減小生成物G或H濃度,逆反應(yīng)速率減小。
(2)若A、B、G、H均為氣體,且a+b>g+h,即正反應(yīng)的反應(yīng)級(jí)數(shù)大于逆反應(yīng)的反應(yīng)級(jí)數(shù),若通過縮小體積增大壓強(qiáng)時(shí),反應(yīng)物濃度增大對正反應(yīng)速率的影響大于生成物濃度增大對逆反應(yīng)速率的影響,此時(shí)v正和v逆均增大,且v正增大的更多,該反應(yīng)正向移動(dòng),即向氣體體積減小的方向移動(dòng);若通過增大體積減小壓強(qiáng)時(shí),反應(yīng)物濃度減小對正反應(yīng)速率的影響大于生成物濃度減小對逆反應(yīng)速率的影響,此時(shí)v正和v逆均減小,且v正減小的更多,該反應(yīng)逆向移動(dòng),即向氣體體積增大的方向移動(dòng);即壓強(qiáng)的改變對氣體體積減小方向的速率影響更大。
(3)根據(jù)阿累尼烏斯公式,由于正、逆反應(yīng)的活化能Ea(正)與Ea(逆)為正值,氣體摩爾常數(shù)R為正值,故升高溫度k正和k逆均增大,若反應(yīng)為吸熱反應(yīng),即Ea(正)>Ea(逆),升高相同溫度時(shí),k正增大的更多,故反應(yīng)向吸熱方向移動(dòng);降低相同溫度時(shí),k正減小的更多,故反應(yīng)向放熱方向移動(dòng);即溫度的改變對吸熱方向的速率影響更大。
五、典型例題

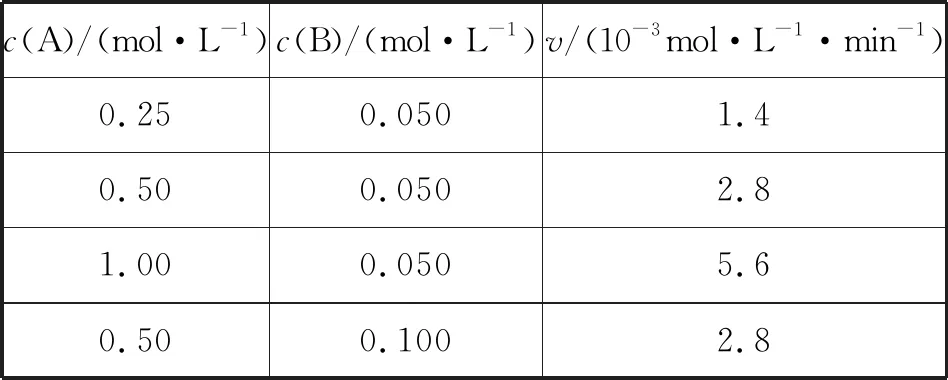
表2
下列說法正確的是
( )
A.速率方程中的m=1、n=1
B.該反應(yīng)的速率常數(shù)k=2.8×10-3min-1
C.增大反應(yīng)物濃度,k增大導(dǎo)致反應(yīng)的瞬時(shí)速率加快
D.在過量的B存在時(shí),反應(yīng)掉87.5%的A所需的時(shí)間是375 min
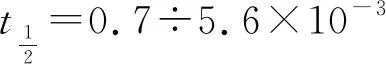

已知該反應(yīng)的v正=k正c2(NO)·c(O2),v逆=k逆c2(NO2)(k正、k逆分別為正、逆向反應(yīng)速率常數(shù))。
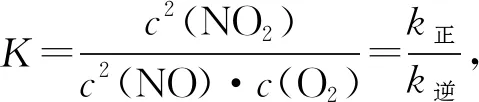
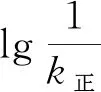

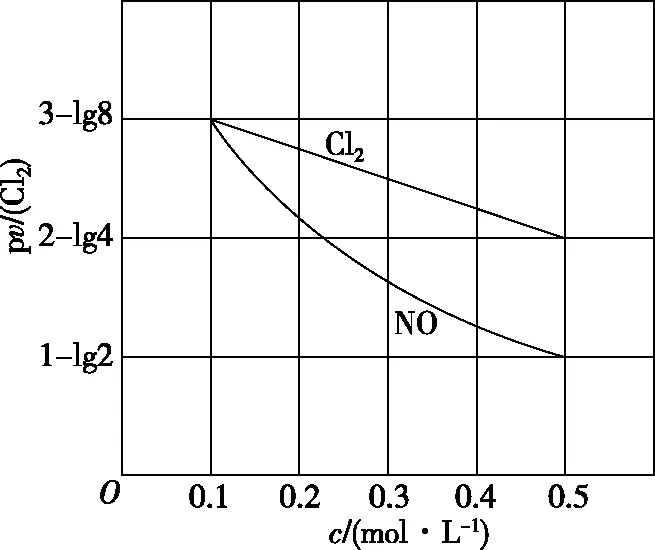
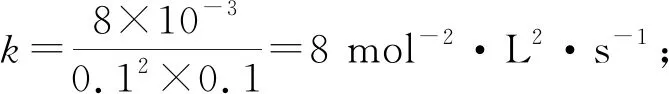

凈反應(yīng)速率v=v正-v逆=k正·p2(NO)·p2(CO)-k逆·p(N2)·p2(CO2),其中k正、k逆分別為正、逆反應(yīng)的速率常數(shù),p為氣體的分壓(分壓=總壓×物質(zhì)的量分?jǐn)?shù))。
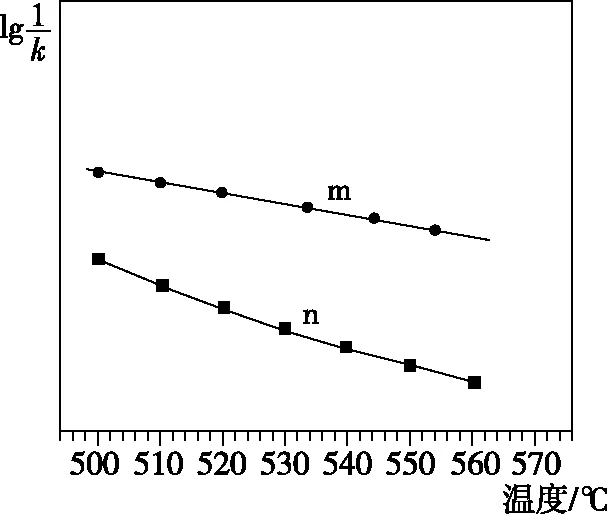
(1)升高溫度,k正-k逆________(填“增大” “減小”或“不變”);
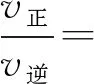
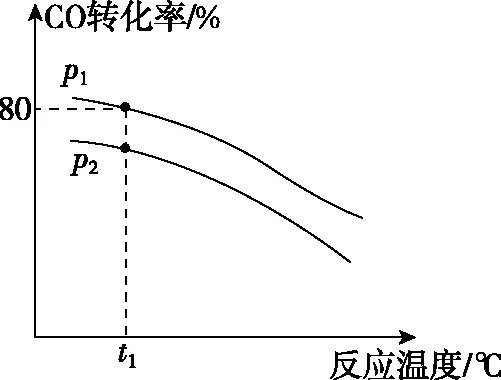
【解析】(1)根據(jù)圖像升高溫度,CO轉(zhuǎn)化率減小可知,該反應(yīng)為放熱反應(yīng),則升高溫度,正反應(yīng)速率和逆反應(yīng)速率均增大,但逆反應(yīng)速率增大的更快,即k逆增大的程度大于k正增大的程度,因此k正-k逆減小。
(2)已知該反應(yīng)為正向氣體體積減小的反應(yīng),則壓強(qiáng)越大,CO轉(zhuǎn)化率越高,故p1>p2。根據(jù)題意,設(shè)起始時(shí)CO和NO的物質(zhì)的量均為1 mol,則在壓強(qiáng)為p1、溫度為t1℃條件下平衡時(shí)CO的轉(zhuǎn)化量為0.8 mol,列出三段式:
起始(mol) 1 1 0 0
轉(zhuǎn)化(mol) 0.8 0.8 0.4 0.8
平衡(mol) 0.2 0.2 0.4 0.8
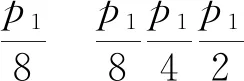
設(shè)N2的體積分?jǐn)?shù)為20%時(shí),CO轉(zhuǎn)化量為2xmol,列出三段式:
起始(mol) 1 1 0 0
轉(zhuǎn)化(mol) 2x2xx2x
平衡(mol) 1-2x1-2xx2x
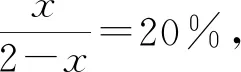

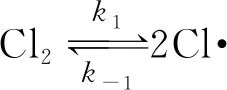
(快平衡)
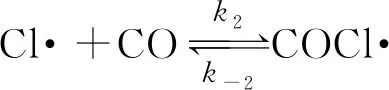
(快平衡)
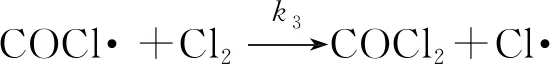
(慢反應(yīng))
試指出反應(yīng)速率方程中的k與反應(yīng)機(jī)理中的速率常數(shù)(k1,k-1,k2,k-2,k3)之間的關(guān)系________。
【解析】在上述反應(yīng)機(jī)理中,第三步反應(yīng)是慢反應(yīng),整個(gè)反應(yīng)的速率由第三步反應(yīng)決定,所以
v=k3c(COCl·)·c(Cl2)
①
根據(jù)題意可知,第一步反應(yīng)和第二步反應(yīng)都快速建立平衡,由它們的平衡式可得:
②
③
可見由這一機(jī)理導(dǎo)出的速率方程與實(shí)驗(yàn)得出的速率方程相符合。