低劑量電離輻射誘導眼晶狀體上皮細胞中差異mRNA表達譜的鑒定
王萍 范莉 陸雪等
關鍵詞:低劑量電離輻射;眼晶狀體渾濁;生物信息學;增殖
中圖分類號:Q345 文獻標識碼:A
眼晶狀體一直被認為是對輻射最敏感組織之一,流行病學對輻射誘導眼晶狀體混濁的隊列研究發現,長期受到低劑量輻射的人群,比如核工業工作者[1] 、醫院介入心臟病學家[2] 、X 射線工作者[3] 、宇航員和飛行員[4] 等,會增加眼晶狀體混濁的發生風險, 且大多發生在皮質或者后囊下。2011 年,主要基于流行病學的研究結果,國際放射防護委員會( ICRP) 推薦眼晶狀體劑量閾值為0. 5 Gy。然而,近年美國關于放射技術人員的隊列研究結果顯示,低劑量(<0. 1 Gy) 和低劑量率(通常<0. 005 Gy/ h)照射后白內障發生風險顯著增加[5] 。我國在陽江高本底地區居民的流行病學研究發現,當眼晶狀體累積劑量達0. 1 Gy 時,患皮質及后囊下渾濁的風險升高,且發生皮質性渾濁的劑量閾值估值為0. 14 Gy[6] 。這提示對于容易接觸低劑量輻射的人群,誘導晶狀體渾濁的劑量限值可能要比ICRP 推薦的0. 5 Gy 低。但是,低劑量電離輻射誘導眼晶狀體渾濁的機制目前還未完全了解,只提出了一些潛在的途徑,包括氧化應激或電離輻射誘導的DNA 損傷可能修復緩慢[7] ,導致細胞增殖、分化異常;DNA 損傷與修復可能存在逆劑量率效應[8-9] ;端粒長度增加和端粒酶活性降低等也可能與白內障發生相關[10-11] 以及遺傳背景不同會顯著改變低劑量電離輻射誘導白內障的發生風險等[12-14] 。相比于低劑量, 較高劑量(>2 Gy)輻射誘導白內障的機制已經比較明確,主要是晶狀體上皮細胞基因組損傷,包括氧化應激、DNA 損傷、細胞間通訊、細胞極性改變等[15] 。為此,我們首先通過生物信息學對低劑量(0. 2 Gy)和較高劑量(2 Gy)γ 射線照射人晶狀體上皮細胞的差異基因表達譜和相關分子通路進行分析,并對與細胞增殖相關的PIM1、HMGB1、BRE 和JUN差異表達基因進行初步驗證,為進一步探索差異表達基因在晶狀體上皮細胞中的功能提供實驗依據,有助于揭示低劑量電離輻射誘導眼晶狀體渾濁的分子機制。
1 材料與方法
1. 1 細胞培養、照射及樣本收集
正常人晶狀體上皮細胞SRA01/ 04 培養在含10% 胎牛血清的MEM 培養基( HyClone,SH30024. 01)或含10%胎牛血清的DMEM 高糖培養基(Gibco,C11965500BT)中,正常人晶狀體上皮細胞HLE-B3 培養在含10%胎牛血清的EMEM 培養基(ATCC,80615210)中,培養條件為飽和濕度、37 ℃ 、5%CO2的培養箱。待SRA01/ 04 細胞長至80% 融合,分別進行0. 2 Gy137Cs 和2 Gy60Co γ射線照射,其中0. 2 Gy 劑量率為9. 73 mGy/ min,2 Gy 劑量率為1 Gy/ min,照射后繼續培養48 h后,收集細胞, 用預冷的PBS 洗一遍, 加1 mLTrizol 裂解,置于-80 ℃ 冰箱保存,用于基因芯片分析。采用相同劑量率對SRA01/ 04 和HLE-B3兩種細胞分別進行0、0. 05、0. 075、0. 1、0. 2、0. 5Gy137Cs γ 射線照射和2 Gy60Co γ 射線照射,照射后24 h、48 h 收集細胞,用于驗證及分析不同劑量照射后不同時間晶狀體上皮細胞差異基因轉錄水平的變化。
1. 2 總RNA 提取
細胞加Trizol 充分裂解后,加入200 μL 三氯甲烷,劇烈震蕩15 s,室溫靜置2 ~ 3 min,于4 ℃ ,12 000 rpm 離心15 min;將上層水相吸至新EP 管中,再加入等體積異丙醇,輕輕混勻后室溫靜置10min,4 ℃ ,12 000 rpm 離心10 min,留底部白色沉淀,加入700 μL 無水乙醇、200 μL 焦碳酸二乙酯(DEPC)水,7 500 rpm 離心5 min,留底部沉淀,適當風干, 加入20 ~ 30 μL DEPC 水, 得到RNA溶液。
1. 3 mRNA 芯片分析
采用Affymetrix 芯片進行分析(北京中康博生物科技有限公司)。具體實驗過程為:樣本總RNA通過質控后,依次進行Poly A 加尾、片段化標記、芯片雜交、芯片洗染、掃描等過程。使用GeneChip3000 7G 掃描儀捕獲熒光信號,并通過GCOS 軟件將信號轉化,從而獲得每個探針的信號值,生成CEL 文件,進行數據標準化,篩選變化倍數大于2(FC>2)的差異表達基因。
1. 4 mRNA 功能的生物信息學分析
利用基因本體學(Gene Ontology, GO)數據庫和京都基因與基因組大百科全書 ( Kyoto Encyclopedia of Genes and Genomes, KEGG) 對差異表達的基因進行功能和信號通路的顯著性分析。
1. 5 實時熒光定量PCR( Real-time PCR) 檢測
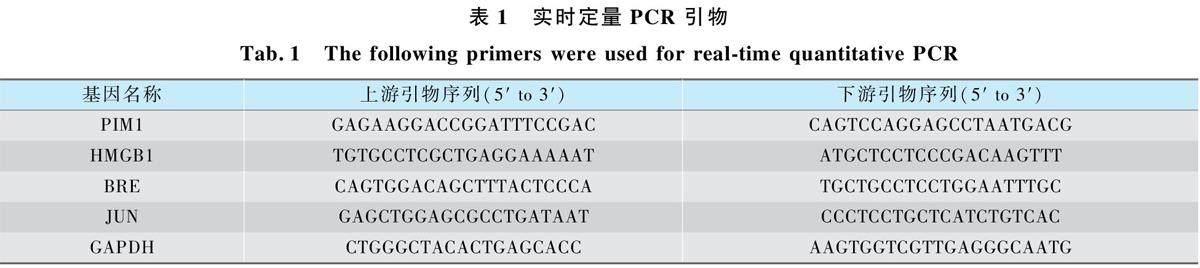
采用PrimeScript RT reagent Kit With gDNAEraser( 日本TaKaRa) 將樣本總RNA 逆轉錄成cDNA,應用ABI7500 快速實時PCR 系統檢測mRNA 表達量。以GAPDH 作為內源性內參基因進行歸一化處理,以2-ΔΔCT法計算照射組與未照射組間mRNA 表達水平的變化。所有樣品檢測均設置3 個平行樣,至少重復3 次。PCR 引物列于表1。
1. 6 統計學處理
采用SPSS 25. 0 軟件進行統計學分析,數據以x±s表示。在數據符合正態分布和方差齊性條件下,多組之間比較使用方差分析,若方差不齊選擇秩和檢驗。p<0. 05 為差異具有統計學意義。
2 結果
2. 1 不同劑量γ 射線照射SRA01 / 04 細胞后差異表達基因及生物學功能與通路分析
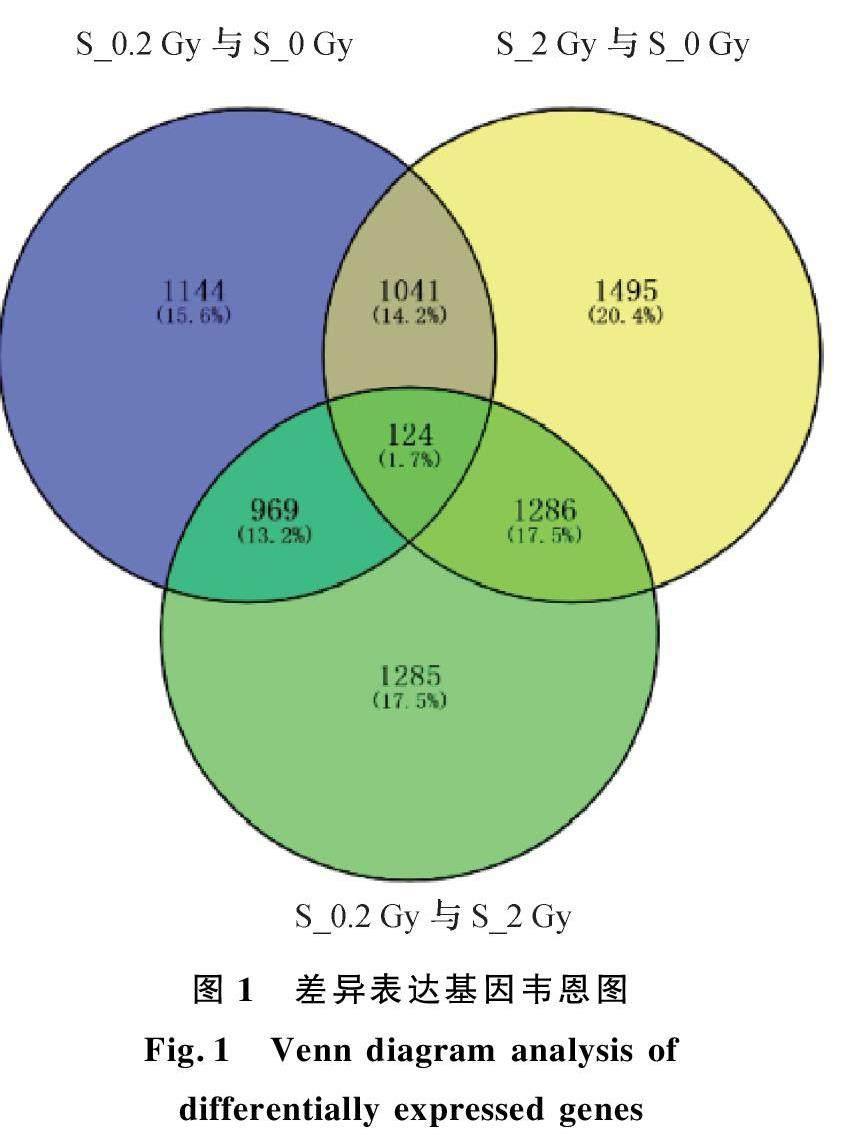
通過芯片分析篩選出了高、低劑量照射后48 h 變化倍數大于2 的基因,各照射組之間相互比較篩選出的共同表達的基因和單獨表達的基因如圖1 所示。發現較高劑量(2 Gy)照射后差異表達基因要比0. 2 Gy 照射后基因數增多,2 Gy 照射后差異表達基因共3 970 個,1 960 個表達上調,2 010 個表達下調,單獨表達的基因1 495 個;而0. 2 Gy 照射后差異表達基因共3 304 個,1 640 個表達上調,1 664 個表達下調,單獨表達的基因1 144 個;此外,0. 2 Gy 與2 Gy 相比共有3 690 個差異表達基因,1 862 個表達上調,1 828 個表達下調,單獨表達的基因1 285 個。
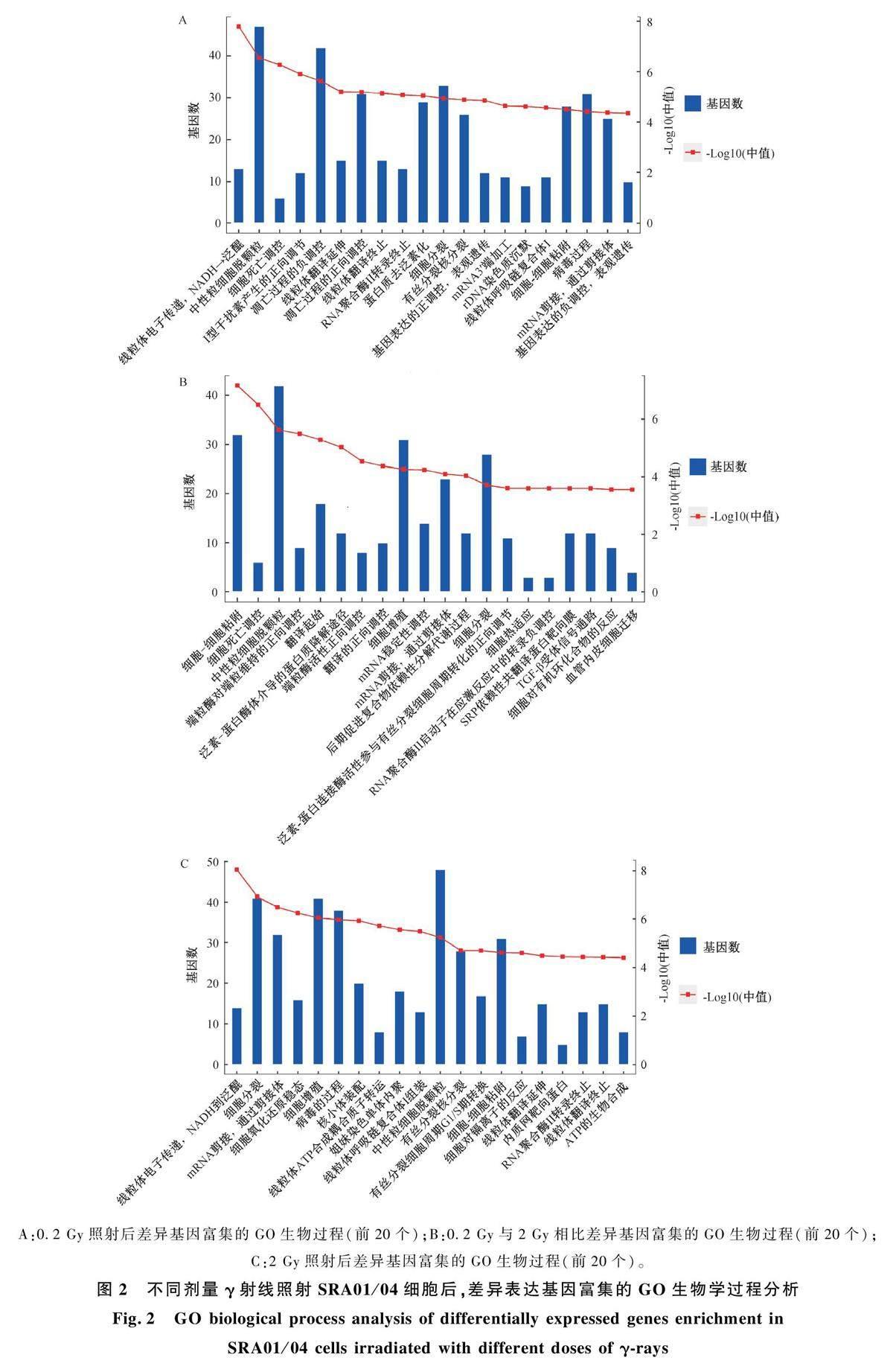
圖2 和圖3 分別給出了不同比較組差異表達基因的GO 生物過程通路和KEGG 功能通路的生物信息學分析結果。首先是0. 2 Gy 與0 Gy 比較組,GO 生物過程通路按統計學顯著性排前三位的分別是線粒體的電子傳遞鏈、中性粒細胞脫顆粒、細胞死亡調控,差異基因主要聚集在細胞分裂、細胞粘附等過程,KEGG 通路分析發現p <0. 01 的信號通路有氧化磷酸化、DNA 復制、衰老等;0. 2 Gy與2 Gy 比較組,GO 生物過程通路按統計學顯著性排前三位的分別是細胞粘附、細胞死亡調控、中性粒細胞脫顆粒,差異基因主要聚集在細胞粘附、細胞增殖、細胞分裂過程,KEGG 通路分析發現p<0. 01 的信號通路有內質網中蛋白質加工、緊密連接等,其他還有細胞周期、氧化磷酸化、錯誤修復、粘附連接等;2 Gy 與0 Gy 比較組,GO 生物過程通路按統計學顯著性排前三位的分別是線粒體的電子傳遞鏈、細胞分裂、mRNA 剪接,差異基因主要聚集在細胞分裂、細胞增殖、細胞粘附以及有絲分裂細胞周期G1 -S 期轉換過程,KEGG 通路分析發現p<0. 01 的信號通路有氧化磷酸化、細胞周期、DNA復制、緊密連接等,其他還有TGF-β 信號通路等。
2. 2 高、低劑量照射SRA01 / 04 細胞后基因表達差異
為了探究低劑量電離輻射誘導眼晶狀體渾濁的分子機制,并與高劑量電離輻射誘導白內障的機制比較異同,我們將重點分析0. 2 Gy 與0 Gy 比較組和0. 2 Gy 與2 Gy 比較組的差異表達基因。GO 生物過程和KEGG 結果表明,0. 2 Gy 與未照射(0 Gy)和較高劑量(2 Gy)相比,相同之處可能在于差異表達基因都與細胞增殖、細胞粘附這一生物過程相關。細胞增殖、粘附相關的差異表達上調的基因(FC>2)見表2、表3,基因表達的熱圖分析見圖4。0. 2 Gy 照射后,差異基因變化倍數最高的前三位分別是原癌基因PIM1、促炎因子IL-1β和編碼抗凋亡蛋白的BRE,0. 2 Gy 與2 Gy 相比,差異基因變化倍數最高的前三位分別是編碼抗凋亡蛋白的BRE、促炎因子IL-18 和DNA 修復酶XRCC6,兩比較組相同的基因為:BRE、JUN、IL -1β、GADD45A、S100A7A。
2. 3 Real-time PCR 驗證差異表達的基因
選擇0. 2 Gy 照射后表達水平顯著上調的基因,以及在0. 2 Gy 與0 Gy 和0. 2 Gy 與2 Gy 比較組中表達水平都顯著上調的基因( PIM1、BRE、JUN)進行Real-tiem PCR 驗證,并且在0. 2 Gy 照射后表達水平下調的基因中也選擇了一個差異倍數變化4. 659 倍且與細胞增殖相關的HMGB1 基因。SRA01/ 04 細胞和HLE-B3 細胞分別經不同劑量(0、0. 05、0. 075、0. 1、0. 2、0. 5 和2 Gy)γ 射線照射后24 h、48 h,利用Real-time PCR 檢測差異基因表達變化。相比于保持著穩定的上皮細胞極性的SRA01/ 04 細胞,HLE-B3 細胞在連續培養中,不僅具有細胞增殖能力,還保持著穩定分化能力。
結果顯示,SRA01/ 04 細胞中(圖5),PIM1 的表達量在照射后24 h,大部分低劑量組相比于未照射組表達水平都顯著升高( p < 0. 05);照射后48 h,相比于未照射組,0. 05 Gy 和0. 1 Gy 照射組表達水平顯著升高(p<0. 05),較高劑量(2 Gy) 組表達水平顯著下降(p <0. 05)。HMGB1 表達量在照射后24 h、48 h,相比于未照射組,某些低劑量點有升高趨勢,其中0. 075 Gy 照射后24 h,HMGB1表達水平顯著升高(p<0. 05),而2 Gy 照射后表達水平顯著下降(p <0. 05)。BRE 的表達水平在低劑量照射后24 h 有隨劑量升高而升高的趨勢,到較高劑量點(2 Gy) 表達回到基線水平;照射后48 h,低劑量組相比于未照射組表達水平有升高趨勢,2 Gy 組表達水平顯著下降(p <0. 05)。JUN的表達量在0. 05 Gy、0. 075 Gy 照射后24 h 升高,2 Gy 照射后顯著升高( p < 0. 05),其余低劑量組JUN 的表達水平都顯著下降( p < 0. 05);照射后48 h,表達量變化與基因芯片分析結果相反。HLE-B3 細胞中( 圖6), PIM1 的表達變化與SRA01/ 04 細胞中表達趨勢基本一致,但表達水平升高不顯著(p >0. 05)。HMGB1 的表達量在照射后24 h 表現為隨劑量升高而升高,照射后48 h 大部分低劑量組相比于未照射組表達水平也有升高趨勢。BRE 的表達量在低劑量照射后24 h 和0. 05 Gy、0. 075 Gy 照射后48 h,與未照射組相比表達水平顯著升高(p <0. 05)。JUN 的表達量在0. 075 Gy、0. 2 Gy 和2 Gy 照射后48 h 顯著升高(p<0. 05),其余時間點和劑量點未見明顯變化。綜上, 在遺傳背景不同的兩種細胞中, PIM1、HMGB1、BRE 在低劑量電離輻射照射后劑量響應比較好,照射后24 h,大部分低劑量組相比于未照射組表達水平明顯升高,48 h 仍然有升高趨勢,但在某些低劑量組升高不顯著,并且這三個基因在SRA01/ 04 細胞2 Gy 照射后48 h,表達水平顯著下降,在HLE-B3 細胞中也有表達水平下降趨勢。這提示低劑量電離輻射作用于眼晶狀體可以誘導某些與刺激細胞增殖、遷移相關的基因表達升高,可能與低劑量電離輻射誘導晶狀體渾濁有關。
3 討論
隨著流行病學隨訪調查的更加系統全面、更準確的照射劑量測量方法以及新診斷技術的發展,研究結果均表明急性和長期受到低劑量輻射的人群發生眼晶狀體渾濁的風險增加。因此,ICRP 在2011 年大幅降低了晶狀體的劑量閾值至0. 5 Gy(原為2 Gy),對于職業照射,每年的晶狀體當量劑量限值也從原來150 mSv 大幅降低至20mSv,且連續5 年內任何一年都不能超過50mSv[16] 。新建議的提出也影響了對低劑量電離輻射如何導致晶狀體渾濁的機制研究。
Hamada[17] 提出眼晶狀體細胞不一定對細胞死亡具有輻射敏感性,其對輻射的敏感性可能與上皮細胞過度增殖、纖維細胞異常分化、DNA 雙鏈斷裂修復不當或緩慢、端粒效應、衰老、晶狀體蛋白改變、非靶向效應、炎癥以及遺傳因素有關。對于易受低劑量輻射的人群,誘導晶狀體渾濁的劑量限值可能要比ICRP 推薦的0. 5 Gy 更低,低劑量電離輻射誘發晶狀體渾濁的分子機制可能與高劑量不同。體內研究表明,低劑量尤其是0. 1 Gy、0. 25 Gy X 射線照射后24 h,小鼠晶狀體外周區細胞密度和增殖明顯增加,cyclin D1 的表達水平也升高,而高劑量1 Gy 和2 Gy 照射后cyclin D1 的表達水平顯著降低[18] 。Vigneux 等[19] 研究發現,HLE-B3 細胞受0. 25 Gy X 射線照射后7 天,細胞增殖和遷移能力顯著增強, 而較高劑量(0. 5 ~2 Gy)時回落到未照射水平,且高于0. 25 Gy 照射后細胞粘附能力持續降低。有研究也發現小于0. 5 Gy 的X 射線照射人晶狀體上皮細胞,活性氧和活性氮的生成略有降低、細胞活力增強、細胞增殖能力也增強,而大于0. 5 Gy 照射后,產生了大量的活性氧和活性氮、細胞活力降低,表明了低劑量電離輻射可以激活抗氧化機制,有效清除活性氧,而較高劑量照射下,過量的活性氧可能導致細胞死亡并誘發白內障[20] 。
本文篩選了高、低劑量照射眼晶狀體上皮細胞后差異表達基因,并進行GO 生物過程和KEGG分析。GO 生物過程表明,0. 2 Gy 照射后,差異表達基因顯著富集在細胞分裂、細胞死亡調控、細胞粘附等方面;0. 2 Gy 與2 Gy 相比,差異表達基因顯著富集在細胞粘附、細胞增殖、細胞死亡調控等方面;2 Gy 照射后,差異表達基因顯著富集在細胞分裂、細胞增殖、有絲分裂細胞周期G1 -S 期轉換、細胞粘附等方面。同樣, KEGG 分析也表明,0. 2 Gy 照射后,差異基因顯著富集的信號通路是氧化磷酸化、與炎癥相關的IL-17 信號通路、與衰老相關的信號通路、DNA 復制以及與細胞增殖、分化相關的MAPK 信號通路等;0. 2 Gy 與2 Gy 相比,差異基因顯著富集的信號通路除氧化磷酸化外,還有與細胞粘附相關的粘附連接和緊密連接、細胞周期、錯配修復等;2 Gy 照射后,差異基因顯著富集的信號通路是氧化磷酸化、細胞周期、DNA復制、緊密連接、TGF-β 信號通路等。綜上表明電離輻射誘導晶狀體上皮細胞功能改變在氧化磷酸化、細胞增殖、細胞粘附等方面與正常晶狀體上皮細胞相比有顯著差別。本研究結果中發現,低劑量電離輻射照射晶狀體上皮細胞后與較高劑量照射后相比,KEGG 分析顯示差異表達基因在錯配修復通路中顯著富集,這提示低劑量電離輻射引起晶狀體上皮細胞DNA 損傷后修復可能不當,從而導致基因組不穩定。已有文獻發現,低能X 射線照射小鼠頭部,72 h 后仍能在晶狀體細胞核中檢測到大量的DNA 氧化損傷標志物8-OHG 以及DNA 單鏈修復蛋白XRCC1,隨后幾個月觀察到上皮細胞異常遷移到內部,表明初始細胞DNA 損傷遺傳給子細胞并引起細胞異常行為,導致白內障[21] 。Ahmadi 等人[7] 用低劑量( <0. 5 Gy) γ 射線照射人晶狀體上皮細胞,發現照射后24 h DNA損傷仍然存在,作者推測這種持續未修復的損傷可能導致基因組突變,傳遞給子細胞,導致基因組不穩定并發生白內障。
本研究應用基因芯片技術篩選了可能與低劑量電離輻射誘導眼晶狀體渾濁發生發展的關鍵基因,對其中與細胞增殖相關的候選基因PIM1、HMGB1、BRE 和JUN 進行了初步驗證。兩種人晶狀體上皮細胞受不同低劑量照射后, 細胞內PIM1、HMGB1 和BRE 基因發生不同程度的表達水平升高變化。我們觀察到HMGB1 在兩種細胞中表達水平的變化趨勢不太一致,在SRA01/ 04 細胞中,HMGB1 只在0. 075 Gy 照射后24 h 表達水平顯著升高,2 Gy 照射后表達水平顯著降低;而HLE-B3 細胞中,HMGB1 在0. 2、0. 5 和2 Gy 照射后24 h 以及0. 05 Gy 照射后48 h 表達水平顯著升高。這種差異可能是由于兩種細胞遺傳背景和細胞特性不同,對輻射敏感性也不同。遺傳背景在低劑量電離輻射誘導晶狀體渾濁中發揮著重要作用。體外研究發現來自不同供體的HLE-B3 細胞和HLEC 細胞經0. 1、0. 25 和0. 5 Gy ( 劑量率:0. 065 mGy/ min)照射后1 h,HLE-B3 細胞活力在各劑量點顯著降低,而HLEC 細胞只在0. 5 Gy 照射后細胞活力降低, 表明HLE-B3 細胞相比于HLEC 細胞對輻射更加敏感[7] 。
在其他細胞類型,PIM1 在視網膜中過表達可激活Stat3、Akt1 和Akt2 通路,并通過線粒體通路抑制神經節細胞凋亡,促進受損視神經再生和功能恢復[22] 。此外,PIM1 在血管平滑肌細胞中表達升高通過調控細胞周期,誘導大多數細胞阻滯于S期和G2?/ M 期, 促進細胞增殖和存活[23] 。Mohammad 等人[24] 研究表明,HMGB1 在人視網膜微血管內皮細胞中過表達可誘導MMP-9 表達上升,細胞遷移能力顯著增強,促進血管生成。BRE基因主要在大腦和生殖器官中表達,在細胞存活、分化、凋亡和再生中發揮重要作用。Yeung 等人[25] 研究發現,BRE- / - 小鼠卵巢中卵泡數量變少,顆粒細胞增殖受到抑制,卵泡閉鎖增加,且γH2AX和與DNA 損傷相關基因的表達升高,表明卵巢中缺少BRE 基因表達會使DNA 損傷修復效率低,導致細胞過度凋亡,進而誘導閉鎖卵泡的形成。目前關于PIM1、HMGB1 或BRE 基因在眼晶狀體方面的功能研究很少。根據本研究結果,我們推測細胞增殖相關的PIM1、HMGB1、BRE 基因在低劑量電離輻射照射人晶狀體上皮細胞后表達水平的變化,可能與低劑量電離輻射誘導晶狀體上皮細胞異常增殖和遷移密切相關。但仍需進一步體內、體外研究確定這些基因在晶狀體上皮細胞中的作用機制。
綜上所述,本研究對較低劑量(0. 2 Gy) 和較高劑量(2 Gy)γ 射線照射人晶狀體上皮細胞后差異表達基因的生物學功能和通路進行了預測分析和初步驗證,為進一步闡明低劑量電離輻射誘導晶狀體渾濁及白內障的發生機制以及輻射防護提供了實驗依據和可能的分子靶點。

