高咬合狀態下牙齦組織中VEGF及β-catenin表達的變化及其機制
李妍 劉曄 李婷婷 宗斌 高鵬玉 徐全臣
[摘要] 目的 通過檢測高咬合狀態下小鼠牙齦組織中血管內皮細胞生長因子(VEGF)及β-catenin表達的變化,探討VEGF及Wnt/β-catenin信號通路在牙齦組織改建中的作用。方法 選取4周齡昆明種雄性小鼠30只,隨機分為對照組和實驗組,每組15只小鼠。通過拔除小鼠右側上頜全部磨牙的方法建立實驗組小鼠高咬合模型。分別于術后第3、7、14、28、56天,每組每次隨機選取3只小鼠麻醉后處死,分離左側下頜第一磨牙及牙齦組織,使用蘇木精-伊紅(HE)染色觀察牙齦組織結構的變化,使用免疫組化染色方法檢測牙齦組織中VEGF以及β-catenin表達的變化。結果 HE染色顯示,實驗組拔牙后第14天牙齦組織明顯增厚,血管數量增多。免疫組化檢測結果顯示,對照組不同時間點牙齦組織中VEGF、β-catenin表達比較,差異無顯著性(P>0.05)。實驗組不同時間點牙齦組織中VEGF、β-catenin表達比較,差異有顯著性(F=250.4、343.9,P<0.01)。除拔牙后第56天外,兩組其余時點牙齦組織VEGF、β-catenin表達比較差異均有顯著性(F=5.7~38.4,P<0.05)。結論 高咬合狀態下,牙齦組織中VEGF及β-catenin表達的變化影響牙齦組織的改建。
[關鍵詞] 咬合力;牙齦;血管內皮生長因子類;Wnt信號通路;β連環素;模型,動物;小鼠
[中圖分類號] R781.4;R322.41? ? [文獻標志碼] A
[ABSTRACT] Objective To investigate the role of vascular endothelial growth factor (VEGF) and the Wnt/β-catenin signaling pathway in gingival tissues remodeling by measuring the changes in VEGF and β-catenin expression in mouse gingival tissues under hyperocclusion.? Methods Thirty male Kunming mice aged four weeks were randomly divided into control group (n=15) and experimental group (n=15). All the right maxillary molars of mice in the experimental group were extracted to establish a hyperocclusion model. On the 3rd, 7th, 14th, 28th, and 56th days after operation, three mice in each group were randomly selected and sacrificed under anesthesia. Their left mandibular first molars with the gingival tissues were isolated. Hematoxylin-eosin (HE) staining was performed to observe the histological changes of the gingiva, and immunohistochemical staining was used to measure the changes in VEGF and β-catenin expression in the gingival tissues.? Results The HE staining showed that in the experimental group, the thickness of gingival tissues and the number of blood vessels increased on day 14 after tooth extraction. The results of immunohistochemical examination showed that in the control group, there were no significant differences in the expression of VEGF and β-catenin in the gingival tissues between different time points (P>0.05); while in the experimental group, there were significant differences in that between different time points (F=250.4,343.9,P<0.01). At all time points except the 56th day after tooth extraction, there were significant differences in the expression of VEGF and β-catenin in the gingival tissues between the two groups (F=5.7-38.4,P<0.05).? Conclusion Under hyperocclusion, changes in the expression of VEGF and β-catenin in gingival tissues affect the remodeling of gingival tissues.
[KEY WORDS] Bite force; Gingiva; Vascular endothelial growth factors; Wnt signaling pathway; beta catenin; Models, animal; Mice
咬合力是維持牙周內環境穩態的主要因素,對牙周膜(PDL)的發育、成熟、形態和功能的維持以及牙槽骨的改建等起重要作用[1-2]。然而,臨床上也常常觀察到導致咬合力異常增高的情況,如牙齒早接觸、磨牙癥等。咬合力異常對PDL和牙槽骨的影響已有大量報道[3-6],但是對牙齦組織改建的影響卻鮮有研究。血管內皮細胞生長因子(VEGF)是一種重要的促血管生成因子,其表達與咬合力的刺激密切相關[7-8]。研究證實VEGF在機械力刺激的牙周組織改建中起重要作用[9]。Wnt/β-catenin信號通路是一條高度保守的信號通路,對于維持牙周組織內環境穩態有重要意義[10-12]。我們在前期研究中發現,咬合力的改變可以引發PDL以及牙槽骨的一系列適應性改建,而Wnt/β-catenin信號通路在這一過程中發揮著重要的調節作用[13-14]。本研究通過建立小鼠高咬合模型,觀察高咬合狀態下小鼠牙齦組織中VEGF和β-catenin表達的變化情況,并進一步探討Wnt/β-catenin信號通路在小鼠牙齦組織改建中的作用。
1 材料和方法
1.1 主要試劑及設備
DAB顯色試劑盒、SABC試劑盒(北京中杉金橋生物技術有限公司),兔抗人EBNA-1單克隆抗體以及兔抗人EBNA-2單克隆抗體(北京博奧森生物技術有限公司),光學倒置顯微鏡(日本Olympus公司)。
1.2 實驗分組以及動物模型的建立
4周齡雄性昆明種小鼠(購買自青島大學動物實驗室)30只,體質量(25±5)g,無齲壞,無牙周組織疾病,牙列完整。所有動物均常規飼養于青島大學動物實驗室內,保持室溫25 ℃,室內濕度56%,12-12 h明暗交替環境,標準飲食,自由飲水。將小鼠隨機分為對照組和實驗組,每組15只小鼠。小鼠適應性喂養1周后,麻醉狀態下拔除實驗組小鼠右側上頜3顆磨牙。對照組僅進行麻醉處理。
1.3 標本制備
分別于拔牙后第3、7、14、28、56天,每組每次隨機選取3只小鼠麻醉下處死小鼠。以40 g/L多聚甲醛行心臟灌注固定。取出左側下頜骨磨牙區骨段(含牙齦組織),浸泡于40 g/L多聚甲醛緩沖液中,于4 ℃環境中加強固定24 h;然后將標本移至EDTA中脫鈣3~4周,梯度乙醇脫水,石蠟包埋,沿左側下頜第一磨牙近遠中方向連續5 μm厚切片,切片行蘇木精-伊紅(HE)染色及免疫組織化學染色。
1.4 HE染色
牙齦組織切片行常規二甲苯脫蠟,梯度乙醇脫水,切片置于蘇木精中染色5 min,氨水中返藍30 s,然后置于伊紅溶液中染色2 min;隨后切片行梯度乙醇脫水,二甲苯透明,用中性樹膠封片,將切片置于顯微鏡下觀察。
1.5 免疫組織化學染色檢測牙齦組織中VEGF及β-catenin的表達
牙齦組織切片行常規二甲苯脫蠟,梯度乙醇脫水,室溫下將稀釋的一抗滴加到切片上,孵育12 h。用含卵白蛋白的PBS稀釋二抗,滴加到切片上,在室溫下孵育30 min。將切片置于DAB溶液中孵育1~5 min,然后蘇木精復染,中性樹膠封片。于顯微鏡下觀察下頜第一磨牙舌側牙齦結締組織,以細胞質中出現棕黃色或棕褐色顆粒定義為陽性細胞。光鏡下,每張切片隨機選取3個高倍視野(1 000倍),計數視野內陽性細胞總數,并計算陽性細胞表達率。陽性細胞表達率=陽性細胞總數/細胞總數。
1.6 統計學分析
使用Image-Pro Plus 6.0 圖像分析軟件包處理數據,陽性細胞率以±s表示,組間比較采用重復測量設計的方差分析,以P <0.05為差異有統計學意義。
2 結? 果
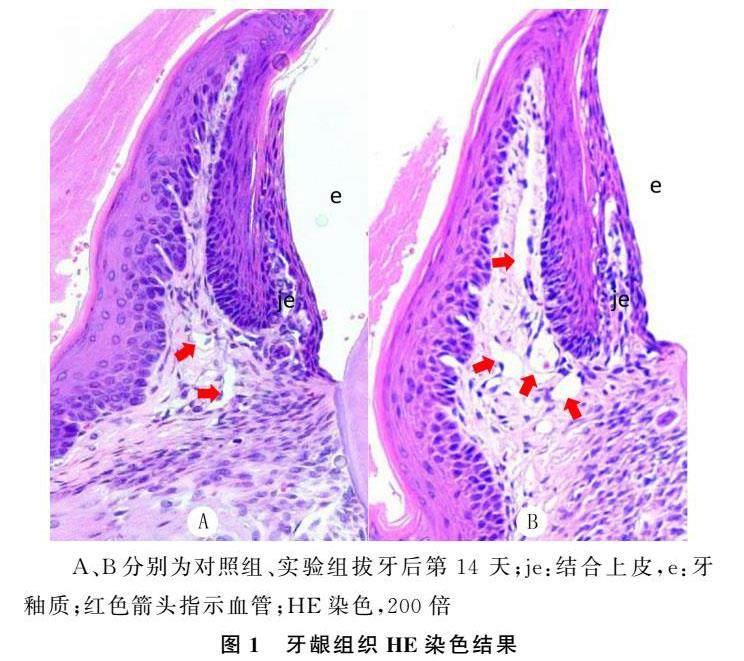
2.1 高咬合狀態對牙齦組織形態學的影響
HE染色結果顯示,拔牙后第14 天實驗組小鼠牙齦組織較對照組明顯增厚,血管數量增多(圖1)。
2.2 高咬合狀態對牙齦組織中VEGF表達的影響
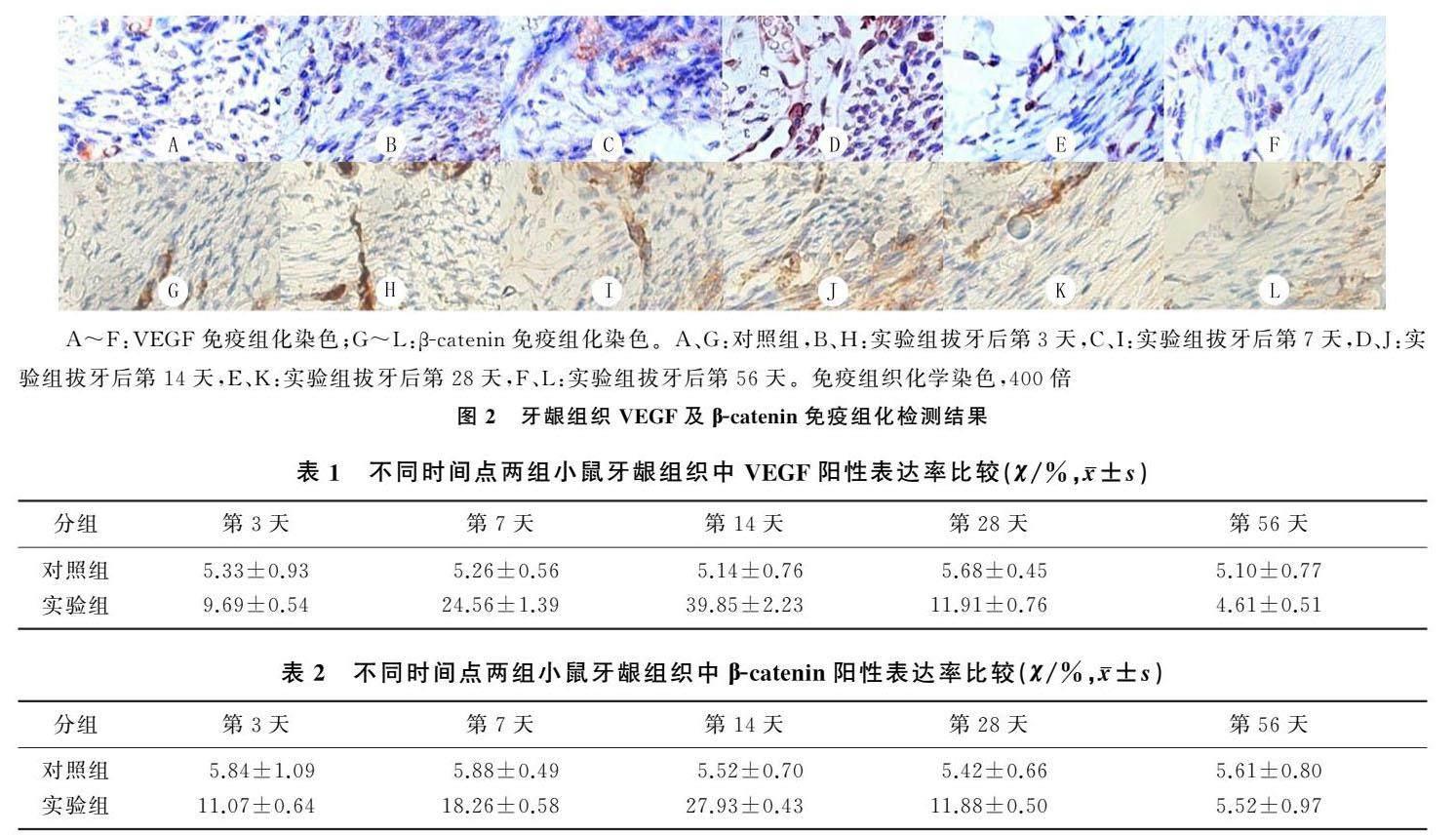
時間、組別、時間與組別交互作用對兩組牙齦組織VEGF表達有明顯的影響(F時間 =184.8,F組別 =844.7,F交互 =188.2,P<0.01)。對照組不同時間點牙齦組織VEGF陽性表達率相比較差異無顯著性(P>0.05)。實驗組不同時間點牙齦組織VEGF陽性表達率比較差異有顯著性(F=250.4,P<0.01)。除拔牙后第56天外,兩組其余時點牙齦組織VEGF陽性表達率比較差異均具有顯著性(F=5.7~20.8,P<0.05)。見圖2A~F、表1。
2.3 高咬合狀態對牙齦組織中Wnt/β-catenin信號通路的影響
時間、組別、時間與組別交互作用對兩組牙齦組織β-catenin的陽性表達率具有明顯的影響(F時間=204.4,F組別=379.7,F交互=206.0,P<0.01)。對照組不同時間點牙齦組織β-catenin陽性表達率比較差異無顯著意義(P>0.05)。實驗組不同時間點牙齦組織β-catenin陽性表達率比較差異具有顯著意義(F=343.9,P<0.01)。除拔牙后第56天,兩組其余時間點牙齦組織β-catenin陽性表達率均差異顯著(F=5.9~38.4,P<0.05)。見圖2G~L、表2。
3 討? 論
3.1 高咬合狀態對牙齦組織中VEGF表達的影響
在牙周組織中,VEGF主要表達于血管內皮細胞、成骨細胞、破骨細胞以及成纖維細胞的細胞質中,參與牙周組織的改建與修復。VEGF是主要的血管生成因子,能夠以自分泌因子的形式,作用于血管內皮細胞,促進新生血管的形成;同時,VEGF也能夠以旁分泌因子的形式,作用于成骨細胞、破骨細胞以及成纖維細胞,增強細胞活性,促進細胞的增殖和分化,從而生成新生骨組織及膠原纖維[15-19]。研究發現,在正畸牙移動過程中,受壓的PDL細胞能夠產生VEGF,促進血管生成,同時,在骨吸收陷窩的破骨細胞中也可觀察到VEGF的表達,VEGF通過調節局部血液循環和骨代謝來促進PDL內在平衡,在牙周改建中發揮關鍵作用[20]。通過構建咬合功能恢復的動物模型,MOTOKAWA等[21]發現咬合刺激可調節PDL細胞中VEGF的表達,從而誘導破骨細胞增殖,導致牙槽骨吸收。本研究在牙齦組織中也發現了類似的改變,高咬合狀態下,牙齦組織中的VEGF表達增加,從而促進了血管生成,建立了有效的血液循環,為牙齦改建提供充足的營養物質。VEGF的增加意味著血管及組織的新生,這與本研究觀察到牙齦組織的增厚相一致。本研究實驗組VEGF的表達在拔牙后第14天時達峰值,然后逐漸下降,第56天時與對照組比較無明顯差異,提示在高咬合狀態作用下,牙齦組織通過一系列的改建作用,最終適應了高咬合狀態,達到了新的生理平衡。
3.2 高咬合狀態對牙齦組織中Wnt/β-catenin信號通路的影響
Wnt/β-catenin信號通路可以通過介導機械信號轉導調節細胞的增殖和分化,對維持PDL和牙槽骨穩態具有重要意義[22-26]。研究發現,經典的Wnt通路能夠介導PDL細胞中的壓力信號轉導,通過其下游靶點調控成骨分化,并在體外通過平衡成骨細胞核因子κB受體活化受體和骨保護素的表達參與破骨形成[27]。牙齦成纖維細胞是牙齦組織中的主要應力細胞,靜壓力通過影響牙齦成纖維細胞中的糖原合成酶激酶-3β/β-catenin信號軸與α-平滑肌肌動蛋白的表達,將機械信號轉變為生物信號,引發一系列生理活動,從而參與牙齦組織的改建過程[28]。在本研究中,高咬合狀態下,牙齦組織中β-catenin表達增加,并持續升高至拔牙后第14天,然后下降。這一結果與本課題組之前在PDL中觀察到的結果相一致[13]。提示高咬合狀態可能是通過調控Wnt/β-catenin信號通路來影響牙齦組織的改建。
3.3 Wnt/β-catenin信號通路對牙周組織改建影響
本課題組前期的研究觀察到,在高咬合狀態下,PDL和牙槽骨初期表現為組織的破壞和細胞的凋亡,然而隨著時間推移,組織的修復和細胞的增殖顯示優勢,最終呈現為PDL纖維增粗、排列致密和牙槽骨密度的增加,這些結果提示牙周組織通過改建來適應高咬合狀態。課題組進一步利用轉基因小鼠體內細胞系追蹤技術,證明了Wnt/β-catenin信號通路對PDL和牙槽骨中的一系列組織和細胞學的改變起調控作用[13]。本實驗中,高咬合狀態的刺激引發牙齦組織中β-catenin和VEGF的表達增強,兩者都呈現出先升高后降低的變化趨勢,提示在牙齦組織中,增強的咬合力可能同樣通過Wnt/β-catenin信號通路調控VEGF的表達,從而影響牙齦組織的改建,以適應新的咬合狀態,維護牙周組織的健康。這一研究結果與其他學者所報道的Wnt/β-catenin信號通路在VEGF表達和血管生成過程中發揮重要作用的結論相一致[29-30]。
綜上所述,高咬合狀態可能通過Wnt/β-catenin信號通路調節牙齦組織中VEGF的表達,影響牙齦組織的改建,具體機制尚待進一步研究。
倫理批準和動物權利聲明:本研究涉及的所有動物實驗均已通過青島大學附屬醫院醫學倫理委員會的審核批準(文件號QYFYWZLL-26090)。所有實驗過程均遵照《實驗動物管理條例》進行。受試對象或其親屬已經簽署知情同意書。
作者聲明:李妍、劉曄、徐全臣參與了研究設計;李妍、劉曄、李婷婷、宗斌、高鵬玉、徐全臣參與了論文的寫作和修改。所有作者均閱讀并同意發表該論文。所有作者均聲明不存在利益沖突。
[參考文獻]
[1] TSUTSUMI T, KAJIYA H, TSUZUKI T, et al. Micro-computed tomography for evaluating alveolar bone resorption induced by hyperocclusion[J]. J Prosthodont Res, 2018,62(3):298-302.
[2] PASSANEZI E, SANT′ANA A C P. Role of occlusion in pe-riodontal disease[J]. Periodontol, 2000,2019,79(1):129-150.
[3] ANGGRAINI W, MASULILI S L C, LESSANG R. The relevance of root's convergence with trauma from occlusion[J]. Contemp Clin Dent, 2018,9(2):174-176.
[4] KIM S Y, CHOI Y H, KIM Y K. Postoperative malocclusion after maxillofacial fracture management: A retrospective case study[J]. Maxillofac Plast Reconstr Surg, 2018,40(1):27.
[5] KANG X N, LI Y M, WANG Y X, et al. Relationships of stresses on alveolar bone and abutment of dental implant from various bite forces by three-dimensional finite element analysis[J]. Biomed Res Int, 2020,2020:7539628.
[6] TSUZUKI T, KAJIYA H, T-GOTO K, et al. Hyperocclusion stimulates the expression of collagen type Ⅻ in periodontal ligament[J]. Arch Oral Biol, 2016,66:86-91.
[7] APTE R S, CHEN D S, FERRARA N. VEGF in signaling and disease: Beyond discovery and development[J]. Cell, 2019,176(6):1248-1264.
[8] MOON J S, LEE S Y, KIM J H, et al. Synergistic alveolar bone resorption by diabetic advanced glycation end products and mechanical forces[J]. J Periodontol, 2019,90(12):1457-1469.
[9] SALOMO M F, REIS S R, VALE V L, et al. Immunoloca-lization of FGF-2 and VEGF in rat periodontal ligament during experimental tooth movement[J]. Dental Press J Orthod, 2014,19(3):67-74.
[10] BIAN Y, XIANG J. Salvianolic acid B promotes the osteogenic differentiation of human periodontal ligament cells through Wnt/β-catenin signaling pathway[J]. Arch Oral Biol, 2020,113:104693.
[11] XIAO Z L, HAN Y N, ZHANG Y, et al. Hypoxia-regulated human periodontal ligament cells via Wnt/β-catenin signaling pathway[J]. Medicine (Baltimore), 2017,96(16):e6562.
[12] BAO J Q, YANG Y T, XIA M J, et al. Wnt signaling: An attractive target for periodontitis treatment[J]. Biomedecine Pharmacother, 2021,133:110935.
[13] XU Q, YUAN X, ZHANG X, et al. Mechanoadaptive responses in the periodontium are coordinated by Wnt[J]. J Dent Res, 2019,98(6):689-697.
[14] ZHANG X, YUAN X, XU Q, et al. Molecular basis for pe-riodontal ligament adaptation to in vivo loading[J]. J Dent Res, 2019,98(3):331-338.
[15] PIZZICANNELLA J, GUGLIANDOLO A, ORSINI T, et al. Engineered extracellular vesicles from human periodontal-ligament stem cells increase VEGF/VEGFR2 expression during bone regeneration[J]. Front Physiol, 2019,10:512.
[16] MILITI A, CUTRONEO G, FAVALORO A, et al. An immunofluorescence study on VEGF and extracellular matrix proteins in human periodontal ligament during tooth movement[J]. Heliyon, 2019,5(10):e02572.
[17] PIZZICANNELLA J, CAVALCANTI M, TRUBIANI O, et al. MicroRNA 210 mediates VEGF upregulation in human pe-riodontal ligament stem cells cultured on 3DHydroxyapatite ceramic scaffold[J]. Int J Mol Sci, 2018,19(12):E3916.
[18] ZHANG Z, SHUAI Y, ZHOU F, et al. PDLSCs regulate angiogenesis of periodontal ligaments via VEGF transferred by exosomes in periodontitis[J]. Int J Med Sci, 2020,17(5):558-567.
[19] MELINCOVICI C S, BO 瘙 塁 CA A B,瘙 塁 U 瘙 塁 MAN S, et al. Vascular endothelial growth factor (VEGF)-key factor in normal and pathological angiogenesis[J]. Revue Roumaine De Morphol et Embryol, 2018,59(2):455-467.
[20] MIYAGAWA A, CHIBA M, HAYASHI H, et al. Compressive force induces VEGF production in periodontal tissues[J]. J Dent Res, 2009,88(8):752-756.
[21] MOTOKAWA M, KAKU M, MATSUDA Y, et al. Effects of occlusal hypofunction and its recovery on PDL structure and expression of VEGF and BFGF in rats[J]. Clin Oral Investig, 2015,19(4):929-935.
[22] LIU Y, LI Z, ARIOKA M, et al. WNT3A accelerates delayed alveolar bone repair in ovariectomized mice[J]. Osteoporos Int, 2019,30(9):1873-1885.
[23] LI J, YIN X, HUANG L, et al. Relationships among bone quality, implant osseointegration, and Wnt signaling[J]. J Dent Res, 2017,96(7):822-831.
[24] CHEN N, WANG J Q. Wnt/β-catenin signaling and obesity[J]. Front Physiol, 2018,9:792.
[25] JIANG B, XU J, ZHOU Y F, et al. Estrogen enhances osteogenic differentiation of human periodontal ligament stem cells by activating the Wnt/β-catenin signaling pathway[J]. J Craniofac Surg, 2020,31(2):583-587.
[26] MATSUMOTO S, KISHIKAWA T, KUDO S, et al. CT evaluation of mass lesions in the parotid region[J]. Nihon Igaku Hoshasen Gakkai Zasshi, 1988,48(6):661-669.
[27] ZHANG L, LIU W, ZHAO J, et al. Mechanical stress regulates osteogenic differentiation and RANKL/OPG ratio in pe-riodontal ligament stem cells by the Wnt/β-catenin pathway[J]. Biochim Biophys Acta, 2016,1860(10):2211-2219.
[28] 顏鳳清. 靜壓力對PLGA支架上人牙齦成纖維細胞GSK-3β/β-catenin信號軸與α-SMA表達的影響[D]. 南寧:廣西醫科大學, 2018.
[29] WANG Y, SANG A M, ZHU M H, et al. Tissue factor induces VEGF expression via activation of the Wnt/β-catenin signaling pathway in ARPE-19 cells[J]. Mol Vis, 2016,22:886-897.
[30] VALLE A, GUILLEVIN R, VALLE J N. Vasculogenesis and angiogenesis initiation under normoxic conditions through Wnt/β-catenin pathway in gliomas[J]. Rev Neurosci, 2018,29(1):71-91.
(本文編輯 耿波 厲建強)

