黃芩提取物對膿腫分枝桿菌生長及生物膜形成的影響
東寶瑜 許馨月 李樹華 李帥 曾雪婷 王雨萌 孫琨 汪川 曾菊梅

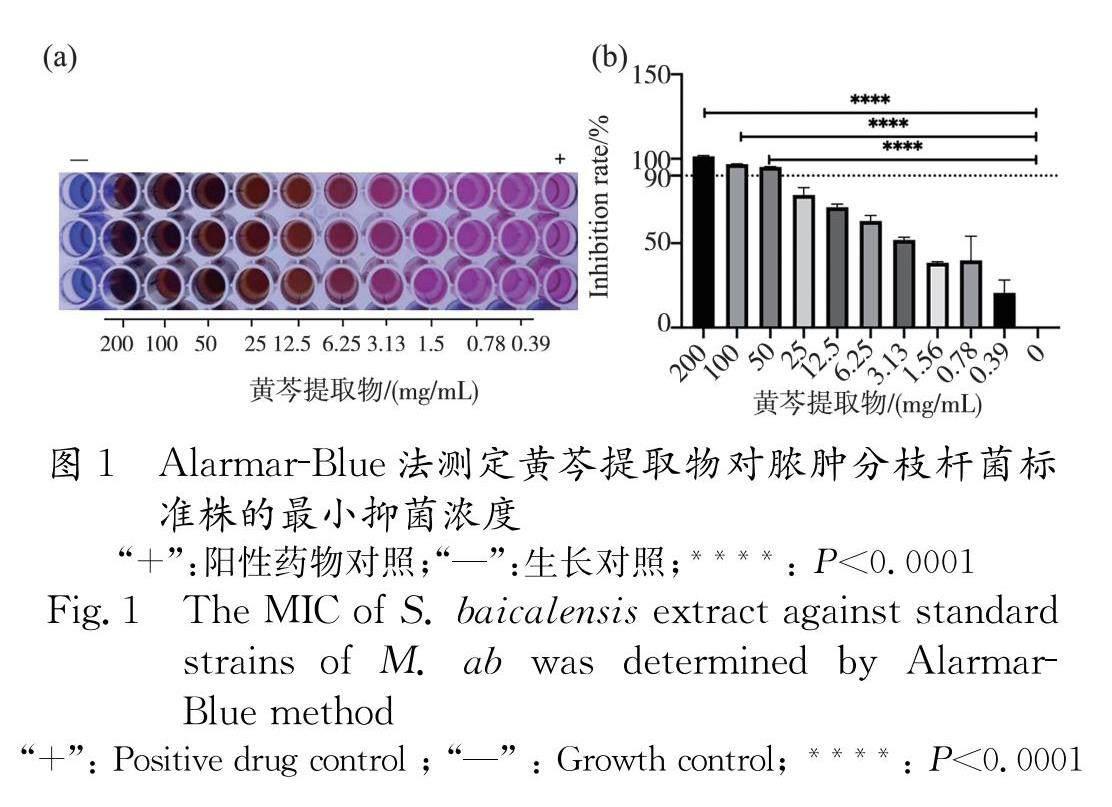

摘 要 ???:為了研究黃芩提取物對膿腫分枝桿菌浮游細菌及生物膜的影響,本研究以膿腫分枝桿菌標準菌株ATCC 19977以及臨床分離株作為受試菌,采用Alarmar-Blue液體藥敏法測定黃芩提取物對膿腫分枝桿菌的最小抑菌濃度(MIC),平板涂布法測定最小殺菌濃度(MBC),結晶紫染色法和掃描電子顯微鏡分析黃芩提取物對膿腫分枝桿菌生物膜形成量及形態結構的影響,進一步采用了RT-qPCR探究黃芩提取物對分枝菌酸合成相關基因表達的影響.結果表明黃芩提取物對膿腫分枝桿菌標準菌株ATCC 19977以及8株臨床分離株的MIC ?90為50~100 mg/mL,MBC為50~200 mg/mL;黃芩提取物可顯著降低膿腫分枝桿菌生物膜形成量( P <0.05),破壞生物膜的結構,并且顯著降低分枝菌酸合成相關基因表達量( P <0.01).本研究表明黃芩提取物能夠抑制膿腫分枝桿菌的生長以及生物膜的形成.
關鍵詞 : 黃芩提取物; 膿腫分枝桿菌; 浮游生長; 生物膜抑制
中圖分類號 : Q93 文獻標識碼 : DOI : ?10.19907/j.0490-6756.2023.046003
收稿日期: ?2022-09-21
基金項目: ??四川省國合項目(2022YFH0048); 四川大學中央高校基本科研業務費(YJ201985); 口腔疾病研究國家重點實驗室開放課題(SKLOD2022KXK0403); 四川大學大學生創新創業訓練計劃(C202210610203)
作者簡介: ??東寶瑜(1997-), 女, 甘肅天祝人, 碩士研究生, 研究方向為公共衛生. E-mail: 1226046785@qq.com
通訊作者: ?曾菊梅.E-mail: zengjumei@scu.edu.cn
Effect of ?Scutellaria baicalensis ?extract on the growth and ?biofilm formation of ?Mycobacterium abscessus
DONG Bao-Yu ?1, XU Xin-Yue ?1, LI Shu-Hua ?1, LI Shuai ?2, ZENG Xue-Ting ?3, ?WANG Yu-Meng ?1, SUN Kun ?1, WANG Chuan ??1, ZENG Ju-Mei ??1
(1. Research Center for Poisoning Treatment, Laboratory Science & Precision Prevention, West China-PUMC C.C. Chen ?Institute of Health, West China School of Public Health and West China Fourth Hospital, Sichuan University, ?Chengdu 610041, China; 2.Sichuan Academy of Chinese Medicine Sciences, Chengdu 610041, China;
3.Department of Medicament, Army Characteristic Medical Center, Army Medical University, Chongqing 400042, China)
To study the effect of ?Scutellaria baicalensis ?extract on ?Mycobacterium abscessus , the standard strain of ?M. abscessus ?ATCC 19977 and clinical isolates were used as the test bacteria. The minimum inhibitory concentration (MIC) of ?S. baicalensis ?extract against ?M. abscessus ?was determined by the Alarmar-Blue method; the minimum bactericidal concentration (MBC) was determined by plate coating method; crystal violet staining method and scanning electron microscope assay were used to analyze the effect of ?S. baicalensis ?extract on the biomass formation and morphological structure of ?M. abscessus ; RT-qPCR was further used to investigate the effect of ?S. baicalensis ?extract on the gene expression which involves in mycolic acid synthesis. The inhibitory effects of ?S. baicalensis ?extract against ?M. abscessus ?standard strain ATCC 19977 and 8 clinical isolates were evaluated, the results showed that the MIC ?90 was 50~100 mg/mL, and the MBC was 50~200 mg/mL. The biofilm formation of ?M. abscessus ?was significantly decreased after adding ?S. baicalensis ?extract( P <0.05), and ?S. baicalensis ?extract disrupted the biofilm formation. The expression of genes related to mycolic acid synthesis was significantly decreased in the ?S. baicalensis ?extract treatment group ( P< 0.01). ?S. baicalensis ?extract inhibits planktonic ?M. abscessus ?growth; meanwhile, it reduces the bacterial adhesion and aggregation on ?M. abscessus ?biofilm formation.
S. baicalensis ?extract; ?M. abscessus ; Planktonic ??growth; Biofilm inhibition
1 引 言
膿腫分枝桿菌( Mycobacterium abscessus, M. ab )是一種常見的致病性非結核分枝桿菌(nontuberculosis mycobacteria, NTM),屬于快速生長型分枝桿菌,通常引起炎癥性肺部感染(如囊性纖維化)以及嚴重的皮膚、關節、軟組織、手術部位和播散性感染 ?[1,2].抗生素治療是當前首選的治療方案,然而,該細菌自身的外膜脂質屏障低滲透性、藥物的修飾滅活酶、外排泵系統及靶點突變等因素,使得該菌對大部分臨床使用抗生素及利福平和異煙肼在內的抗結核藥物耐藥 ?[3].此外,膿腫分枝桿菌是一種可形成生物膜的耐多藥細菌.生物膜(biofilm)是微生物被包裹在其自身分泌的多聚物中形成的一種特殊細胞群體結構.與浮游細菌相比,膿腫分枝桿菌生物膜對抗生素治療的耐受性更高 ?[4],臨床上許多頑固、難以治療的感染與生物膜的形成相關.因此,控制生物膜形成是治療膿腫分枝桿菌感染的新策略 ?[5].
分枝菌酸是分枝桿菌細胞壁上脂質復合物的重要組成部分.值得注意的是,分枝桿菌生物膜的細胞外聚合物(Extracellular Polymeric Substances, EPS)富含分枝菌酸,分枝菌酸可使膜內細菌具有群落內聚力,其合成與生物膜的形成密切相關 ?[6].通過影響分枝菌酸的合成有望抑制膿腫分枝桿菌生物膜的形成.
我國有豐富的中藥資源,中藥在治療傳染病方面有廣泛的前景.黃芩始載于《神農本草經》,別名山茶根、土金茶根,為唇形科植物黃芩 ?Scutellaria baicalensis Georgi ?的干燥根,味苦,性寒,歸肺、膽、脾、小腸、大腸經,其有效成分是黃酮類化合物,主要包括黃芩苷(baicalin)、黃芩素(baicalein)等.隨著近年來臨床治療的不斷深入,研究表明黃芩及 其活性成分具有抗菌、抗病毒 、抗腫瘤、護肝以及免疫保護等作用 ?[7],尤其以抗菌作用最為顯著,目前已被證明對包括葡萄球菌屬 ?[8]、大腸埃希菌 ?[9]、幽門螺桿菌 ?[10]以及銅綠假單胞菌 ?[11]等在內的多種微生物及生物膜有效.
本文旨在探討黃芩對膿腫分枝桿菌的抑菌作用以及黃芩對膿腫分枝桿菌生物膜形成的抑制作用,為臨床有效治療膿腫分枝桿菌引起的疾病提供理論基礎.
2 材料與方法
2.1 材 料
膿腫分枝桿菌標準菌株(ATCC 19977)購自美國模式培養物集存庫;膿腫分 枝桿菌臨床分離株8株(MAB-S1、MAB-S2、MAB-S3、MAB-S4、MAB-R1、 ?MAB-R2、MAB-R3、MAB-R4)由四川大學華西第四醫院微生物室提供.
2.2 實驗方法
2.2.1 菌液準備 ?用接種環挑取復蘇后的單個菌落至無菌7H9液體培養基中,37 ℃培養,用7H9液體培養基作為空白對照管,酶標儀測得菌液OD ?600 nm為0.5時,即細菌培養至對數生長期,獲得純菌液備用.
2.2.2 藥物準備 ?黃芩提取物溶解于無菌水,配制為200 mg/mL的儲存濃度,通過0.22 μm的濾膜過濾除菌,置于4 ℃冰箱備用.
2.2.3 藥物的最小抑菌濃度 ?采用Alarmar-Blue液體藥敏法測定黃芩提取物的MIC.設置卡那霉素作為抑菌對照,不加藥物的純菌液作為生長對照.以二倍稀釋設置藥物濃度梯度,藥物濃度從200 mg/mL到0.39 mg/mL,共設置10個濃度 ?[12,13].每個濃度設置復孔.將接種后的微孔板置于5% CO ?2培養箱37 ℃培養48 h,加入Alarmar-Blue指示劑培養過夜.采用多功能微孔板分析儀測定540/595 nm處的熒光值,計算不同藥物濃度下對細菌的生長抑制率.MIC ?90定義為抑制率大于等于90%對應的最低藥物濃度,MIC ?50定義為抑制率大于等于50%對應的最低藥物濃度.藥物作用的抑制率計算公式如下:
抑制率= 1- 試驗孔熒光值-抑菌對照熒光值 生長對照熒光值-抑菌對照熒光值 ?×??100%
2.2.4 藥物的最低殺菌濃度 ?MBC定義為殺死99.9%(與生長對照孔菌落數比較)的微生物所需的最低藥物濃度.藥敏試驗培養后的微孔板,取藥物MIC ?90孔及以上兩孔、生長對照中的菌液各50 μL作10倍稀釋,稀釋度依次為10 ?-1、10 ?-2、10 ?-3、10 ?-4、10 ?-5 ?[14].將稀釋液均勻涂布至7H9固體培養基上,平板倒置培養于5% CO ?2培養箱,37 ℃培養3~4 d后,進行菌落計數,三次生物學重復后,將所獲得的菌落數做統計分析.
2.2.5 生物膜培養及其抑制 ?細菌在7H9液體培養基中培養至對數生長期后,收集菌體.用蘇通培養基洗滌菌體2次并重懸(OD ?600 nm=0.9~1.2),然后用蘇通培養基按照1∶100的比例稀釋到24孔板中,每孔2 mL.每板在孵育前用Parafilm密封膜覆蓋,以減少水份蒸發并允許空氣自由交換, 37 ℃ 下孵育 5~7 d,生物膜培養成熟.黃芩提取物的干預,即用蘇通培養基稀釋的1∶100菌液加入24孔板,每孔中加入黃芩提取物,設置終濃度為0×MIC、0.5×MIC、1×MIC,每孔總體積為2 mL,設置三個平行孔,在第7天收集生物膜.
2.2.6 生物膜的定量分析 ?通過結晶紫染色確定黃芩提取物對于膿腫分枝桿菌生物膜形成的影響.在24孔板中獲得成熟的生物膜后,吸出孔板內的上清液,PBS洗滌,去除浮游細菌.每孔加入1 mL 4%(w/v)多聚甲醛室溫固定生物膜15 min,吸棄多聚甲醛,37 ℃烘干孔板,每孔加入1 mL 0.01%(w/v)結晶紫染液,室溫靜置染色5 min,無菌PBS輕輕洗滌2次去除多余染料;每孔加入2 mL 33%(v/v)乙酸,溫和震蕩30 min溶解染料;最后,將100 μL乙酸洗脫液轉移至一個新的96孔板上,酶標儀575 nm處讀取OD值來量化生物膜的形成.
2.2.7 生物膜微觀形態分析 ?使用掃描電子顯微鏡對黃芩提取物干預生物膜的形態進行觀察.將無菌圓形玻片置于24孔板中,分組加樣同2.2.5部分,獲得成熟的生物膜.去除多余培養基,用PBS輕柔漂洗2~3次去除松散的浮游細菌;將各孔加入2.5%(v/v)戊二醛,4 ℃固定12 h;吸棄戊二醛后PBS輕柔漂洗2次;依次用30%、50%、70%、80%、90%和100%(v/v)的乙醇洗脫,使生物膜梯度脫水;將脫水后樣本放入100%(v/v)乙酸正戊酯置換處理,在CO ?2臨界點干燥儀中干燥,噴金后,用掃描電子顯微鏡觀察生物膜樣本的形態結構.
2.2.8 分枝菌酸合成相關基因表達量的測定
① RNA的提取 取2.2.1培養至對數生長期的菌液稀釋至OD ?600 nm=0.005,設置生長對照組及黃芩提取物處理組(終濃度為25 mg/mL),37 ℃ 下孵育 24 h.收集菌體于無酶離心管中,采用TRIzol法提取細菌總RNA ?15],RNA提取完成后使用Nanodrop 2000分光光度計測定RNA濃度以及OD ?260 nm/OD ?280 nm.
② cDNA的合成 ?采用Goldenstar ?RT6 cDNA Synthesis Kit Ver.2試劑盒,配制如下反應體系:RNA模板20 ng,gDNA Remover 1 μL,10×gDNA Remover Buffer 1μL,RNase-free Water加至終體積10 μL.混勻體系短暫離心,42 ℃ 2 min,60 ℃ 5 min后,迅速置于冰上冷卻,短暫離心后加入以下組分:5×Goldenstar ? Reaction Buffer ?4 μL,Goldenstar ? RT6 (200 U/L) 1 μL, Randomer (50 μmol/L) 1 μL,dNTP Mix (10 mmol/L) 1 μL,DTT 1 μL,RNase-free Water 2 μL.25 ℃ ?10 min,55 ℃ 15 min,85 ℃ 5 min后終止反應, -80 ℃保存.
③ 基因表達定量分析 ?配制反應體系:10 μL的2×T5 Fast qPCR Mix (SYBR Green Ⅰ),10 μmol/L上下游引物各0.8 μL,1 μL的cDNA模板,50×ROX Reference Dye Ⅱ 0.4 μL,RNase-free Water補至20 μL,用 QuantStudio 3儀器進行qPCR,反應程序為 95 ℃ 1 min, 95 ℃ 10 s, 60 ℃ 10~15 s, 40 cycles.設置16S rRNA基因為內參基因,采用2 ?-ΔΔCt計算方法計算分枝菌酸合成相關基因的相對表達量 ?[16].
2.2.9 統計學處理 ?正態分布資料數據以 ?x ±s 表示,采用 SPSS 18.0 軟件進行統計學分析,組間差異采用student t檢驗比較,三組及以上采用單因素方差分析比較組間差異, 然后進行Dunnetts檢驗.檢驗水準α=0.05,當 P <0.05時,差異具有統計學意義.采用 GraphPad Prism 8.0軟件構建圖表.
3 結 果
3.1 最小抑菌濃度(MIC)和最小殺菌濃度(MBC)
Alarmar-Blue液體藥敏法測定黃芩提取物的 MIC結果顯示,黃芩提取物對膿腫分枝桿菌標準株的MIC ?50為3.13 mg/mL,MIC ?90為50 mg/mL(結果見圖1).平板涂布法結果顯示黃芩提取物對膿腫分枝桿菌標準株的MBC為100 mg/L.黃芩提取物對膿腫分枝桿菌臨床株的MIC ?50、MIC ?90以及MBC結果如表2所示.
3.2 生物膜定量分析結果
生物膜內的細菌和胞外聚合物可以與結晶紫結合,通過測量吸光度的變化來定量檢驗藥物處理對生物膜的影響.黃芩提取物干預處理后,膿腫分枝桿菌標準株無藥對照孔在氣液交界面形成一層成熟生物膜,呈乳白色蠟質狀,而25、50 mg/mL 的黃芩提取物處理組孔中幾乎沒有形成可見生物膜(結果見圖2).結晶紫染色定量結果表明,25、50 mg/mL的黃芩提取物顯著降低了膿腫分枝桿菌的生物膜總生物量( P <0.0001).黃芩提取物處理膿腫分枝桿菌臨床株后,臨床株處理組的生物膜生物量顯著低于無藥對照孔的生物膜生物量( P <0.05)(結果見圖3).以上結果說明黃芩提取物可以抑制膿腫分枝桿菌的生物膜的形成.
3.3 ?掃描電子顯微鏡觀察黃芩提取物對膿腫分枝桿菌標準株生物膜形成的影響
設置實驗組黃芩提取物濃度分別為0.5×MIC和1×MIC,以及無藥生長對照組,對樣品進行掃描電鏡分析.由生長對照組(結果見圖4)可以觀察到當膿腫分枝桿菌培養一段時間后,細菌生長良好,大量團聚,會形成連接致密且有一定厚度的生物膜;在25 mg/mL黃芩提取物處理組,細菌數量有一定的下降,生物膜變薄且松散,生物膜的完整性受到影響;在50 mg/mL 黃芩處理組,細菌數目大量下降,且細菌分散,不再團聚成一個整體,生物膜基本消失.上述結果表明,黃芩提取物對膿腫分枝桿菌生物膜的形成有抑制作用.
3.4 分枝菌酸合成相關基因表達量的測定
采用實時熒光定量PCR測定分枝菌酸合成相關基因的相對表達量結果(見圖5).黃芩提取物處理后,分枝菌酸合成相關基因 MAB_2028 , MAB_2029 , MAB_2030 , MAB_2031 , MAB_2032 , ?MAB_2034 表達量均顯著下降( P <0.01).以上結果說明黃芩提取物能影響分枝菌酸合成相關基因的下調表達,從而抑制膿腫分枝桿菌的生長及生物膜的形成.
4 討 論
近年來,世界范圍內非結核分枝桿菌(nontuberculosis mycobacteria,NTM)病的發病率和死亡率正穩步上升 ?[17-19].膿腫分枝桿菌作為NTM病常見的感染因子,對大部分抗生素及一線抗結核藥物具有高度耐藥性,導致治療效果差,臨床診療復雜棘手 ?[20-22].膿腫分枝桿菌能夠在人肺中形成生物膜生長,并嵌入終末期肺病的肺泡壁中,可能引起的慢性、持續性肺部疾病 ?[23].生物膜的形成是人類 NTM 感染的致病性和耐藥性的關鍵機制,抗生物膜劑成為治療膿腫分枝桿菌感染的新思路.因此,亟需開發新型藥物來治療膿腫分枝桿菌引起的感染.
研究表明,天然植物黃芩對耐碳青霉烯肺炎克雷伯菌的MIC為250~1000 mg/mL ?[24],對諾卡菌的MIC為62.50 g/L,表現出一定的殺滅效果 ?[25].而課題組通過前期的篩選發現天然植物黃芩對膿腫分枝桿菌浮游菌的生長具有抑制作用.本研究通過測定黃芩提取物對浮游菌的最小抑菌濃度和最小殺菌濃度證實了黃芩提取物可以抑制膿腫分枝桿菌浮游菌的生長,黃芩提取物對膿腫分枝桿菌標準株的MIC ?50和 MIC ?90分別為3.13 mg/mL和50 mg/mL.我們進一步測試了0.5×MIC(25 mg/mL)的黃芩提取物能有效抑制膿腫分枝桿菌標準株和臨床株生物膜的形成,其對生物膜的清除可消除由于生物膜的存在而導致的抗生素耐藥性升高.由此可見,黃芩提取物在殺死膿腫分枝桿菌和克服由生物膜引起耐藥性方面極具潛力.
膿腫分枝桿菌表現出兩種菌落形態:平滑型菌落S(Ma ?Sm)和更具抗生素抵抗力的粗糙型菌落R(Ma ?Rg) ?[4].膿腫分枝桿菌復合體可以分為三個亞種:膿腫亞種, 馬賽亞種以及博萊亞種.這些亞種之間的區別具有臨床意義,感染會表現出不同的藥物敏感性測試結果以及臨床癥狀 ?[26,27].在本項研究中,黃芩提取物在膿腫分枝桿菌標準株和臨床株S型、R型以及膿腫亞種、馬賽亞種中均表現出良好的抗菌作用以及生物膜形成的抑制作用.其它中草藥如黃連及香茅草提取物均能抑制膿腫分枝桿菌的生長和生物膜的形成,黃連濃縮膏體MIC為1 mg/mL ?[28],香茅草精油MIC為3.506 mg/mL ?[29],紅木的水醇提取物BoHE對于馬賽亞種的MIC為2.34 mg/mL,但該研究未探究BoHE對膿腫分枝桿菌生物膜的影響 ?[30].以上植物提取物未在膿腫分枝桿菌臨床株中進行抑菌及抑制生物膜的研究,而本研究測試了黃芩提取物在膿腫分枝桿菌不同菌落形態、不同亞種的臨床株中的抑菌及生物膜抑制效果,使得黃芩提取物在治療膿腫分枝桿菌感染方面更具有臨床意義,為臨床生物膜抑制劑的開發提供一定基礎.
分枝菌酸是獨特的長鏈脂肪酸,存在于富含脂質的分枝桿菌細胞壁中.新的哌啶醇衍生物PIPD1通過靶向膿腫分枝桿菌的分枝菌酸轉運 ?[31]、甲氟喹通過干擾分枝菌酸的生物合成 ?[32]均表現出明顯的膿腫分枝桿菌抑菌活性. MAB_2028 至 2034 基因位于同一個操縱子,研究表明, MAB_2028 , MAB_2030 , MAB_2032 都參與膿腫分枝桿菌分枝菌酸的合成 ?[33].在本研究中,黃芩提取物處理后, MAB_2028 , MAB_2029 , MAB_2030 , MAB_2031 , MAB_2032 , MAB_2034 的表達量均下調,表明黃芩提取物可能通過影響分枝菌酸的生物合成從而抑制膿腫分枝桿菌的生長及其生物膜的形成.
臨床上會發生許多與生物膜相關的感染,一旦在非生物或組織表面上建立了生物膜,使用常規劑量的抗生素幾乎不可能根除 ?[34],由抗生素和表現出抗生物膜活性的化合物的聯合治療是解決該問題的一種潛在策略.研究發現黃連及其主要成分小檗堿可以抑制膿腫分枝桿菌的生物膜形成,增強抗生素治療膿腫分枝桿菌感染的能力 ?[28].黃芩提取物中含有多種不同作用機制的抗菌成分,黃芩單體的抑菌與生物膜抑制作用以及抑制生物膜形成的具體機制有待深入研究與探索.綜上所述,黃芩提取物有望成為臨床治療膿腫分枝桿菌感染的新方法.
參考文獻:
[1] ??De Groote M A, Huitt G. Infections due to rapidly growing ?Mycobacteria ?[J]. Clin Infect Dis, 2006, 42: 1756.
[2] ?Floto R A, Olivier K N, Saiman L, ?et al . US cystic fibrosis foundation and european cystic fibrosis society consensus recommendations for the management of non-tuberculous ?Mycobacteria ?in individuals with cystic fibrosis [J]. Thorax, 2016, 71: i1.
[3] ?Illouz M, Alcaraz M, Roquet-Banères F, ?et al . ?Mycobacterium abscessus , a model of resistance to multiple antibiotic classes [J]. Med Sci (Paris), 2021, 37: 993.
[4] ?Clary G, Sasindran S J, Nesbitt N, ?et al . ?Mycobacterium abscessus ?smooth and rough morphotypes form antimicrobial-tolerant biofilm phenotypes but are killed by acetic acid [J]. Antimicrob Agents Chemother, 2018, 62: e01782.
[5] ?Kostakioti M, Hadjifrangiskou M, Hultgren S J. Bacterial biofilms: development, dispersal, and therapeutic strategies in the dawn of the postantibiotic era [J]. Cold Spring Harb Perspect Med, 2013, 3: a010306.
[6] ?Ojha A, Anand M, Bhatt A, ?et al . GroEL1: a dedicated chaperone involved in mycolic acid biosynthesis during biofilm formation in ?Mycobacteria ?[J]. Cell, 2005, 123: 861.
[7] ?龔發萍, 鄭鳴福. 黃芩的化學成分及藥理作用[J]. 臨床合理用藥雜志, 2021, 14: 176.
[8] ?梅林, 賀錫中, 熊云, 等 中藥黃芩的血清抑菌活性試驗研究[J]. 醫學研究雜志, 2009, 38: 102.
[9] ?周雪寧, 權志博, 王雷陜, 等. 五倍子等三種中藥體外抗產ESBLs大腸埃希菌研究及其探討[J]. 陜西中醫學院學報, 2009, 32: 80.
[10] ?吳靜, 胡東, 王克霞. 黃芩和黃芩苷對幽門螺桿菌的體外抗菌活性研究[J]. 中藥材, 2008: 707.
[11] Brackman G, Cos P, Maes L, ?et al . Quorum sensing inhibitors increase the susceptibility of bacterial biofilms to antibiotics in vitro and ?in vivo ?[J]. Antimicrob Agents Chemother, 2011, 55: 2655.
[12] 殷姿, 歐宜文, 李蓓, 等. 黃芩對肺炎克雷伯菌抑制作用及其機制研究[J]. 中國病原生物學雜志, 2016, 11: 388.
[13] Chen W, Li B, Li S, ?et al . Effects of scutellaria baicalensis on activity and biofilm formation of ?Klebsiella pneumoniae ?[J]. Chin Med Sci J, 2016, 31: 180.
[14] 何志群, 滕飛, 高超, 等. 夫西地酸聯合抗生素抑制膿腫分枝桿菌的研究 [J]. 四川大學學報: 自然科學版, 2021, 58: 066001.
[15] Del Rio B, Ladero V, Redruello B, ?et al . Lactose-mediated carbon catabolite repression of putrescine production in dairy ?Lactococcus lactis ?is strain dependent [J]. Food Microbiol, 2015, 48: 163.
[16] Arocho A, Chen B, Ladanyi M, ?et al . Validation of the 2-DeltaDeltaCt calculation as an alternate method of data analysis for quantitative PCR of BCR-ABL P210 transcripts [J]. Diagn Mol Pathol, 2006, 15: 56.
[17] Mirsaeidi M, Machado R F, Garcia J G, ?et al . Nontuberculous mycobacterial disease mortality in the United States, 1999-2010: a population-based comparative study [J]. PLoS ONE, 2014, 9: e91879.
[18] Namkoong H, Kurashima A, Morimoto K, ?et al . Epidemiology of pulmonary nontuberculous mycobacterial disease, Japan [J]. Emerg Infect Dis, 2016, 22: 1116.
[19] Yu X, Liu P, Liu G, ?et al . The prevalence of non-tuberculous mycobacterial infections in mainland China: systematic review and meta-analysis [J]. J Infect, 2016, 73: 558.
[20] Cowman S, Van Ingen J, Griffith D E, ?et al . Non-tuberculous mycobacterial pulmonary disease [J]. Eur Respir J, 2019, 54: 1900250.
[21] Griffith D E. ?Mycobacterium abscessus ?and antibiotic resistance: same as it ever was [J]. Clin Infect Dis, 2019, 69: 1687.
[22] Griffith D E, Daley C L. Treatment of ?mycobacterium abscessus ?pulmonary disease [J]. Chest, 2022, 161: 64.
[23] Qvist T, Eickhardt S, Kragh K N, ?et al . Chronic pulmonary disease with ?Mycobacterium abscessus ?complex is a biofilm infection [J]. Eur Respir J, 2015, 46: 1823.
[24] 唐金蓉, 李盛, 張曼俐, 等. 黃芩、黃連和黃柏對CRKP的抑菌作用研究 [J]. 醫學理論與實踐, 2022, 35: 2469.
[25] 周意, 李秋明, 龍華婧, 等. 黃芩顆粒與抗菌藥聯合使用對諾卡菌的體外抑菌效果 [J]. 實用檢驗醫師雜志, 2022, 14: 191.
[26] Harada T, Akiyama Y, Kurashima A, ?et al . Clinical and microbiological differences between ?Mycobacterium abscessus ?and ?Mycobacterium massiliense ?lung diseases [J]. J Clin Microbiol, 2012, 50: 3556.
[27] Koh W J, Jeon K, Lee N Y, ?et al . Clinical significance of differentiation of ?Mycobacterium massiliense ?from ?Mycobacterium abscessus ?[J]. Am J Respir Crit Care Med, 2011, 183: 405.
[28] Tseng C Y, Sun M F, Li T C, ?et al . Effect of coptis chinensis on biofilm formation and antibiotic susceptibility in ?Mycobacterium abscessus ?[J]. Evid Based Complement Alternat Med, 2020, 2020: ?9754357.
[29] Rossi G G, Guterres K B, Bonez P C, ?et al . Antibiofilm activity of nanoemulsions of ?Cymbopogon flexuosus ?against rapidly growing mycobacteria [J]. Microb Pathog, 2017, 113: 335.
[30] Lima V J, Zagmignan A, Lima L L F, ?et al . Hydroalcoholic extract and ethyl acetate fraction of bixa orellana leaves decrease the inflammatory response to ?Mycobacterium abscessus ?Subsp. ?massiliense ?[J]. Evid Based Complement Alternat Med, 2018, 2018: 6091934.
[31] Dupont C, Viljoen A, Dubar F, ?et al . A new piperidinol derivative targeting mycolic acid transport in ?Mycobacterium abscessus ?[J]. Mol Microbiol, 2016, 101: 515.
[32] Degiacomi G, Chiarelli L R, Recchia D, ?et al . The antimalarial mefloquine shows activity against ?Mycobacterium abscessus , inhibiting mycolic acid metabolism [J]. Int J Mol Sci, 2021, 22: 8533.
[33] Dokic A, Peterson E, Arrieta-Ortiz M L, ?et al . ?Mycobacterium abscessus ?biofilms produce an extracellular matrix and have a distinct mycolic acid profile [J]. Cell Surf, 2021, 7: 100051.
[34] Kouidhi B, Al Qurashi Y M, Chaieb K. Drug resistance of bacterial dental biofilm and the potential use of natural compounds as alternative for prevention and treatment [J]. Microb Pathog, 2015, 80: 39.

